提示
前言
神经肿瘤是颅内常见病,主要包括神经上皮肿瘤、脑膜瘤、转移瘤及淋巴瘤等。从483期开始将刊发“第二轮神经肿瘤系列”,与同道共享,欢迎大家批评指正和交流讨论。
病例简介
患者男,68岁,因“头晕、头痛3月余”入院。
患者于3月前逐渐出现头晕、头痛等症状,头痛呈持续性、不剧,主要为额部及后枕部,无意识障碍、行走不稳、大小便失禁、恶心呕吐等其他症状。遂至当地医院就诊查,头颅CT示“左侧枕骨内占位,考虑骨肿瘤性病变”,未处理。现来我院就诊,门诊拟“颅内占位性病变”收住入院。
入院查体:神清,精神软,双侧瞳孔3mm,对光反射灵敏,口角不歪,对答切题,四肢肌力V级,双侧肢体深浅感觉对称存在,指鼻试验阴性,双侧巴氏征阴性。
既往史:2017年于我院有胸骨柄、肋骨 “浆细胞瘤”手术切除史。
诊疗经过
入院后完善术前检查检验,头颅增强MRI(图1)和三维重建CT(图2)提示:“左枕骨骨质破坏伴软组织肿块,考虑淋巴造血系统来源肿瘤,浆细胞瘤可能”。为进一步明确左侧横窦及乙状窦的侵犯情况,予完善MRV检查(图3),结果提示:“左侧乙状窦及左侧颈内静脉未见显影”。
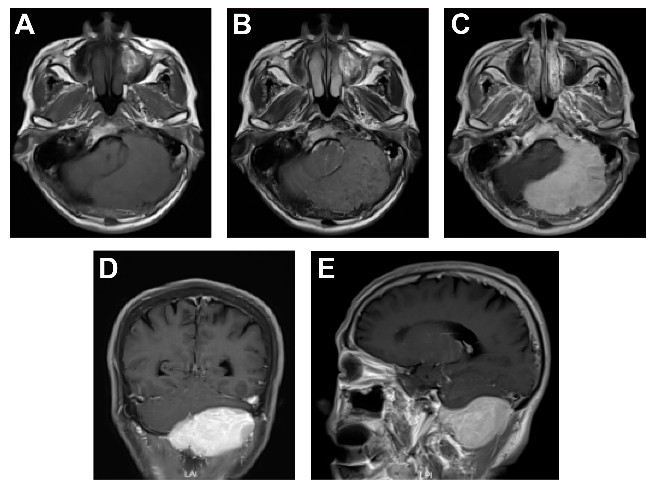
图1.头颅增强MRI提示左侧枕骨内占位,(A)T1呈等或稍低低信号,(B)T2呈等或稍高信号,(C,D,E)增强扫描呈明显均匀强化,浆细胞瘤首先考虑。
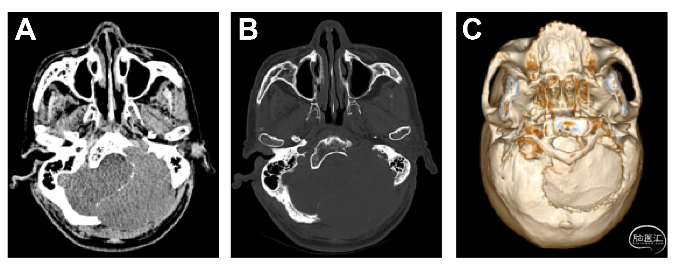
图2.头颅三维重建CT提示(A,B)左枕骨骨质破坏伴软组织肿块,(C)三维重建显示肿块向上至项上线,向下至枕骨大孔,向内跨过中线,向外至乙状窦。
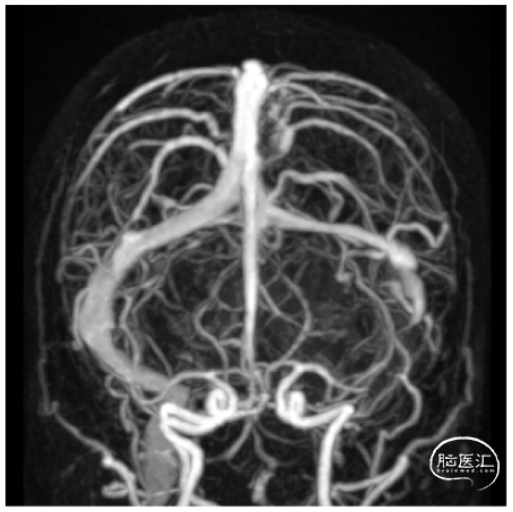
图3. 磁共振静脉造影检查(MRV)提示:左侧乙状窦及左侧颈内静脉未见显影。
根据上述检查结果,以及患者胸骨柄、肋骨浆细胞瘤既往史,诊断考虑:左侧枕骨内占位、浆细胞瘤首先考虑。同时,患者术前相关检验结果未提示明显的高钙血症、贫血和肾功能损害等CRAB症状。考虑到该占位已对脑组织产生明显压迫,经科室讨论及与家属的充分沟通后决定先行手术切除。
患者于2025年2月20日行“颅底病损切除术+颅底重建再造术”。
手术简要经过:术者逐层分离枕部肌肉后见肿瘤,其血供丰富,质地软,位于后枕部颅底。为进一步明确肿瘤边界逐步暴露周边正常颅骨。待完全暴露肿瘤表面后,从肿瘤顶部边界分离,见肿瘤血供主要来自硬膜、周边颅骨板障,并于硬膜粘连明显。于显微镜下逐步离断肿瘤的硬膜基底,在超声吸引辅助下大部分切除肿瘤后,进一步分离中线对侧的肿瘤边界以及枕骨大孔区的肿瘤边界予切除,再分离切除乳突下乙状窦下肿瘤,最后分离切除侵袭枕髁肿瘤,最终实现全切肿瘤。肿瘤切除后予钛链、钛钉以及骨科水泥行颅底再造。
术后予头孢呋辛钠预防感染,辅以止痛、止吐、护胃等对症支持治疗。
术后行头颅增强MRI(图4)及CT(图5)提示肿瘤基本全切,颅底重建完好,无积血积液等情况。
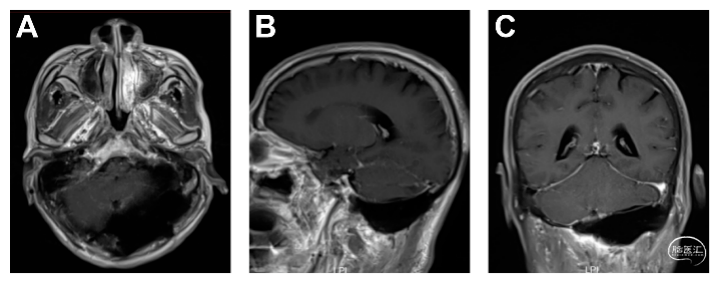
图4.头颅增强MRI提示肿瘤基本全切,且术区无明显积血、积液、积气。
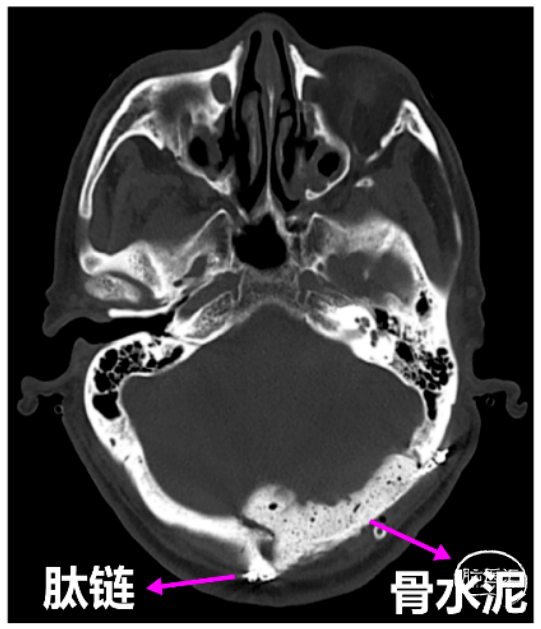
图5. 肽链联合骨水泥行颅底重建示意图。
病理结果
常规病理结果(图6)提示:(颅骨肿瘤)见弥漫增生浆样细胞,结合病史,考虑浆细胞瘤。
免疫组化:B7-06(颅骨肿瘤):MUM1(+),CD10(-),CD20(个别+),CD3(散在+),CD30(-),CD5(散在+),CD79a(部分+),GFAP(-),CD19(-),Ki-67(30%+),p53(-),EBER ISH(阴性),CD138(部分+), CD38(+),Kappa(弥漫+),Lambda(散在+),EMA(-)。
图6. 常规病理结果。
术后患者恢复良好,于2025年2月26日出院。出院情况:神清,精神可,双侧瞳孔3mm,对光反射灵敏,口角不歪,对答切题,四肢肌力V级,双侧肢体深浅感觉对称存在,指鼻试验阴性,双侧巴氏征阴性,伤口敷料清洁无明显渗血渗液。此外,考虑到“浆细胞瘤”属于淋巴及血液系统肿瘤,为进一步明确其具体分型,建议患者至血液科进一步治疗。
讨论
浆细胞瘤(Plasmacytoma)是一类以分泌免疫球蛋白的浆细胞异常增生为特征的恶性肿瘤,WHO中枢神经系统肿瘤分类把浆细胞瘤归属于淋巴瘤和造血系统肿瘤。根据累及范围可分为以下两类:孤立性浆细胞瘤(Solitary Plasmacytoma,SP)和多发性骨髓瘤(multiple myeloma,MM)[1]。SP是指单发性的浆细胞肿瘤,局限于骨骼(骨孤立性浆细胞瘤)或软组织(髓外浆细胞瘤),无多发性骨髓瘤(MM)的系统性表现(CRAB症状:高钙血症、肾功能不全、贫血、骨病)[2,3]。其中,骨孤立性浆细胞瘤常见于脊柱、骨盆等中轴骨,其临床特点包括骨痛、病理性骨折,但血和尿中无单克隆蛋白,主要累及造血活跃部位,除孤立性病灶外,全身X射线检查无其他病灶发现,骨髓检查无浆细胞增生现象[4,5]。髓外浆细胞瘤是浆细胞在骨外或者髓外形成的肿瘤,好发于头颈部(如鼻咽、扁桃体),占所有浆细胞瘤的3-5%[6]。SP的诊断标准为:单发浆细胞克隆性增殖(活检证实);骨髓浆细胞比例<10%,无终末器官损伤(CRAB症状);无血清/尿M蛋白或仅少量存在。而MM是指发生在骨髓的多灶性浆细胞恶性肿瘤,其特点为血清中存在单克隆蛋白、骨髓溶解性破坏、病理性骨折、出现全身CRAB症状等,主要累及骨髓中造血活跃部位[7]。MM的诊断标准为:骨髓中浆细胞占比≥10%且有相关的CRAB症状,或者骨髓中浆细胞占比≥60%,并且同时存在单克隆免疫球蛋白或尿中Bence Jones蛋白。在治疗方面,孤立性浆细胞瘤主要治疗方式是放疗,5年生存率>70%,约50%进展为MM,需长期随访。而MM的治疗方式主要为化疗,预后较差。
颅内浆细胞瘤是一种罕见的肿瘤,发生位置可分为骨内和骨外。骨内浆细胞瘤常见于斜坡、蝶鞍、颞骨岩部、额顶骨和枕骨等部位;而骨外浆细胞瘤通常被认为起源于脑膜或Virchow-Robin间隙的网状细胞,主要发生在硬脑膜上,且在脑实质中出现的情况相对较为罕见[8-10]。其临床症状不仅包括前述的全身表现,且与肿瘤的具体位置和大小密切相关。在CT扫描中,颅内浆细胞瘤的影像学特点主要表现为:局部骨质破坏,以溶骨性损害为主,边缘颅骨呈现“八”字形或分叉状;在颅骨破坏后,原始颅板的轮廓依然可分辨,没有骨质增生或硬化的表现;可能形成软组织肿块,肿块穿越内外板,形成双凸型,边界清晰,整体密度高于脑实质,且内部密度可能不均。在MRI扫描中,表现为:T1信号为等信号或稍低,T2信号为等信号或稍高,信号可能均匀或混杂;增强扫描中病灶明显强化,信号均匀;肿瘤内部可能出现“微型脑征”,这可能是反映了病灶内残留骨嵴,形成类似脑沟或脑回的表现;邻近的脑膜也可能出现强化现象。在诊断颅内浆细胞瘤时,需要与以下几种颅内肿瘤相鉴别:(1)脑膜瘤:多为广基底,常出现“脑膜尾征”,通常引起周围骨质增生而非破坏。(2)脊索瘤:好发于斜坡和鞍区,MRI上T2信号高,肿瘤内部可见点状出血或散在钙化,增强扫描呈不均匀。(3)软骨肉瘤:多发生于颅底软骨结合处,MRI表现为T1低信号、T2信号不均匀高,增强扫描可见“分隔状”表现。
根据术前检查及检验结果,本例患者暂未出现明显的全身症状,而局部肿瘤占位效应明显,已导致患者出现头晕、头痛等神经损害,故考虑直接行手术切除。术中可见肿瘤血供丰富,与周围硬膜粘连明显,因而术者推荐分块逐步切除肿瘤,并尽量保证硬膜完好,预防脑脊液漏等相关风险。值得一提的是,在本例手术中术者使用肽链作为支架,利用骨水泥对枕骨进行了重建,获得良好效果,术后未见明显积血、积液,且局部骨质平整、美观。骨水泥用于颅骨缺损修补的优点颇多,包括:骨水泥具有优良的生物相容性,能与周围组织有效整合,填补颅骨缺损;骨水泥在应用后迅速固化,能够在短时间内提供强度和稳定性,加快术后患者的恢复;骨水泥具有优良的机械强度,能够承受额外的生理压力,确保颅骨的功能性;骨水泥的密度与正常骨组织非常接近,便于医生进行后续评估和监测;相较于其他重建材料,骨水泥的成本较低,降低了整体手术费用;并且可根据手术过程中实际需要进行调整和塑形,以确保重建的精确性。其适用于包括肿瘤切除后缺损、创伤性颅骨骨折和先天性畸形等多种颅骨骨质缺损情况[11,12]。最后,考虑到“浆细胞瘤”属于淋巴及血液系统肿瘤,为进一步明确其诊断,建议患者至血液科进一步治疗。
参考文献
往期回顾
声明:脑医汇旗下神外资讯、神介资讯、神内资讯、脑医咨询、Ai Brain 所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。







