导读:
在阿尔茨海默病(AD)领域,早期诊断意义重大。当前,脑脊液中Aβ肽和p-tau蛋白检测是重要诊断手段,血浆检测因微创等优势在研究中兴起。但tau蛋白磷酸化复杂,其生理病理作用及多位点磷酸化检测和诊断价值待探索。意大利佩鲁贾大学 Anna L. Wojdała团队近期在《Nature Communications》期刊发表了题为“Immunoassay detection of multiphosphorylated tau proteoforms as cerebrospinal fluid and plasma Alzheimer’s disease biomarkers” 的文章。该团队研究人员假设双位点磷酸化p-tau蛋白诊断价值更高,并开发两种免疫分析法检测脑脊液和血浆中特定双位点磷酸化tau蛋白。技术上,两种方法性能良好。研究对两个队列深入研究,结果显示多数相关蛋白水平在AD组相对神经系统疾病对照组显著升高,血浆p-tau181&231无此差异。诊断性能上,血浆p-tau217&231 出色,优于单一位点磷酸化检测。该研究证实p-tau217&231 作为AD生物标志物潜力,提示脑脊液和血浆中tau蛋白磷酸化模式有差异。未来需更大规模研究探索tau蛋白磷酸化,推动 AD 早期诊断与治疗发展。

阿尔茨海默病(AD)是最常见的神经退行性疾病,对全球公共健康的冲击日益加剧。随着首批可改变疾病进程的疗法逐渐问世,尽早诊断阿尔茨海默病,尤其是在临床症状出现之前,显得尤为重要。通过脑脊液(CSF)检测β-淀粉样蛋白(Aβ)肽和不同位点磷酸化tau蛋白(主要为苏氨酸181位点(p-tau181)、205位点(p-tau205)、212位点(p-tau212)、217位点(p-tau217)和231位点(p-tau231)),可以高度准确地识别阿尔茨海默病,有效区分AD患者与对照组及其他神经退行性疾病。
得益于超灵敏技术的发展,这些技术扩展了体液中可测量蛋白质浓度的范围,过去十年间,探索血液衍生基质中AD生物标志物诊断潜力的研究显著增加。与脑脊液采集相比,血液采样是一种侵入性较小的程序,无需特定的专业知识或设备,广泛的医疗专业人员均可操作。重要的是,血液允许重复采样,这对于纵向研究以及监测疾病修饰疗法的效果至关重要。与CSF中的发现类似,在血浆中测量的几种磷酸化形式的tau(p-tau181、p-tau205、p-tau212、p-tau217、p-tau231)在AD连续体的不同阶段具有很高的诊断价值。然而,已鉴定出多种tau蛋白的翻译后修饰(PTMs),包括超过50个磷酸化位点,其在生理和病理中的重要性尚未完全理解。值得注意的是,最近的研究提出了tau蛋白过度磷酸化可能是随着阿尔茨海默病(AD)进展而加剧的生理过程这一问题。此外,有人提出了一种针对AD的tau蛋白分期模式,其中特定位点的磷酸化变化随疾病进展而发生,并随着时间推移呈现不同的轨迹。进一步而言,同时测量不同位点磷酸化的tau蛋白的诊断和预后价值尚未被探索,以及与单一磷酸化位点的tau蛋白形式相比的附加价值也未明确。
为了研究多磷酸化tau蛋白作为阿尔茨海默病(AD)生物标志物在人体体液中的潜力,作者团队开发了两种夹心免疫分析方法,分别检测同时在T181和T231位点磷酸化的tau蛋白(p-tau181&231;C231D181分析法)以及在T217和T231位点磷酸化的tau蛋白(p-tau217&231;C231D217分析法)。随后,他们在来自不同临床阶段的阿尔茨海默病患者、额颞叶痴呆(FTD)患者以及神经疾病对照组(NDC)的匹配脑脊液和血浆样本中测量了p-tau181&231和p-tau217&231。
结果1 夹心免疫分析方法技术验证
C231D181 检测的技术验证包括了 8 点标准曲线,其中肽类标准品稀释液(1:2)的浓度范围从 80 pg/mL 到 1.25 pg/mL,并包含一个不含肽类标准品的空白对照(补充表 2)。C231D181 检测的定量下限 (LLOQ) 和定量上限 (ULOQ) 分别为 1.25 pg/mL 和 80 pg/mL(补充表 3)。批内和批间变异系数 (CV%) 分别为 10% 和 3%(补充表 4, 5)。在两台不同仪器上评估的稀释线性结果良好(仪器 1 的 CV%:11%,仪器 2 的 CV%:6%;测试了 1x、2x、4x、8x、16x 和 32x 稀释的加标样品)(补充表 6)。C231D181 检测的加标回收率评估显示中等回收率:低加标为 69%,高加标为 87%(补充表 7)。使用单磷酸化肽混合物进行检测时,结果显示为空白信号水平,表明双磷酸化是形成免疫复合物并产生信号的必要条件(补充表 8)。C231D217 检测的 8 点标准曲线包括肽类标准品稀释液(1:3),其浓度范围从 40 pg/mL 到 0.05 pg/mL,并包含一个不含肽类标准品的空白对照(补充表 9)。C231D217 检测的定量下限 (LLOQ) 和定量上限 (ULOQ) 分别为 0.05 pg/mL 和 40 pg/mL(补充表 10)。批间和批内变异系数 (CV%) 分别为 7% 和 4%(补充表 11, 12)。在两台不同仪器上评估的稀释线性结果良好(仪器 1 的 CV%:2%,仪器 2 的 CV%:3%;测试了 2x、4x、8x、16x 和 32x 稀释的加标样品)(补充表 13)。C231D217 检测的加标回收率评估结果显示:低加标为 72%,高加标为 84%(补充表 14)。
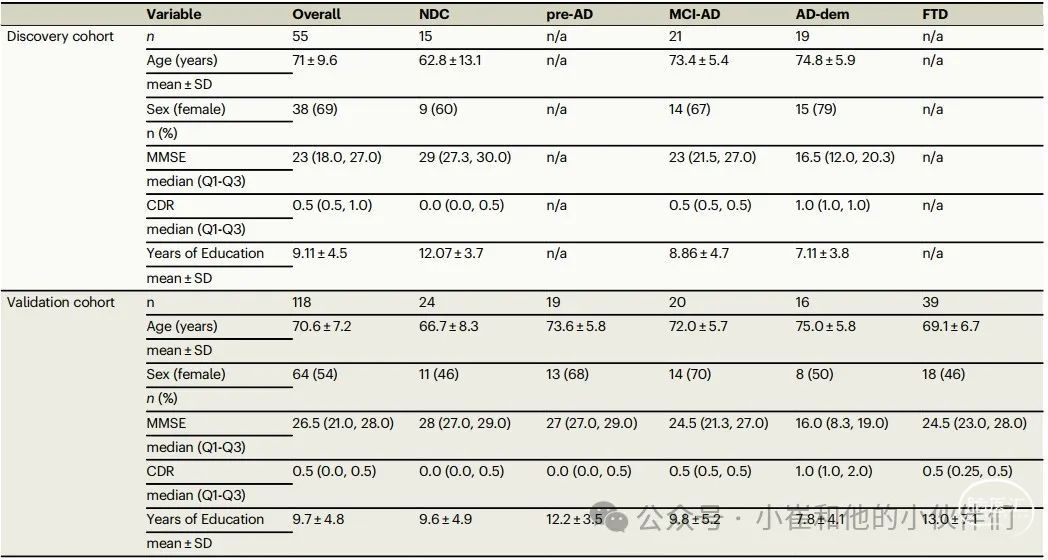
两个队列的人口统计学和临床参数见表 1。除了预期的MMSE和CDR差异外,发现队列和验证队列中不同临床组别的年龄差异也具有统计学意义(发现队列:NDC与MCI-AD p≤0.01,NDC与AD-痴呆 p≤0.001;验证队列:NDC与pre-AD p≤0.05,NDC与AD-痴呆 p≤0.01,AD-痴呆与FTD p≤0.05)。在所有队列中,各临床组别之间的性别差异无统计学意义。
表1 | 发现队列和验证队列的人口统计学和临床特征概况
如在发现队列中所评估,血浆p-tau181&231 与脑脊液和血浆中的p-tau181、p-tau231或其脑脊液对应物(脑脊液p-tau181&231)无相关性(图 1a)。相反,脑脊液和血浆中的p-tau217&231 均与脑脊液和血浆中的 p-tau217 和 p-tau231 水平表现出强烈的正相关(Spearman 相关性分析)(图 1a, b)。

图1 | 脑脊液和血浆中 p-tau181、p-tau217、p-tau231、p-tau181&231 以及 p-tau217&231 之间的相关性
P-tau181、P-tau231和P-tau181&231:在发现队列中,与无认知障碍(NDC)组相比,轻度认知障碍阿尔茨海默病(MCI-AD)和阿尔茨海默病痴呆(AD-dem)组的脑脊液(CSF)和血浆中的p-tau181、p-tau231以及CSF中的p-tau181&231水平均显著升高(图 2a)。血浆中的p-tau181&231水平在NDC组和阿尔茨海默病连续体各组之间没有显著差异(图 2b,补充图2)。
在发现队列中测量的CSF p-tau181、p-tau231和p-tau181&231在区分NDC和阿尔茨海默病方面表现出高准确性(受试者工作特征曲线下面积(AUC)范围为0.986–1.000;补充表15)。在血浆中,p-tau231在区分NDC与MCI-AD及AD-dem方面表现最佳(血浆p-tau231 NDC vs. MCI-AD AUC = 0.925,95% CI 0.840–1.000;NDC vs. AD-dem AUC = 0.947,95% CI 0.872–1.000),其次是p-tau181(血浆p-tau181 NDC vs. MCI-AD AUC = 0.877,95% CI 0.761–0.993;NDC vs. AD-dem AUC = 0.943,95% CI 0.857–1.000)(补充表15, 16)。对于血浆p-tau181&231的ROC分析显示,在区分NDC与MCI-AD(AUC = 0.514,95% CI 0.320–0.709)和NDC与AD-dem(AUC = 0.579,95% CI 0.383–0.775)方面表现较差(补充表15, 16)。
在发现队列中进行的中位浓度倍数变化分析(AD连续组的中位浓度除以对照组的中位浓度)显示,脑脊液和血浆中的p-tau231具有最高的倍数变化(补充表17)。所有脑脊液比较均显示出较大的标准化效应量(Cohen’s d >0.8)(图 2a)。在血浆中,p-tau231显示出较大的效应量,而p-tau181显示出中等效应量(d>0.5),而p-tau181&231的效应量则微乎其微(d< 0.2)(图 2b)。对于p-tau217、p-tau231和p-tau217&231,在发现队列中,与对照组相比,MCI-AD和AD-痴呆组的脑脊液和血浆水平均显著升高(图2,补充图2)。

图2 | 在发现队列中,脑脊液和血浆 p-tau181、p-tau217、p-tau231、p-tau181&231 以及 p-tau217&231 的诊断性能
针对发现队列中脑脊液 p-tau217、p-tau231 及 p-tau217&231 进行的 ROC 分析显示,这些指标在区分正常认知 (NDC) 和阿尔茨海默病连续阶段 (AD continuum stages) 方面具有高准确性(AUC 范围为 0.986–1.000;补充表 15)。在血浆中,p-tau217&231 在区分 NDC 与轻度认知障碍阿尔茨海默病 (MCI-AD)(AUC = 0.993,95% CI 0.974–1.000)以及 NDC 与阿尔茨海默病痴呆 (AD-dem)(AUC = 0.964,95% CI 0.898–1.000)方面表现出最佳能力(补充表 15, 16)。在针对 NDC 与所有合并的阿尔茨海默病连续阶段组(MCI-AD 和 AD-dem)进行的 ROC 分析中,血浆 p-tau217&231 的名义 AUC 最高(AUC = 0.979,95% CI 0.945–1.000),在所比较的血浆标志物中表现最优,但与血浆 p-tau217 或 p-tau231 的 AUC 值相比无统计学显著差异(图 3a)。根据患者脑脊液 AT 档案进行的 ROC 分析显示,血浆 p-tau217&231 在所比较的检测方法中具有最高的名义 AUC 值(A+ vs. A- AUC = 0.979,95% CI 0.945–1.000;A + T+ vs. 其他 AUC = 0.973,95% CI 0.934–1.000),并产生了最高的标准化效应量(补充图 1)。在发现队列中,p-tau217&231(C231D217 检测)在脑脊液和血浆中的中位浓度变化倍数(AD 连续阶段组 vs. NDC)高于所有其他标志物(补充表 17)。在脑脊液和血浆的所有临床组比较中均观察到较大的标准化效应量(图 2)。
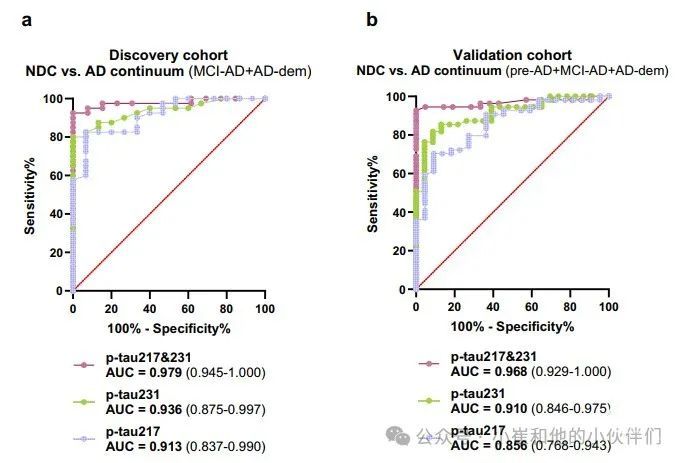
图3 | 血浆 p-tau217、p-tau231 及 p-tau217&231 的 ROC 分析
P-tau181、P-tau231和P-tau181和231:在验证队列中,与对照组相比,AD前、MCI-AD和AD-dem组的CSF ptau181、P-tau231和P-tau181和231水平持续升高(P≤0.0001)(图4,补充图2)。NDC和FTD之间的CSF p-tau181、p-tau231和p-tau181和231水平没有显著差异(图4,补充图2)。
针对脑脊液中 p-tau181、p-tau231 和 p-tau181&231 的 ROC 分析在验证队列中进行,确认了这三种检测方法在区分 NDC(无认知障碍)与 MCI-AD(轻度认知障碍阿尔茨海默病)以及 NDC 与 AD-dem(阿尔茨海默病痴呆)方面具有高准确性(AUC 范围 = 0.991–1.000;补充表 15, 16)。此外,NDC 与 pre-AD(阿尔茨海默病前期)的 ROC 分析也显示每种检测方法均获得了较高的 AUC 值(脑脊液 p-tau181:NDC vs. pre-AD AUC = 0.970,95% CI 0.929–1.000;脑脊液 p-tau231 AUC = 0.991,95% CI 0.972–1.000;脑脊液 p-tau181&231 AUC = 0.982,95% CI 0.951–1.000)。测量脑脊液中的 p-tau181、p-tau231 和 p-tau181&231 可有效区分 AD-dem 和 FTD(额颞叶痴呆)(AUC 范围 = 0.968–0.978)(补充表 15)。
在验证队列中,对 AD 连续体各组与 NDC 的中位浓度倍数变化分析确认了在发现队列中观察到的趋势,即脑脊液和血浆 p-tau231 显示最高的中位浓度倍数变化(脑脊液 p-tau231:发现队列 AD-dem/NDC = 5.39;验证队列 AD-dem/NDC = 5.72;血浆 p-tau231:发现队列 AD-dem/NDC = 6.02;验证队列 AD-dem/NDC = 2.56;补充表 17)。最大的标准化效应量出现在脑脊液 p-tau181、p-tau231 和 p-tau181&231 以及血浆 p-tau231(图 4)。血浆 p-tau181 在所有临床组比较中表现出中等效应量(pre-AD/NDC = 0.40,MCI-AD/NDC = 0.26,AD-dem/NDC = 0.29)(图 4)。
在验证队列中,脑脊液和血浆中的 p-tau217、p-tau231 以及 p-tau217&231 水平在前阿尔茨海默病(pre-AD)、轻度认知障碍阿尔茨海默病(MCI-AD)和阿尔茨海默病痴呆(AD-dem)组中均显著升高,与对照组相比(图 4,补充图2)。而脑脊液或血浆中的 p-tau217、p-tau231 和 p-tau217&231 水平在非痴呆对照(NDC)和额颞叶痴呆(FTD)之间没有显著差异(图 4)。

图4 | 验证队列中脑脊液和血浆 p-tau181、p-tau217、p-tau231、p-tau181&231 以及 p-tau217&231 的诊断性能
针对验证队列中测量的脑脊液 p-tau217、p-tau231 和 p-tau217&231 进行的 ROC 分析确认了这三种检测方法在区分 NDC 和 AD 连续阶段方面具有高准确性(AUC 范围 = 0.927–1.000),其中脑脊液 p-tau217 在所有比较中显示出最高的 AUC 值(补充表 15)。ROC 分析显示,脑脊液 p-tau217、p-tau231 和 p-tau217&231 在区分 AD-痴呆与 FTD 方面也非常有效(AUC 范围 = 0.934–0.978)(补充表 15)。在血浆中,用于区分NDC和每个AD连续阶段的ROC分析显示,血浆p-tau217和231的标称AUC值高于血浆p-tau217和p-tau231(补充表15)。与血浆p-tau217 NDC与MCI-AD和NDC与AD dem的AUC相比,观察到显著差异,但与p-tau231相比没有差异(补充表16)。血浆ptau217、p-tau231和p-tau217&231的测量可以有效地区分AD dem和FTD(AUC范围=0.803-0.904)(补充表15)。
在NDC与所有联合AD连续组(AD前、MCI-AD和AD dem)的ROC分析中,血浆p-tau217和231的准确度最高,AUC为0.968 95%CI 0.929–1.000,与血浆p-tau218和p-tau231的AUC有显著差异(图3)。
血浆p-tau217&231在区分A+与A-组(AUC = 0.914,95% CI 0.855–0.973)以及A+ T+与其他组(AUC = 0.894,95% CI 0.831–0.957)时,也获得了最高的名义AUC值,这些分组是根据脑脊液AT特征定义的(补充图1),并且产生了最高的标准化效应量。
在验证队列中,血浆中位浓度倍数变化(AD连续组与NDC对比)的分析确认了发现队列中观察到的趋势,显示p-tau217和p-tau231的倍数变化值高于其他标志物(血浆p-tau217和p-tau231倍数变化:发现队列AD-痴呆/NDC = 13.63;验证队列AD-痴呆/NDC = 20.6;补充表17)。在脑脊液中,发现队列中p-tau217和p-tau231的最大中位浓度倍数变化为18.13(脑脊液p-tau217和p-tau231发现队列AD-痴呆/NDC = 18.13),而验证队列中p-tau217的最大中位浓度倍数变化为8.51(脑脊液p-tau217验证队列AD-痴呆/NDC = 8.51)(补充表17)。对于脑脊液和血浆中的p-tau217、p-tau231以及p-tau217和p-tau231组合,所有临床组比较均显示出较大的标准化效应量(图4)。
作者团队提出了一种同时靶向两个不同位点磷酸化tau的方法——T181和T231(ptau181和231;检测C231D181)或T231和T217(p tau217和231;测定C231D217)(图 5)。研究结果表明,CSF具有良好的AD生物标志物潜力,但血浆p-tau181和231没有。另一方面,作者团队提出ptau217和231作为一种极具前景的CSF和血浆生物标志物,其在血浆中的表现可能甚至优于血浆中的p-tau217或p-tau231。CSF和血浆之间观察到的差异表明了基质特异性蛋白质加工,值得进一步研究,包括评估tau蛋白在与已分析位点不同的位点同时磷酸化,并将临床验证扩展到更大的队列。

图5 | 免疫测定的设计
原文链接:
Wojdała AL, Bellomo G, Gaetani L, Teunissen CE, Parnetti L, Chiasserini D. Immunoassay detection of multiphosphorylated tau proteoforms as cerebrospinal fluid and plasma Alzheimer's disease biomarkers. Nat Commun. 2025 Jan 2;16(1):214.

编 译 / 程赫镭
校 审 / 蔡玉洁
声明:脑医汇旗下神外资讯、神介资讯、神内资讯、脑医咨询、Ai Brain 所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。




