文章来源:中国脑血管病杂志, 2024, 21(11):744-751.
作者:刘一铭 张峰 华扬 脑卒中高危人群筛查脑颈动脉规范化评估数据库课题组
作者单位:510655广州,中山大学附属第六医院超声科(刘一铭、张峰);首都医科大学宣武医院血管超声科(华扬)
通信作者:华扬,Email:dryanghua99@163. com;张峰,Email:zhangf56@mail.sysu.edu. cn
摘要:目的探索无心脑血管病危险因素者椎动脉优势(VAD)所致双侧椎动脉管径不对称程度与椎动脉起始段狭窄(VAOS)发生的相关性及诊断VAD的最佳管径差值(△D)截断值。方法回顾性连续性纳入2019年12月至2021年12月“脑卒中高危人群筛查脑颈动脉超声规范化评估数据库”中无高脂血症、高血压病、糖尿病、肥胖(体质量指数≥28kg/m2)、吸烟史、饮酒史等心脑血管病危险因素的非椎动脉闭塞受试者6404例。收集患者年龄、性别、体质量指数、双侧椎动脉管径△D及根据椎动脉起始段和椎间隙段的收缩期峰值流速和舒张末期流速评估的VAOS情况。将狭窄率≥50%的受试者划分为VAOS组,其余为对照组。比较两组一般资料及△D,将其中差异有统计学意义的项目作为自变量,以发生狭窄率≥50% VAOS作为因变量,进一步采用多因素Logistic回归分析,分析其独立影响因素。使用倾向性评分匹配对VAOS组和对照组按1∶5进行匹配,基于匹配后受试者以发生狭窄率≥50% VAOS为结局指标,以△D为自变量绘制受试者工作特征(ROC)曲线并计算曲线下面积(AUC),以约登指数计算△D的最佳截断值。结果纳入的6404例受试者中,男1975例,女4429例;其中VAOS组46例,VAOS发生率0.72%。(1)单因素Logistic回归分析结果显示,VAOS组的男性比例、年龄、体质量指数及△D均高于对照组(均P<0.05)。将以上变量进一步纳入多因素Logistic回归分析,结果显示,男性(OR=2.49,95%CI:1.36~4.67,P=0.003)、年龄(OR=1.14,95% CI:1.11~1.17,P< 0.01)及△D(OR=1.81,95% CI:1.06 ~ 2.97,P=0.024)均为发生狭窄率≥50% VAOS的危险因素。(2)倾向性评分匹配后,VAOS组纳入46例,对照组纳入230例,共276例。组间比较结果显示,VAOS组△D高于对照组[0.65(0.30, 1.20)mm比0.40(0.20,0.80)mm,P=0.009],余基线资料组间差异均无统计学意义(均P>0.05)。(3)基于倾向性评分匹配后的276例受试者,以发生狭窄率≥50% VAOS为结局指标、以△D为自变量绘制的ROC曲线分析结果显示,△D预测无心脑血管病危险因素者发生狭窄率≥50% VAOS的AUC为0.622,最佳截断值为0.800mm,特异度为78.3%,敏感度为41.3%。结论无心脑血管病危险因素者双侧椎动脉管径不对称程度与发生狭窄率≥50%的VAOS相关,△D最佳截断值为0.800mm,可作为定义VAD的参考标准,△D≥0.800mm提示发生狭窄率≥50% VAOS的风险较高(特异度78.3%、敏感度41.3%)。本研究结果有待进一步验证。
椎动脉是颅内后循环的重要供血主干,通常由左右两侧锁骨下动脉分别发出,穿过两侧颈椎的横突孔上行进入颅内[1]。椎动脉的解剖学变异十分常见,如起源异常、走行变异、管径不对称等。椎动脉管径不对称这一解剖学因素与后循环病变的关系一直以来都备受研究者关注,并衍生出椎动脉发育不良(vertebral artery hypoplasia, VAH)和椎动脉优势(vertebral artery dominance,VAD)两个概念。VAH一般定义为椎动脉管径≤2.0mm,主要关注管径纤细对血流灌注以及后循环供血的影响[2]。一般认为VAD是两侧椎动脉管径相差较大,主要关注双侧椎动脉不对称对基底动脉血管走行及后循环缺血性疾病的影响[3]。既往研究显示,VAH和VAD均与椎-基底动脉形态改变、管腔狭窄及后循环缺血的发生相关[4-5]。椎动脉是头颈部动脉中发生粥样硬化性狭窄的常见血管之一,其起始段是好发部位,狭窄发生率占椎-基底动脉系统的43%[1,6]。本团队近期的一项研究结果显示,VAD所致的管径不对称是发生椎动脉起始段狭窄(vertebral artery origin stenosis,VAOS)的危险因素[7]。然而,目前对VAD定义的标准在不同研究中存在差异,且既往针对VAD的临床研究主要关注其与后循环缺血(posterior circulation ischemic, PCI)的关系[3,8],尚未见以VAOS为结局对VAD的定义标准进行探讨的研究。因此,本研究拟对无心脑血管病危险因素者VAD所致的双侧椎动脉管径不对称程度与VAOS发生的关系进行进一步探讨,探索可预测VAOS的VAD最佳管径差截断值。
1 对象与方法
1.1 对象
回顾性连续纳入“脑卒中高危人群筛查脑颈动脉超声规范化评估数据库”中2019年12月至2021年12月行颈部动脉超声筛查的11255名受试者数据。本研究方案经中山大学附属第六医院医学伦理委员会审核批准(伦理号:2020ZSLYEC-315)。
纳入标准:(1)住院或门诊接受颈部动脉超声检查;(2)年龄18~80岁。
排除标准:(1)超声数据录入错误;(2)基线信息缺失;(3)椎动脉完全闭塞者;(4)由椎动脉管壁弥漫增厚引起的全程狭窄者;(5)有高脂血症(既往有高脂血症病史,或存在以下情况中任一项:血清低密度脂蛋白胆固醇≥3.12mmol/L,血清总胆固醇≥5.80mmol/L,三酰甘油≥2.25mmol/L)、高血压病(既往高血压病史,或住院期间在安静状态下间隔1周重复测量血压≥140/90mmHg)、糖尿病(既往糖尿病史,或入院后空腹血糖≥7.0mmol/L,或餐后2h血糖≥11.1mmol/L,或经糖耐量试验明确诊断者)、肥胖[体质量指数(body mass index,BMI)≥28kg/m2]、吸烟史(每天至少吸1支烟且连续或累积达6个月)、饮酒史(乙醇摄入量≥20g/d,超过5年)等心脑血管病危险因素者[9]。
1.2 仪器设备
超声检查采用日立-阿洛卡(日本)Ascendus、飞利浦(荷兰)Epiq7或飞利浦(荷兰)IU22彩色多普勒超声诊断仪,选择3.0~7.0MHz和(或)3.0~9.0MHz和(或)3.0~11.0MHz和(或)3.0~12.0MHz和(或)4.0~8.0MHz线阵探头。
1.3 数据收集
收集受试者的一般资料,包括年龄、性别及BMI数据;测量双侧椎动脉椎间隙段(V2段)内径并计算椎动脉管径差值(△D=D粗-D细)。
1.4 评价标准和定义
VAOS的诊断标准参照《中国脑卒中血管超声检查指导规范》[10],根据椎动脉起始段及椎间隙段的收缩期峰值流速(PSV)和舒张末期流速(EDV)评估VAOS狭窄率,并分为狭窄率<50%、50%~69%、70%~99%以及闭塞4个等级。具体诊断如下。狭窄率<50%:狭窄段流速PSV起始段≥85cm/s,PSV起始段/PSV椎间隙段≥1.3且EDV起始段≥27cm/s;狭窄率50%~69%:PSV起始段≥140cm/s,PSV起始段/PSV椎间隙段≥2.1且EDV起始段≥35cm/s;狭窄率70%~99%:PSV起始段≥220cm/s,PSV起始段/PSV椎间隙段≥4.0且EDV起始段≥50cm/s;闭塞:无血流信号;其中狭窄率≥70%的患者均为经过CT血管成像(CTA)或DSA证实。本研究将狭窄率≥50%的受试者划分为VAOS组[6],其余为对照组。
1.5 质量控制
超声检测流程及诊断标准参考《中国脑卒中血管超声检查指导规范》[10]制定标准化图像及数据采集流程,由多中心课题组各参与医院经过血管超声操作规范培训并通过相关考核的专业技术人员完成超声检测及相关数据采集。超声检测图像及数据统一上传至国家卫生健康委国家健康医疗大数据创新应用示范中心数据库。由研究发起单位3名高级职称超声科医师组成质量控制小组,按照“1.4”部分所述图像采集规范标准及诊断标准审查超声图像质量,不合格者均剔除。
1.6 统计学分析
使用R软件(4.2.1版本)进行数据统计分析。采用Kolmogorov-Smirnov方法对计量资料进行正态性检验,符合正态分布的计量资料用x-±s表示,组间比较使用t检验;不符合正态分布的计量资料使用中位数和四分位数[M(P25,P75)]表示,组间比较使用秩和检验;计数资料采用频数和百分比[例(%)]表示,组间比较采用χ2检验或Fisher确切概率法。比较两组一般资料及△D,将其中差异有统计学意义的项目作为自变量,以发生狭窄率≥50% VAOS作为因变量,进一步采用多因素Logistics回归分析其独立影响因素。使用倾向性评分匹配对VAOS组和对照组按1∶5进行匹配,基于匹配后受试者以发生狭窄率≥50% VAOS为结局指标,以△D为自变量绘制受试者工作特征(receiver operating characteristic, ROC)曲线并计算曲线下面积(area under the curve, AUC),以约登指数计算△D的最佳截断值。以P<0.05为差异具有统计学意义。
2 结果
2.1 研究对象纳入情况及一般资料
11255名接受颈部动脉超声筛查人群中,排除基线信息缺失或超声数据录入错误者122名,排除有心脑血管病危险因素的受试者4710例(其中高血压病2345例、高脂血症1060例、糖尿病1079例、肥胖639例、吸烟史2248例、饮酒史999例),排除椎动脉闭塞者19例,最终共纳入符合纳入排除标准的受试者6404例。其中男性1975例,占30.8%,女性4429例,占69.2%;年龄19~80岁,平均(43±13)岁;诊断VAOS者93例,包括狭窄率<50%者47例、50%~69%者24例、70%~99%者22例;将46例狭窄率≥50%的 VAOS患者纳入VAOS组,其余6358例纳入对照组,狭窄率≥50% VAOS发生率0.72%。
2.2 狭窄率≥50% VAOS相关危险因素的单因素及多因素Logistic回归分析
单因素Logistic回归分析结果显示,VAOS组的男性比例、年龄、BMI及△D均高于对照组(均P<0.05)。将以上变量进一步纳入多因素Logistic回归分析,结果显示,男性(OR=2.49,95% CI:1.36 ~ 4.67,P=0.003)、年龄(OR=1.14, 95% CI:1.11~1.17,P<0.01)及△D(OR=1.81, 95% CI:1.06 ~ 2.97,P=0.024)均为发生狭窄率≥50% VAOS的危险因素。见表1。
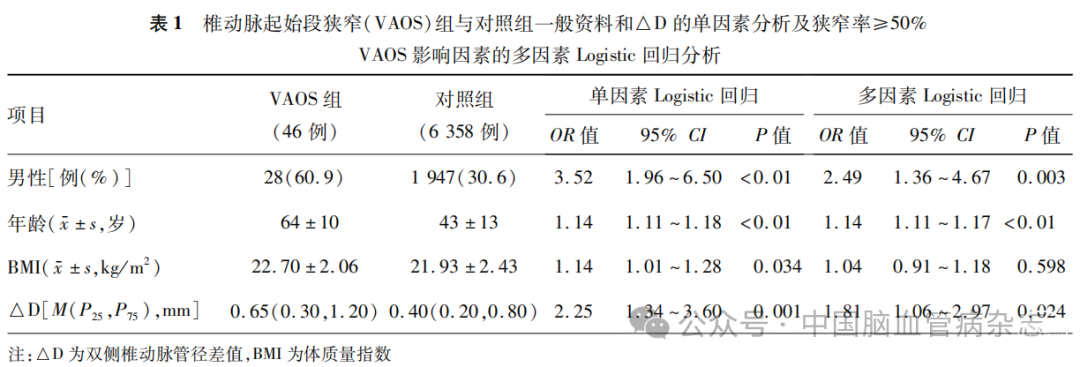
2.3 VAOS组与对照组倾向性评分匹配后基线比较
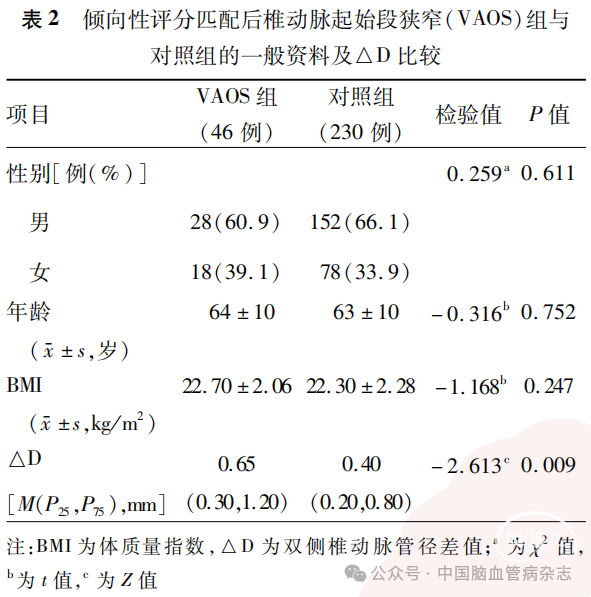
使用倾向性评分匹配VAOS组和对照组并按1∶5比例进行匹配后,VAOS组纳入46例,对照组纳入230例,共276例。组间比较结果显示,VAOS组△D高于对照组(P=0.009),余基线资料组间差异均无统计学意义(均P>0.05)。见表2。
2.4 △D预测狭窄率≥50% VAOS的ROC曲线分析
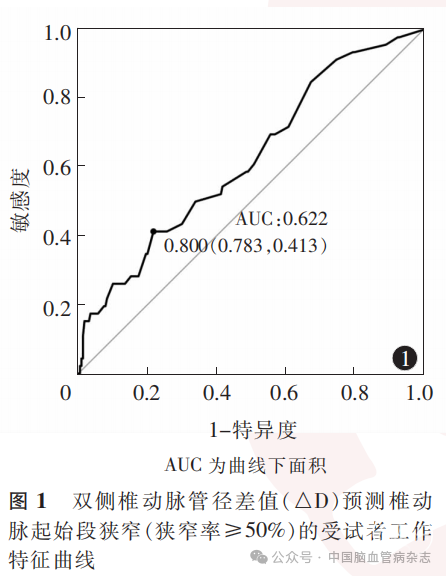
基于倾向性评分匹配后的276例患者,以发生狭窄率≥50% VAOS为结局指标、以△D为自变量绘制的ROC曲线分析结果显示,△D预测无心脑血管病危险因素者发生狭窄率≥50% VAOS的AUC为0.622,以约登指数选择的最佳截断值为0.800mm,特异度为78.3%,敏感度为41.3%。见图1。
3 讨论
椎-基底动脉系统(后循环)病变是导致缺血性卒中的重要原因之一[8]。研究显示,约24%(129/543)缺血性卒中与PCI有关,后循环缺血性卒中发病后1年内病死率为19%(24/129)、致残率为61%(79/129)[11]。Marquardt等[6]和Caplan等[12]的多中心研究结果显示,在后循环卒中患者中,VAOS(狭窄率≥50%)的发生率分别为26%(37/141)和32%(131/407)。1998年,Wityk等[13]纳入新英格兰医学中心后循环系统注册登记研究中407例PCI患者进行分析,结果显示,约9%(38/407)的后循环卒中由VAOS直接导致,包括:(1)VAOS引起动脉血栓栓塞(19例);(2)椎动脉低灌注导致PCI(13例);(3)近端椎动脉夹层(6例)。Zhu等[3]在一项研究中对78例VAD(双侧椎动脉管径△D≥1.2mm)患者和68例非VAD患者进行分析,结果显示,VAD组PCI发生率高于非VAD组[46.2%(36/78)比20.6%(14/68),P= 0.001]。既往关于椎动脉不对称性的研究,其研究结局多为PCI相关临床事件(如小脑、脑干梗死等)[3,14-15]。VAOS作为PCI的重要影响因素,可能也会受到椎动脉不对称的影响,并且可能是椎动脉不对称导致PCI的一个中间变量。
既往研究认为,VAH(任意一侧椎动脉管径≤2.2mm)与PCI相关,Chi等[14]对210例前循环梗死和143例后循环梗死患者进行比较,结果显示,后循环梗死组VAH的发生率高于前循环梗死组[44.76%(64/143)比22.38%(47/210),P<0.01]。本团队既往研究显示,VAOS组(任意程度的VAOS;547例)患侧椎动脉V2段管径较正常组(无VAOS;9889例)相应侧别的椎动脉管径更粗[3.5(3.1,3.8)mm比3.2(2.9,3.5)mm,P<0.01],VAOS组患者中椎动脉管径纤细(≤2.5mm)的发生率与正常组比较差异无统计学意义[14.8%(81/547)比12.3%(1218/9889),P= 0.086][16]。Şahin和Gökçe[17]将VAD定义为双侧椎动脉管径不相等或其中一侧以更小的角度汇入基底动脉,结果显示,右侧VAD患者中同侧VAOS发生率较左侧VAD患者高[25.5%(14/55)比16.5%(17/103),P=0.044]。本团队另一项研究结果也显示,VAD(双侧椎动脉管径△D≥1.2mm)与VAH(管径≤2.0mm)均在单因素分析中与VAOS的发生有关(VAD:OR=2.73,95%CI:1.70~4.23,P< 0.01;VAH:OR=3.05,95%CI:1.27~6.22,P< 0.01),但在多因素Logistic分析中,仅VAD是发生VAOS的独立危险因素(VAD:OR=2.14,95% CI:1.30~3.40,P< 0.01;VAH:OR=1.59,95% CI:0.59 ~ 3.79,P=0.321)[7]。因此,单纯关注VAH或管径纤细因素可能无法反映解剖因素与VAOS的真实关系,VAD所致的双侧椎动脉管径不对称性对VAOS所产生的影响可能更应关注。
本研究中VAOS均基于彩色多普勒超声血流动力学参数进行诊断,彩色多普勒超声对VAOS的诊断效能已在既往研究中证实[18-19]。一项荟萃分析显示,以DSA为诊断VAOS的“金标准”,磁共振血管成像(MRA)、CT血管成像和彩色多普勒超声诊断VAOS(狭窄率≥50%)的特异度分别为94.8%、95.2%和97.7%,敏感度分别为93.9%、100%和70.2%[18]。Hua等[19]研究显示,以DSA结果为参考标准,彩色多普勒超声基于血流动力学参数诊断椎动脉起始段不同狭窄程度的准确率分别为94.5%(狭窄率<50%)、96.2%(狭窄率50%~69%)、88.7%(狭窄率70% ~ 99%)。
VAOS的发生与多种疾病或因素相关,如吸烟史、高血压病、糖尿病、冠心病、饮酒史以及肥胖等[20]。张峰等[16]研究纳入10436名参与颈部动脉粥样硬化筛查者分析影响VAOS(任意程度的VAOS)发生的危险因素,结果显示,高血压病(OR=1.90,95% CI:1.65~2.31,P<0.01)、吸烟史(OR=1.91,95% CI:1.53~2.37,P< 0.01)、高脂血症(OR=1.30,95% CI:1.01 ~ 1.65,P<0.05)及糖尿病(OR=1.44, 95% CI:1.14~1.80,P< 0.01)均为VAOS发生的独立危险因素。本研究主要关注椎动脉不对称程度对VAOS发生的影响,为了避免心脑血管疾病危险因素的干扰,我们从“脑卒中高危人群筛查脑颈动脉超声规范化评估数据库”中筛选了无心脑血管疾病危险因素的人群,并考虑到椎动脉闭塞可能导致的管腔负性重构,从而影响结果分析,因此本研究中也剔除了椎动脉闭塞的患者。
本研究结果显示,VAOS组的椎动脉管径△D大于对照组[0.65(0.30,1.20)mm比0.40(0.20,0.80)mm,P=0.001];多因素Logistic分析结果显示,男性、年龄和△D均为VAOS发生的危险因素,说明△D与VAOS发生存在相关性。动脉粥样硬化性病变的发生与血管内局部血流动力学环境密切相关[21]。Mysior和Stefańczyk[22]对113名无动脉粥样硬化及椎-基底动脉相关病史的志愿受试者的双侧椎动脉超声参数进行分析,结果显示,随着管径不对称比值[diameter asymmetry ratio,DAR;DAR=(D粗-D细)/D粗×100%]增大,PSV比值(PSV粗/PSV细)和EDV比值(EDV粗/EDV细)均呈现增大的趋势(DAR0~25%:PSV比值=1.09,EDV比值=1.27;DAR26% ~ 50%:PSV比值=1.45,EDV比值=1.47; DAR51%~100%:PSV比值=1.46, EDV比值=3.48;DAR>100%:PSV比值=2.19, EDV比值=4.76),提示双侧管径不对称程度影响了血流动力学的平衡。Chen等[23]将186例PCI患者分为VAD组(双侧椎动脉管径△D≥0.03cm;122例)和非VAD组(64例)并比较其血流动力学参数,结果显示,VAD组内较粗侧椎动脉与较细侧椎动脉相比,PSV和EDV均更高[PSV:(49.57 ± 17.22)cm/s比(42.84 ± 15.15)cm/s,P=0.034;EDV:(17.59 ± 6.94)cm/s比(13.5 ± 4.95)cm/s,P= 0.023]。赵洪明等[24]通过计算机对颈部血管内血流动力学进行模拟分析,结果显示,椎动脉起始部存在低速涡流。局部不稳定的血流动力学环境会改变血流对血管壁内皮细胞的剪应力,从而导致内皮细胞功能异常,促使进一步向动脉粥样硬化发展[21]。因此双侧椎动脉管径不对称所导致的双侧椎动脉血流动力学不平衡可能是加速椎动脉起始段粥样硬化发展进程的重要因素[7]。
目前针对VAD的定义和研究仍存在一定局限性。Mysior和Stefańczyk[22]的研究关注于无动脉粥样硬化及椎-基底动脉相关病史人群中VAD所致血流动力学变化,缺乏与临床事件的关联。Hong等[15]定义VAD为双侧椎动脉管径△D≥ 0.3mm,或两侧椎动脉直径相当时,与基底动脉连接更直接的一侧为优势椎动脉,结果表明,VAD所产生的血流动力学不平衡导致了基底动脉迂曲。Zhu等[3]对167例有PCI症状的患者进行分析,以双侧椎动脉管径△D≥1.2mm为标准定义VAD,结果显示,VAD是后循环梗死的危险因素。上述研究所关注的结局均不相同,在VAD定义标准的选择上也存在差异,均未进一步探讨VAD的标准。
本团队既往研究显示,年龄因素可能会影响椎动脉管径重构,女性雌激素的调节可能对椎动脉粥样硬化的发生起到了预防作用[7],故本研究进一步使用倾向性评分匹配VAOS组和对照组,结果显示,VAOS组△D高于对照组[0.65(0.30,1.20)mm比0.40(0.20,0.80)mm,P=0.009],余基线资料组间差异均无统计学意义(均P>0.05)。本研究以狭窄率≥50% VAOS为因变量,以△D为自变量构建ROC曲线,结果显示,△D预测狭窄率≥50% VAOS的曲线下面积为0.622,以约登指数选择的△D最佳截断值为0.800mm(特异度78.3%、敏感度41.3%)。此结果敏感度较低,考虑可能是因为动脉粥样硬化的发生发展是多因素(如环境因素、遗传因素等)共同作用的复杂结果[25],VAD作为单一因素难以对VAOS的发生形成决定性作用。但AUC为0.622,特异度为78.3%,仍提示△D对发生狭窄率≥50% VAOS具有一定预测作用,因此针对中国人群,双侧椎动脉管径△D≥0.800mm或可作为定义VAD的参考标准,以提示发生VAOS的风险相对较高。
既往针对于VAD的研究多关注解剖结构上的信息,如双侧椎动脉管径△D、椎动脉与基底动脉连接角度等[3,15,17]。但血流动力学是动脉粥样硬化疾病发展的一个重要因素,且与解剖结构存在相互影响、互为因果的关系[8]。曹利民等[26]研究纳入260例PCI患者分析VAD的血流动力学特征,结果显示,与短暂性脑缺血发作患者(58例)比较,脑梗死患者(121例)的优势动脉PSV更低[(43.48±19.31)cm/s比(56.63±18.91)cm/s,P<0.01],阻力指数更高(0.75±0.12比0.61±0.10,P<0.01),提示VAD患者的优势动脉为后循环供血的主要血管,优势椎动脉的血流动力学状态与PCI不同的临床转归(短暂性脑缺血发作或脑梗死)相关。因此,未来针对VAD的研究可联合管径的不对称性和血流动力学变化,探索其与PCI发生的相关性,及相关血流动力学参数标准,以进一步完善VAD的定义。本研究存在局限性:本研究未收集椎动脉起始段发出角度、走行迂曲情况等,这些可能影响VAOS的血流动力学因素,危险因素方面还需要矫正其他因素,比如饮食、运动等。本研究结果有待进一步验证。
综上,无心脑血管病危险因素者双侧椎动脉管径差异程度与狭窄率≥50%VAOS相关,△D预测≥50% VAOS的最佳截断值为0.800mm,可作为定义VAD的参考标准,△D≥0.800mm提示发生狭窄率≥50% VAOS的风险较高(特异度78.3%、敏感度41.3%)。
*本文转载自“中国脑血管病杂志”,脑医汇获授权转载
声明:脑医汇旗下神外资讯、神介资讯、脑医咨询、Ai Brain 所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。
投稿邮箱:NAOYIHUI@163.com
未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享。
投稿/会议发布,请联系400-888-2526转3。







