
2024年9月2日,先声药业宣布,其与宁丹新药合作开发的在研创新药先必新®舌下片(依达拉奉右莰醇舌下片),已获得美国食品药品监督管理局(FDA)的“突破性疗法认定”,可用于急性缺血性卒中(AIS)治疗,成为了全球脑卒中治疗领域首个被FDA认定为突破性疗法的创新药。
“突破性疗法认定”旨在加速治疗严重疾病和解决重大未满足医疗需求的潜在新药的开发和监管审查。这一认定的获得,将有利于先必新®舌下片得到FDA更多指导,加速海外临床开发进程,并有望通过优先审评大幅缩短产品上市审评时间。

先必新®舌下片是一种脑细胞保护剂,含依达拉奉和右莰醇两种活性成分,具有抗氧化、抗炎和协同增效作用,能够显著减少AIS导致的脑细胞损伤。该药独特的舌下片配方在舌下与唾液接触后即可迅速崩解,通过舌下静脉丛快速吸收进入血液发挥疗效,有望增加卒中治疗方式的灵活性。先必新®舌下片有望与先声药业已上市的先必新®注射剂(依达拉奉右莰醇注射用浓溶液)组成序贯疗法,利于患者在院内院外获得完整疗程。
此前,先必新®舌下片新药上市申请于2023年6月28日获中国国家药品监督管理局受理,首个适应症是用于改善AIS所致的神经症状、日常生活活动能力和功能障碍。此外,先必新®舌下片也已在美国健康受试者中完成I期临床试验。

本次“突破性疗法认定”是基于先必新®舌下片在前期临床研究中展现的显著疗效指标改善。一项在中国开展的针对AIS治疗的多中心、随机、双盲、平行、安慰剂对照III期临床研究(TASTE-SL试验)数据显示:相较于安慰剂,先必新®舌下片显著改善AIS患者治疗后神经功能恢复及独立生活能力,达到预期疗效终点,安全性良好。2024年2月19日,《JAMA Neurology》在线发表了该研究的主要结果——“依达拉奉右莰醇舌下片治疗AIS:TASTE-SL随机临床试验”(推荐阅读:《【中国声音】舌下含服依达拉奉-右莰醇对急性缺血性脑卒中患者的治疗效果》)。

具体而言,TASTE-SL试验在2021年6月28日至2022年8月10日进行,随访90天。试验共纳入来自中国33个中心的914名48h内发病的AIS患者,年龄在18至80岁之间,美国国立卫生研究院卒中量表(NIHSS)评分在6至20分之间,上下肢运动障碍总分≥2分,卒中前改良Rankin量表(mRS)评分≤1分。
所有参与患者按1:1的比例被随机分配到先必新®舌下片组(依达拉奉,30mg;右莰醇,6mg)或安慰剂组(依达拉奉,0mg;右莰醇,60μg),每日2次,持续14天,并随访至90天。试验的主要疗效结局为随访90天时mRS≤1分的患者比例。
结果显示,与安慰剂组相比,先必新®舌下片组在第90天时获得良好功能预后(mRS≤1)的患者比例明显更高(290 [64.4%] vs 254 [54.7%];风险差异,9.70%;95% CI,3.37%-16.03%;几率比,1.50;95% CI,1.15-1.95,P = .003)。在不同年龄、性别、发病至治疗时间、高血压史、高脂血症史、糖尿病史、心脏病史和肾功能亚组中,先必新®舌下片组改善神经功能的获益一致。此外,两组的不良事件发生率相当(89.8% [405/450] vs 90.1% [418/464])。
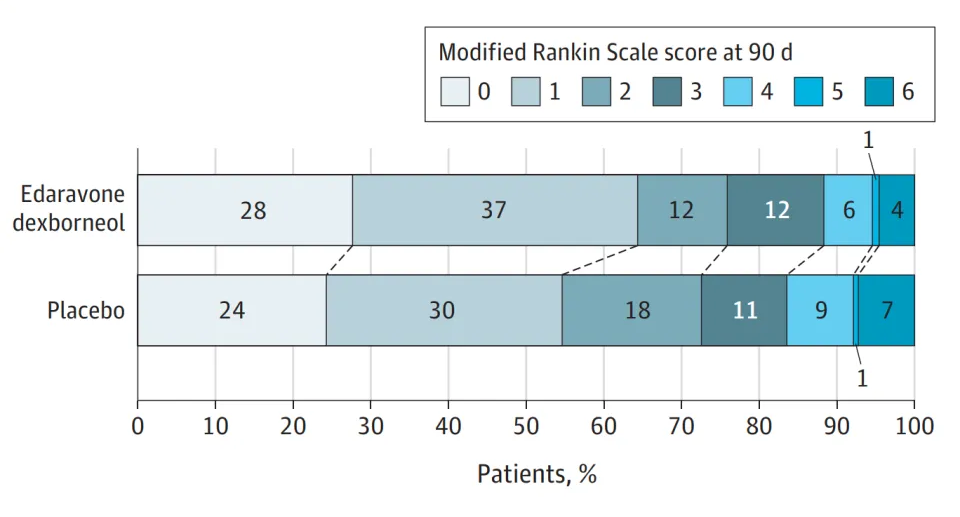
90天时的功能预后分布
通讯作者、北京大学第三医院樊东升教授等人在文中表示:“据我们所知,先必新®舌下片是第一种用于AIS患者的舌下脑细胞保护剂,相较于静脉注射药物有多项临床优势,包括起效更快、剂量需求更低、患者依从性更好、便利性更佳、生物利用度更高等。众所周知,卒中发病至治疗时间是良好预后概率的标准因素。一旦发现卒中,应立即进行急性阶段治疗。先必新®作为一种快速起效、患者友好的脑细胞保护剂,在试验中展现出AIS功能结局方面的良好疗效。总的来看,在未来的临床实践中,无论医疗资源如何,可以尽早对AIS患者使用这款舌下片,甚至包括昏迷、吞咽困难、居家或搭乘救护车前往医院的患者。”
关于先声药业
![]()
先声药业(2096.HK)是一家创新与研发驱动的制药公司,建设有“神经与肿瘤药物研发全国重点实验室”。本公司重点聚焦肿瘤、神经系统、自身免疫及抗感染领域,同时积极前瞻性布局未来有重大临床需求的疾病领域,致力于“让患者早日用上更有效药物”。本公司以自主研发及协同创新双轮驱动,与多家创新企业、科研院校建立战略合作伙伴关系。
声明:脑医汇旗下神外资讯、神介资讯、神内资讯、脑医咨询、Ai Brain 所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。




