
研究背景
![]()
免疫系统功能障碍和炎症在颅内动脉瘤(IAs)的发展中起着至关重要的作用。然而,遗传病理生理学的进展很复杂,尚未完全阐明。
图1. 研究设计流程图。
主要结果
![]()
01.
免疫炎症相关基因表达和IAs
在显著性阈值(P值<0.05)下,我们筛选出13个与IAs风险相关的基因,经过多重检验校正(P-FDR<0.2)和共定位分析,最终发现PSMA4、ERAP2和TNFSF12与IAs风险呈正相关。相反,RELT与IAs风险呈负相关。在验证阶段,PSMA4、TNFSF12和RELT在eQTLGen联盟中得到复制。基因预测有9个基因与aSAH风险相关。PSMA4和RELT在eQTLGen联盟和FinnGen研究中得到重复。在uIA中,鉴定出11个相关基因。多重校正和共定位分析显示RELT与uIA风险呈负相关,FinnGen研究和eQTLGen联盟也重复了这一结果。此外,我们还探讨了这些基因在脑组织中是否存在差异表达。在IAs其亚型中发现了PSMA4。在IAs和aSAH中也发现了ERAP2。

图2. (A) eQTL和pQTL水平上IAs的火山图。(B) eQTL和pQTL水平上的aSAH火山图。(C) eQTL和pQTL水平uIA的火山图。
02.
免疫炎症相关基因编码蛋白质和IAs
共有10种、13种、8种血浆蛋白与IAs、aSAH、uIA相关。经FDR校正后,ICAM5、RELT和LIFR与IAs风险呈负相关,而TNFSF12、ERAP2、CSF1R、IL18R1与IAs风险呈正相关。基因预测高水平的IL18R1、CSF1R、ERAP2、IL16、IL1R1和TNFSF12与aSAH风险呈正相关,而RELT、RPS6KA和MMP9与aSAH风险呈负相关。此外,高水平的RELT和STAT6显著降低了uIA的风险。进一步进行共定位分析,发现IAs和uIA中的RELT(PPH4:0.82)和IAs中的TNFSF12(PPH4:0.94)(图5)。在FinnGen研究中,仅在aSAH和uIA中观察到CSF1R、RELT和LIFR。
图3. 通过SMR分析鉴定的蛋白质候选基因在IAs中的单细胞类型表达。
03.
免疫炎症相关基因表达和蛋白质的证据
根据蛋白质是基因表达的最终产物这一理论,在蛋白质水平上建立关联证据是一项基本要求。在eQTL–pQTL水平上,我们确定了两个基因:RELT和TNFSF12被确定为IAs的一级证据;ERAP2和ICAM5被确定为IAs的三级证据。RELT、ERAP2和TNFSF12被认为是aSAH的三级证据;RELT也被确定为uIA的一级证据。此外,RELT在FinnGen研究中成功复制到aSAH和uIA性状中。虽然ERAP2和TNFSF12在eQTL水平上无法通过统计学显著性检验,但它们在发现研究中保持了OR的一致方向。
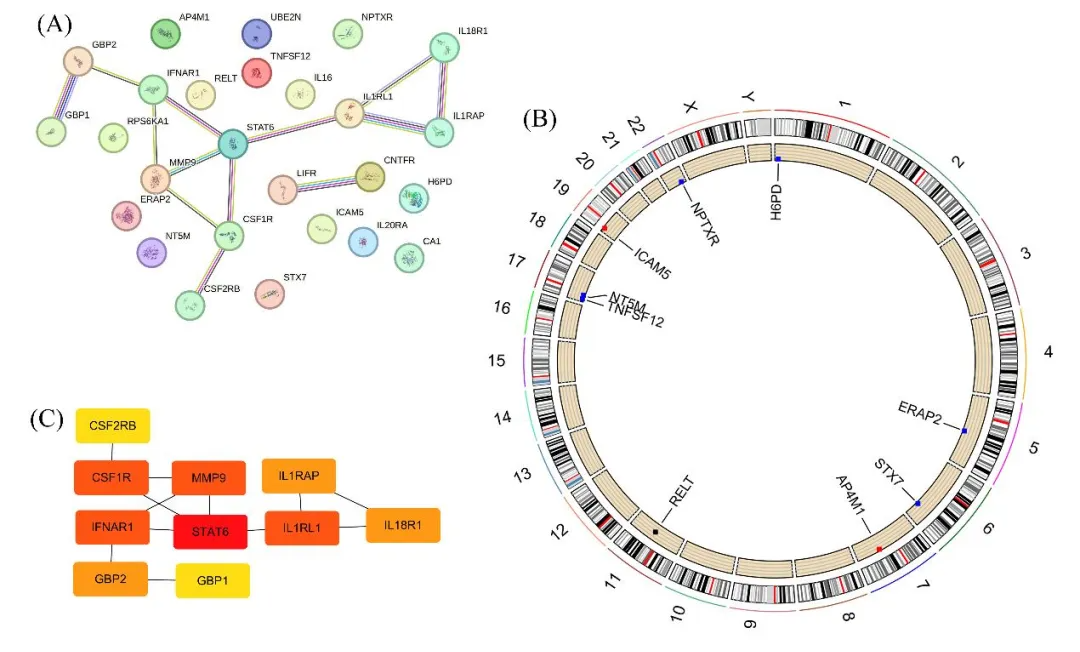
图4. (A)和(C)为pQTL水平PPI网络的构建(p<0.05)。(B)表示候选IIRGs在IAs中的染色体定位。
04.
整合免疫炎症相关基因和IAs之间的多组学证据
我们选取eQTL和pQTL水平的共表达基因作为靶向探针,探讨DNA甲基化是否在IAs及其亚型中调控这些基因。最终我们发现,cg06382664探针在IAs及其亚型中正向调控RELT的表达,这降低了IAs的风险。相反,其他RELT DNA甲基化探针,如cg18850434、cg08770935和cg21810604,与IAs、aSAH和uIA中RELT表达降低相关。此外,cg04295144与ICAM5表达水平降低有关,这意味着它可能是IAs的潜在风险因素。进一步的共定位分析为cg06382664(PPH4>0.7)与IAs及其亚型的参与提供了强有力的证据。我们在FinnGen研究中成功复制了RELT及其相关甲基化探针cg06382664。
图5. IAs和uIA中RELT和TNFSF12变体的HyPrColoc图。
05.
IAs的额外多组学证据
我们的研究还发现,高水平的H6DP,NPTXR和NT5M增加了IAs的风险;STX7增加了uIA的风险;而AP4M1可能对uIA具有保护作用。
06.
IAs中IIRG的单细胞类型特异性表达
使用Seurat软件包和CellMarker数据库整合IAs和正常样本的结果后,t-SNE图清晰地显示出14个细胞簇,包括成纤维细胞、巨噬细胞、NK细胞、内皮细胞、B细胞、粒细胞、单核细胞、T细胞等(图3)。与正常组织相比,IAs中成纤维细胞、巨噬细胞、小胶质细胞和中性粒细胞的比例较高,而壁细胞、周细胞、内皮细胞和室管膜细胞的比例较低(图3)。对IIRG中的富集基因(蛋白质水平上pFDR<0.2)和另外五个基因(H6PD、NPTXR、NT5M、AP4M1和STX7)的分析表明,15个候选蛋白质编码基因在IA中具有细胞类型特异性富集。STX7和TNFSF12主要在小胶质细胞中富集,而H6PD、STX7和TNFSF12主要在星形胶质细胞中富集。
07.
PPI治疗靶点潜力评估
PPI网络用于显示潜在因果IIRG编码蛋白之间的相互作用(P<0.05),揭示了ILRL1、IL1RAP、IL18R1、STAT6、MMP9、CSF1R、CSF2RB、IFNAR1、GBP2、ERAP2和GBP1之间的潜在相互作用,以及LIFR和CNTFR之间的相互作用(图4)。它们是可能参与调节白细胞介素家族信号通路和巨噬细胞刺激相关通路。
文章小结
![]()
我们的大型多组学研究整合了全基因组关联研究(GWAS)和基于汇总数据的孟德尔随机化(SMR),以探索IAs的潜在治疗靶点并提供支持IIRGs和IAs之间因果关系的遗传证据。然后,筛选相关的IIRG进行进一步的功能分析,包括单细胞RNA序列分析、PPI网络构建和DNA甲基化调控。整合多组学证据后,我们最终确定了IIRG:RELT、TNFSF12、ICAM5和ERAP2为IAs的新治疗靶点。
通讯作者简介
![]()
郭爱顺 副主任医师
漳州市医院
. 硕士研究生导师,副主任医师、内镜微创组负责人
. 中国医药教育协会-神经内镜与微创医学专业委员会委员,中国医师协会神经修复专业委员会青年委员,International College of Surgeons (ICS)会员,中国医师协会神经内镜颅底技术培训中心(漳州市医院)副主任,福建省垂体肿瘤多学科协作组秘书,福建省神经外科学会神经内镜专业委员会委员,福建省抗癌协会第一届神经肿瘤委员会委员,福建省医学会脑功能检测与神经调控专业委员会委员,福建省第一届神经调控专家委员会委员,中国人体健康促进会神经调控专委会委员,福建省海医会微创神经外科分会委员、漳州市医学会神经外科分会秘书长兼常委,漳州市康复与物理医学会常委
. 漳州市医院第二届青年才俊获得者,在国内重要杂志发表论文十余篇,其中SCI4篇,主持或参与省级科研5项
. 擅长应用神经内镜与微创神经外科技术治疗鞍区及各种部位、类型和难度的神经肿瘤、脑积水、脑出血、脑囊肿、颅神经疾病及脊髓肿瘤等,率先在闽西南地区开展昏迷病人促醒手术及顽固性疼痛电极植入术等手术,并在漳州地区率先开展帕金森、痉挛性斜颈、昏迷促醒等DBS手术及三叉神经球囊压迫技术,开展院内新技术6个,国家实用新型专利1项
![]()
声明:脑医汇旗下神外资讯、神介资讯、神内资讯、脑医咨询、Ai Brain 所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。






