
经典文章回顾
摘要:颅内动脉粥样硬化性疾病(ICAD)是世界范围内卒中最常见的病因之一。在中风患者中,美国东亚裔和非白人人群患icad相关中风的负担高于欧洲裔白人。与有症状的ICAD相比,无症状ICAD患病率的差异不那么明显。除中风外,ICAD还会增加痴呆和认知能力下降的风险,从而加重ICAD的社会负担。在确诊卒中且狭窄≥70%的icad相关卒中患者中,卒中复发风险最高。事实上,在狭窄>70%的患者中,>20%的1年卒中复发率是卒中常见原因中最高的发生率之一。ICAD引起脑卒中的机制包括斑块破裂伴原位血栓形成和闭塞或动脉对动脉栓塞、血流动力学损伤和分支闭塞性疾病。脑卒中复发的风险因脑卒中的潜在机制而异,但定量磁共振血管造影、计算机断层血管造影、磁共振灌注或经颅多普勒等技术是否有助于狭窄程度以外的风险分层尚不清楚。ICAD的诊断在很大程度上依赖于基于腔体的研究,如计算机断层血管造影、磁共振血管造影或数字减影血管造影,但较新的技术,如高分辨率血管壁磁共振成像,可以帮助区分ICAD和狭窄性动脉病变。
发病机制
动脉粥样硬化是一种胆固醇介导的疾病,指的是胆固醇沉积在动脉壁上形成动脉粥样硬化(图1A和1B)。从冠状动脉疾病推断,动脉粥样硬化发病机制的简化模型始于血管内皮功能障碍和胆固醇颗粒的内膜积聚循环单核细胞粘附在活化的内皮上,浸润血管壁,成熟为巨噬细胞,与积累的脂蛋白颗粒结合,成为泡沫细胞(图1C和1D)。在较小程度上,T淋巴细胞也进入循环。平滑细胞响应白细胞的浸润,从中膜向内膜迁移,促进胶原基质的合成,可能导致病理性内膜增厚。
脂质、白细胞和平滑肌细胞的持续实变导致动脉粥样硬化的形成。总之,这些炎症成分有助于斑块的进展,甚至在没有明显狭窄的情况下也可能导致临床事件。重要的是,动脉粥样硬化病变的分类是基于纤维帽形成的程度、富含脂质的坏死核心的程度以及诸如血栓等复杂特征。平滑肌的细胞介导的胶原基质合成产生了纤维帽,它是指覆盖在脂质核心上的一层独特的结缔组织(图1E)浸润性炎症反应可降解间质胶原,引起纤维帽的侵蚀和变薄,这可能增加斑块破裂的易感性,从而引发急性血栓形成,这是动脉粥样硬化的可怕并发症,斑块内出血和斑块新生血管也是斑块易损性的特征(图1F)

图1所示。颅内动脉粥样硬化。
颅内动脉粥样硬化是由胆固醇在血管内膜内的沉积合并成动脉粥样硬化组成的(A)苏木素和伊红(H&E)染色,B)弹性蛋白van Gieson (EVG)染色。动脉粥样硬化周围是强烈的内膜增殖和纤维化,通常为偏心腔,引起不同程度的管腔狭窄([A和B]管腔用字母L表示)。泡沫细胞由巨噬细胞组成,吞噬脂肪颗粒,呈圆形,细胞核偏心([C]蓝色箭头)。泡沫细胞CD68染色阳性([D] +CD68细胞呈棕色)。纤维帽([E]标记纤维帽厚度的双箭头)将动脉粥样硬化从管腔(L)中分离出来。较薄的纤维帽被认为增加了斑块破裂的脆弱性。斑块的其他高危特征包括颅内出血和新生血管形成([F]斑块内有小血管的证据)。新生血管不应与滋养血管相混淆,滋养血管在最近端的外膜周围。
通常,以低壁剪应力和周壁张力为特征的血流动力学环境会促进动脉粥样硬化低壁剪应力以血流再循环和振荡剪应力为特征,发生在与血流分割线或动脉分支点相对的动脉壁上,血流模式偏斜。动脉壁的张力补偿了非层流模式,但这可能会由于长时间的压力而变得疲劳,动脉僵硬,特别是在高血压患者中在颅内循环中,动脉粥样硬化斑块可能更常见于中动脉腹壁,与穿支孔相对,以及基底动脉近端侧壁,在那里2条椎动脉汇合处的角度影响血流模式。
在冠状动脉中,动脉粥样硬化病变最初从管腔向外扩张,保留管腔口径然而,体内成像和病理研究表明,颅内动脉外重构作为动脉粥样硬化形成的反应结果存在差异。大脑动脉独特的解剖学特征可能与颅内外重构程度的不确定性有关:缺乏外部弹性层,相对于冠状动脉较厚的介质,复杂的侧支,以及大脑远端动脉的自我调节能力。进一步了解颅内动脉重塑可以更好地了解斑块检测、ICAD的风险特征和未来的治疗方法。
ICAD可通过多种机制引起缺血性卒中(图2):易损斑块破裂伴血栓形成导致原位闭塞或动脉对动脉栓塞,高级别狭窄导致血流动力学衰竭(图3A和3B),或小穿孔动脉起源处内膜引起的分支闭塞性疾病(图3C和3D) ,后者可在轻度管腔狭窄时发生,表现为腔隙性梗死。动脉对动脉栓塞和分支闭塞性疾病可能是相对常见的机制,但通常存在多种并发机制。每种机制可能传达不同的预后和卒中复发风险,这一直是确定高危亚组的焦点,这些亚组可能从更有针对性的治疗中受益。具有血流动力学衰竭特征的ICAD卒中复发风险特别高(图3A和3B)。

图2。颅内动脉粥样硬化性疾病的病理生理学。
颅内动脉粥样硬化性狭窄可引起卒中的机制主要有3种,这些机制可以重叠:(1)斑块破裂:当内皮破裂时发生,通常有薄的纤维帽,致血栓物质暴露于血流中。在斑块管腔表面形成的血栓可以生长并阻塞狭窄水平的动脉,也可以完全或部分分离导致远端栓塞。(2)血流动力学效应:斑块可不断生长,增加狭窄程度。进行性狭窄可减少前流,导致灌注不足,在低血容量或低血压的情况下会加剧。(3)穿支闭塞性疾病:动脉粥样硬化伴不同程度的内膜增生和基底物质增加,可使从母动脉分叉的穿通动脉的口变窄或闭塞,影像学和临床表现为腔隙性卒中。

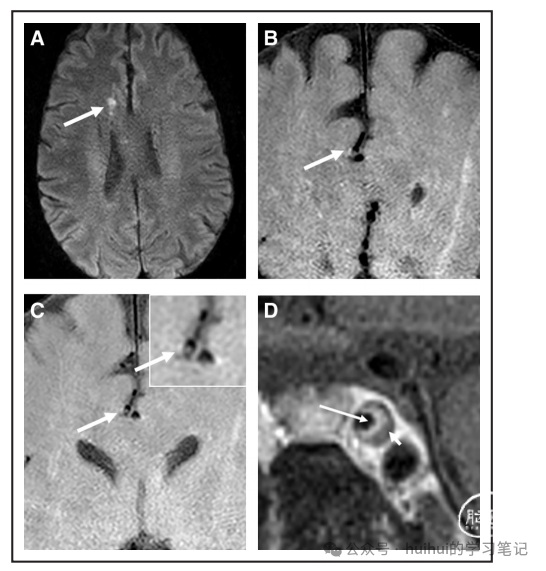
图3。颅内动脉粥样硬化性狭窄的管腔研究。
颅内动脉粥样硬化性狭窄的诊断主要是基于腔内的研究。高度颅内动脉粥样硬化性疾病(ICAD)患者可通过血流动力学衰竭发生卒中([A和B]脑计算机断层扫描(CT)显示左m1近端有血流间隙,CT灌注显示灌注不足)。同样,ICAD可以冲击穿通动脉的起源,导致腔隙性梗死([C]右侧M1高度狭窄,并伴有急性梗死,如图[D]所示)。基于腔隙的研究,如计算机断层血管造影、飞行时间磁共振血管造影(MRA) ([E]血流伪影夸大狭窄程度)或数字减影血管造影([F]与[E]相同的狭窄,但能更好地划分血管轮廓,避免MRATOF血流伪影)是ICAD最常见的诊断方法。
icad成像
ICAD的诊断很大程度上依赖于影像学(图3E和3F)。ICAD的评估代表了ICAD的晚期阶段,传统上依赖于基于管腔的成像,如数字减影血管造影(DSA)、CTA和mra。一些成像方式,如TCD、灌注成像和计算流体动力学(CFD),可以表征狭窄血管的血流动力学。然而,这些成像方式在表征动脉粥样硬化斑块和区分动脉粥样硬化引起的狭窄和其他狭窄方面的能力有限。高分辨率血管壁磁共振成像(vwMRI)已成为评估斑块特征和对未来临床风险分层的一种有前景的方式(图4)。其他较新的成像方式,如正电子发射断层扫描(PET) -配体计算机断层扫描/磁共振,也正在研究作为评估易损斑块的成像技术,这些易损斑块可能导致卒中风险增加。在本节中,我们总结了常用的腔内成像模式和最新技术,以及表征斑块病变和识别风险分层生物标志物的新兴模式。
基于腔隙的ICAD诊断
数字减影血管造影
DSA是评估其他基于光成像方式获得的狭窄严重程度准确性的基准。DSA提供了颅内血管的良好空间分辨率和血管狭窄程度的精确测量。它还提供了血流模式和侧支的实时可视化(图2)然而,它是最具侵入性的技术,需要注射造影剂,并且有手术并发症的风险,包括中风和腹股沟血肿因此,在临床上不常用于诊断ICAD。
计算机断层血管造影术
CTA是诊断ICAD的常规方法。与dsa相比,它是非侵入性的,提供了快速的图像采集,对于检测>50%狭窄的颅内大血管具有高度的敏感性和特异性。计算机断层扫描还可以轻松地可视化颅内动脉钙化,这与衰老高度相关,已被证明是中风的一个危险因素。尽管颅内动脉钙化通常被认为是动脉粥样硬化疾病的标志,但先前的组织病理学研究表明,只有内膜钙化(在计算机断层扫描上显示为厚的、聚集的)才与动脉粥样硬化有关,而内侧钙化(在计算机断层扫描上显示为薄的、连续的)并不总是与动脉粥样硬化(严格由动脉粥样硬化定义)有关。此外,内膜钙化可能表明动脉粥样硬化斑块的稳定性,斑块通常可以在没有内膜钙化的情况下存在。因此,ICAD的确定不应仅根据钙化负荷。
MRI
磁共振血管造影(MRA)是另一种评估ICAD的无创方法。飞行时间(TOF) MRA不需要辐射或造影剂注射。然而,这种技术容易受到手术夹或支架的影响,并且对血流的干扰很敏感,这可能导致对狭窄程度的高估。基于钆的对比增强MRA通常较少受血流相关伪影的影响,可以改善管腔通畅的可视化与DSA相比,3T时的TOFMRA检测50% - 99%狭窄的灵敏度为75% - 85%,特异性为95%。零回声时间MRA是一种较新的磁共振技术,它结合了动脉自旋标记策略和超短回声时间,产生类似于dsa获得的血管造影图像。与tof -MRA相比,零回声时间MRA对区域不均匀性和磁化率伪影不太敏感,并且显示出更特异性,更不容易出现狭窄高估。定量MRA是另一种先进的技术,它结合了TOF-MRA和相对比磁共振技术来表征血流动力学和与狭窄血管相关的侧枝。该技术已在临床环境中用于筛查颅内支架内再狭窄的风险,并在一项研究中用于对症状性椎基底动脉疾病的卒中风险进行分层,但目前尚未广泛用于ICAD患者的风险分层。
ICAD的血流动力学研究
经颅多普勒血流动力学研究
TCD是一种成本效益高、无创的床边评估和监测ICAD的方法。SONIA试验(卒中结局和颅内动脉粥样硬化的神经影像学)显示TCD可以检测出50% - 99%的颅内狭窄,且具有显著的阴性预测值。局灶性平均流速增加,远端平均流速降低和脉搏指数增加是管腔狭窄的征象。使用屏气或CO2管理可用于测量血管舒缩反应性和识别盗血现象。高强度信号监测的TCD可以检测到微栓子的存在,在一项研究中,微栓子是症状性ICAD患者卒中复发的危险因素,但在MyRIAD研究(颅内动脉粥样硬化疾病早期复发机制)中没有发现。TCD的一个缺点是它是一种盲目的技术,确定狭窄的准确性依赖于操作员捕捉狭窄区域流速波形的能力。经颅彩色编码双超声通过b型和彩色多普勒成像的结合,比TCD有优势.这使血管可视化,并允许角度调整,以获得更准确的流速测量与常规血管造影相比,经颅彩色编码双超声在检测≥50%狭窄时具有很高的可靠性。
灌注成像
灌注成像由于其在大血管闭塞的扩展窗口机械取栓决策中的应用而被广泛应用。近年来,灌注成像作为一种对有症状的ICAD患者进行风险分层的工具进行了研究。一项研究发现,在狭窄50%至99%的血管内平均通行时间的增加会增加同侧卒中的风险,通常沿着边界区域。同样,另一项研究表明,灌注不良的患者(定义为Tmax >6-s错配量增加≥15ml)更容易发生卒中复发。虽然灌注成像传统上依赖于使用造影剂,但对于无法接受造影剂的患者,动脉自旋标记提供了一种替代的磁共振成像技术,通过使用内源性磁性标记的动脉血液水来追踪血流。
计算流体动力学
CFD是一种建模工具,它使用从其他模式重建的源图像来模拟通过目标血管段的血流。利用CFD模型提取的常见血流动力学变量包括横截面压力梯度、剪切应变率和壁面剪切应力。在一项包含9例DSA患者的小病例研究中,CFD分析显示狭窄部剪切率呈指数增加,狭窄程度更大,狭窄中部剪切率增加,足以诱导血小板活化。在狭窄的远端,有快速波动的非层流模式。血管成形术和支架置入术改善了患者的血流动力学特征。使用一种新的血流动力学信号强度比标记物来测量TOF-MRA在动脉狭窄处血流相关增强的差异,发现信号强度比低于中位数的患者更容易复发缺血性卒中。到目前为止,CFD的使用尚未在ICAD中得到验证,也不常用于临床实践。
基于动脉壁ICAD诊断
高分辨率vwMR
高分辨率vwMRI在ICAD诊断中的应用越来越广泛。这项技术可能在建立管腔狭窄的鉴别诊断和改善动脉粥样硬化斑块的诊断中发挥潜在的作用。为了说明这一点,一项对196例病例的尸检研究表明,尽管颅内动脉粥样硬化通常与狭窄相关,但约20%的病例在没有明显狭窄的情况下表现为晚期动脉粥样硬化。高分辨率vwMRI提供了一种观察动脉粥样硬化斑块的活体方法,包括未导致可观察到的狭窄的斑块。此外,传统的基于管腔的成像,在区分动脉粥样硬化和血管炎引起的狭窄时,出现了一个常见的诊断挑战。这种解释是通过考虑危险因素和患者的临床病史来辅助的。例如,动脉粥样硬化通常不影响年轻患者,主要影响湍流血流较高的区域,而血管炎则没有这种偏好然而,即使使用DSA,也有相当大的诊断不确定性。基于对血管壁增强模式的评估、随访成像中持续增强的程度以及邻近实质增强的累及程度,血管壁成像有望区分血管炎与ICAD。
![]()
声明:脑医汇旗下神外资讯、神介资讯、神内资讯、脑医咨询、Ai Brain 所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。




