世界著名神经创伤杂志《Journal of Neurotrauma》最近发表了一篇关于小分子化合物日柏醇(Hinokitiol)通过调控铁死亡过程改善颅脑损伤(TBI)小鼠的神经功能的研究成果:《Protective Effects of Hinokitiol on Neuronal Ferroptosis by Activating the Keap1 /Nrf2/HO-1 Pathway in Traumatic Brain Injury》。该研究由中山大学附属第一医院杨李轩/谢宝树团队完成,结果表明日柏醇可能通过调控Keap1/Nrf2/HO-1通路抑制小鼠TBI后神经元铁死亡发挥神经保护作用。
J Neurotrauma杂志亚太区编辑高国一教授将这篇文章推荐给广大国内神外同仁,并特别邀请J Neurotrauma杂志主编David Brody教授进行了联合点评。

唐洪兴1,**,何科君1,**,赵坤1,**,郑宸1,吴维迟1,金卫林2,*,杨李轩1,*,谢宝树1,*
1. 中山大学附属第一医院神经外科,中国广州
2. 兰州大学附属第一临床医学院,兰州大学第一医院医学前沿创新研究中心,肿瘤神经科学研究所,中国兰州
*通讯作者 **三位作者对本文贡献均等
文章摘要
颅脑创伤(Traumatic brain injury, TBI)是目前世界范围内死亡和致残的主要原因。铁死亡(Ferroptosis),一种新型的细胞程序性死亡方式,已被证实参与了TBI继发性脑损伤的关键病理过程。日柏醇(Hinokitiol)是一种天然小分子化合物,近年来,发现其可以调节铁代谢,并在帕金森病等动物疾病模型中显示出神经保护功能。然而,日柏醇在TBI后铁死亡的作用的研究尚未有相关报道。本文利用构建体内和体外TBI模型,发现了日柏醇在TBI后神经元铁死亡、继发性脑损伤(神经炎症等)及神经功能障碍改善中重要作用,并进一步关注到Keap1/Nrf2/HO-1信号通路可能是日柏醇发挥神经保护作用的重要调控机制。
![]()
背景介绍
![]()
方 法
![]()
结 果
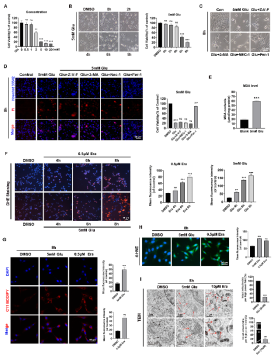
从图2可以看出日柏醇可以挽救谷氨酸诱导的神经元细胞铁死亡。

图3日柏醇可影响TBI后Keap1/Nrf2/HO-1信号通路蛋白表达。表现为明显上调血红素加氧酶-1(Hmox1, HO-1)蛋白的表达,并增加核因子红细胞系相关因子2(Nrf-2)的核转位。


图5揭示了日柏醇可能通过调控Keap1/Nrf2/HO-1通路抑制小鼠TBI后神经元铁死亡。


![]()
讨 论
TBI是一种严重的急性神经系统疾病,发病机制极其复杂,中重型TBI治疗效果不佳,往往遗留严重的神经功能后遗症,给个人、家庭和社会带来了严重的负担,是威胁全球性的公共卫生健康的重大问题。在过去一个多世纪中,对TBI药物的研究诞生了很多种新的神经保护性药物,但三期临床试验都未显示出明确的疗效。因此,通过药物靶向抑制TBI后继发性损伤关键病理过程是促进神经功能的恢复是潜在的有效治疗手段之一。
本文所研究的化合物—日柏醇是从中国台湾柏科(Cupressaceae)树木中分离出来的一种天然上的小分子化合物,已证实具有抗菌、抗炎和抗氧化等多种生物学活性。在本文中,利用构建体内和体外TBI模型,发现了日柏醇在TBI后神经元铁死亡、继发性脑损伤(神经炎症等)及神经功能障碍改善中重要作用,并进一步关注到Keap1/Nrf2/HO-1信号通路可能是日柏醇发挥神经保护作用的重要调控机制。
Hmox1(Heme Oxygenase 1, HO-1)是热休克蛋白(HSP)家族的一员,由HMOX1基因编码,其作用是催化血红素降解为亚铁离子、一氧化碳和胆绿素/胆红素。HO-1是生物氧化应激系统中至关重要的转录因子,具有抗炎、调节氧化应激抗细胞凋亡和神经保护作用等多种作用。Nrf2是Cap'n'collar(CNC)家族成员,是调控HO-1表达的转录因子,在细胞抗氧化损伤和亲电应激机制中起着至关重要的作用。在稳态条件下,Nrf-2通过泛素化和蛋白酶体依赖性降解被Kelch样ECH相关蛋白1(Kelch-like ECH-associated protein 1, Keap1)降解。在应激下,Nrf-2因Keap1构象变化而逃脱泛素化,并易位到细胞核,触发基因的表达。Nrf-2的靶基因包括溶质载体家族7成员11(SCL7A11)、谷胱甘肽过氧化物酶4(GPX4)和参与抗氧化信号通路的HO-1。
在本研究中,首先,C57小鼠用于建立TBI模型(精准控制皮质冲击模型,controlled cortical impact, CCI),通过行为学实验,发现日柏醇治疗显著降低了小鼠TBI后mNSS评分,改善了TBI小鼠在莫里斯水迷宫(MWM)和Rotarod转棒实验中的表现,且明显减轻了小鼠TBI后3天引起的脑组织体积损失、皮层和海马神经元损伤及损伤皮层及附近铁沉积。此外,TBI后受损皮层区域及附近星形胶质细胞和小胶质细胞激活增加,而日柏醇抑制了星形胶质细胞和小胶质细胞的活化。我们还发现在急性TBI后铁死亡相关基因(如PTGS2)明显升高,而日柏醇显著抑制了这一过程。这些结果表明,日柏醇改善小鼠TBI后神经功能障碍。
接着,本文继续验证了日柏醇对体外TBI细胞损伤模型的影响,发现日柏醇可以挽救谷氨酸、铁死亡特异性诱导剂—Erastin诱导的细胞损伤或死亡,明显减少细胞内脂质过氧化产物(MDA、4-HNE等)的生成、减少致死性活性氧簇(ROS)的产生和过量亚铁离子(Fe2+)的积累,抑制铁死亡相关mRNA的显著表达,减轻线粒体损伤。这些结果表明,日柏醇对体外TBI神经元细胞损伤具有保护作用。
然后,又进一步探讨了日柏醇对TBI细胞损伤模型具有保护作用可能得机制。在我们的研究中,RNA-seq高通量测序显示,HO-1可能是日柏醇发挥神经保护作用的关键蛋白之一。Real-time PCR和Western blot实验则进一步验证了这一结论。此外,还发现通过siRNA转染敲低HO-1后可明显减弱了日柏醇的神经保护作用,这些结果表明日柏醇可能是通过上调HO-1发挥神经保护作用。
最后,在体外TBI模型中,通过Western blot、免疫荧光染色等实验,发现日柏醇处理后,神经元细胞HO-1表达显著增加,Nrf2细胞核转位明显增加,而胞浆中Nrf2减少。在TBI小鼠模型中,通过WB、RT-PCR、免疫荧光染色(IF)、免疫组化实验(IHC)等发现在TBI后1天,3天,7天HO-1蛋白明显升高,日柏醇治疗后能显著增加神经元HO-1蛋白的表达。上述这些结果表明,日柏醇可能通过调控Keap1/Nrf2/HO-1信号通路抑制小鼠TBI后神经元铁死亡来发挥神经保护作用。
本研究发现了一种小分子天然化合物日柏醇通过激活TBI后Keap1/Nrf2/HO-1通路可以抑制神经元铁死亡、减少神经炎症,有效改善TBI后运动、平衡、空间学习和记忆功能障碍,促进神经功能的康复。提示了日柏醇是治疗TBI相关脑损伤和神经功能障碍潜在治疗药物。未来,还需要进一步大量且深入的研究来阐明日柏醇治疗TBI后铁死亡、脑水肿、神经炎症引起的神经损伤的机制。
![]()
结 论

编辑点评
David Brody 教授
Journal of Neurotrauma杂志主编
铁死亡(Ferroptosis)是基础研究的明星,对于铁死亡在疾病领域的研究热情持续高涨,例证之一就是以铁死亡为关键研究内容的国家级课题申报的数量居高不降。作为一种新型的细胞程序性死亡方式,铁死亡参与TBI继发性脑损伤的病理过程,但对其调控作用亟待深入。杨李轩/谢宝树研究团队选取日柏醇,并观察其在TBI后铁死亡的作用。研究构建在体和体外TBI模型,发现了日柏醇在TBI后神经元铁死亡、继发性脑损伤及神经功能障碍改善中重要作用,并进一步关注到Keap1/Nrf2/HO-1信号通路可能是日柏醇发挥神经保护作用的重要调控机制。研究为颅脑创伤治疗药物的临床转化提供了新的选择和实验室证据。
点击/识别二维码,前往高国一 教授学术主页
查看更多精彩内容
![]()
通讯作者简介
谢宝树 主治医师
中山大学附属第一医院
神经外科主治医师,硕士研究生导师
主持国自然一项,省部级课题两项
第一作者或通讯作者发表SCI论文8篇,其中影响因子大于10分的两篇
研究方向:颅脑创伤与铁死亡
杨李轩 主任医师
中山大学附属第一医院
神经外科主任医师,硕士研究生导师,博士研究生导师,博士后合作导师
主持国家自然科学基金1项,省自然科学基金3项,广州市科技重大项目1项,省科技项目2项,省卫健委项目1项
以通讯/第一作者在国际期刊发表SCI论文8篇,第一或通讯作者中文核心期刊收录论文20余篇
![]()
声明:脑医汇旗下神外资讯、神介资讯、神内资讯、脑医咨询、Ai Brain 所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。
投稿邮箱:NAOYIHUI@163.com
未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享。











