第一作者:丁宁,罗然
通讯作者:胡荣
其他作者:张倩,李欢欢,张水仙,陈焕然
作者单位:陆军军医大学第一附属医院(西南医院)

REF: Ding N, Luo R, Zhang Q, et al. Current Status and Progress in Stem Cell Therapy for Intracerebral Hemorrhage. Transl Stroke Res. Published online November 25, 2023. doi:10.1007/s12975-023-01216-7
PMID: 38001353
+ + + + + + + + + + +
摘 要
脑出血是一种高发病率且预后不良的疾病,对人类生命和健康造成了难以估量的伤害。然而,对于脑出血的治疗选择非常有限,特别是在改善病变微环境、促进神经细胞存活和增强神经功能方面。本综述全面讨论了干细胞治疗脑出血的应用,系统总结了其发展历史、移植类型、移植途径和移植时机。另一方面,本综述介绍了提高干细胞移植效果的最新研究进展,包括移植前预处理、基因修饰、联合治疗和其他多种策略。此外,本综述首次详细阐述了干细胞治疗在临床转化中面临的障碍。这些讨论对于推动干细胞治疗脑出血、促进其临床应用和改善患者预后具有重要意义。
+ + + + +
简介
01
脑出血的危害与治疗困境
02
脑出血后内源性干细胞的修复作用与局限性
03
脑出血后干细胞移植疗法的发展及优势
干细胞移植疗法策略
01
移植物种类
①干细胞

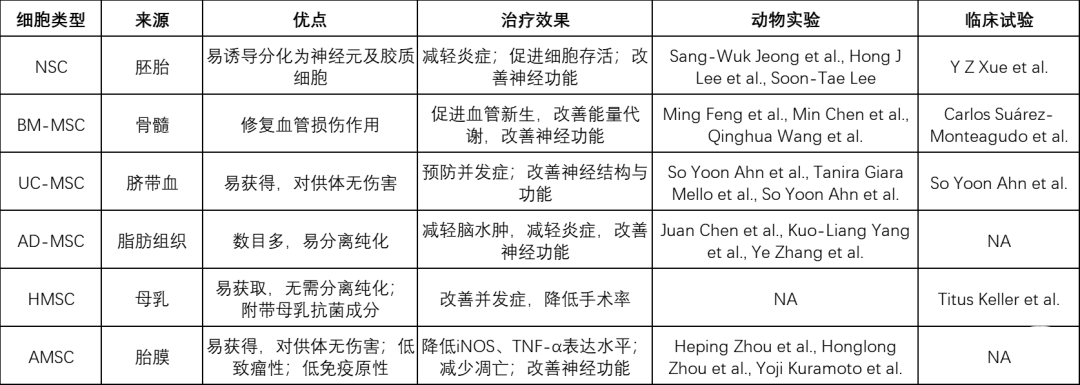
用于治疗ICH的干细胞及有关研究
缩写:NSC:neural stem cell; UC-MSC:umbilical cord- mesenchymal stem cell; BM-MSC:bone marrow- mesenchymal stem cell; AD-MSC:adipose-derived mesenchymal stem cell; HMSC:human milk stem cell; AMSC:amniotic stem cell。
神经干细胞可以在合适的条件下通过一套精密而复杂的调控网络向神经元以及胶质细胞方向分化。既往研究证实,移植后的神经干细胞可以在受体内存活、分化成神经元并整合进原有神经环路。由于NSC在治疗中枢神经系统损伤中的天然优势,通过移植人类胚胎NSC治疗ICH,可以减轻ICH后全身炎症反应,减轻脑组织炎症浸润与细胞凋亡,起到保护神经功能与改善行为学的治疗效果。有关动物实验已开展近20年,其有效性与安全性也在后续一系列实验中得到证实。人体试验也进一步证明了经由腰椎穿刺移植NSC在治疗ICH的安全性与有效性,但缺少深入的临床试验使得ICH患者的NSC移植治疗缺少详细的临床指导方案。
作为涵盖了骨髓间充质干细胞(BM-MSC)、脐带间充质干细胞(UC-MSC)、脂肪间充质干细胞(AD-MSC)在内的一大类干细胞,MSC的来源广泛,而且它具有较低的免疫原性,能够分化成神经元及胶质细胞,这些都使得MSC成为ICH干细胞治疗的常见选择。
骨髓间充质干细胞(BM-MSC)具有良好的修复血管损伤作用,在猕猴脑出血动物模型上表现出了良好的治疗效果,可以在能量代谢、血管密度、神经功能水平改善脑出血预后)。大鼠ICH模型提示其背后的机制可能跟BM-MSC激活TSG-6,抑制NF-κB信号通路,减少iNOS、ONOO(-)等有害物形成,保护血脑屏障有关。最新研究则揭示了BM-MSC可以分泌C1q/TNF相关蛋白,抑制小胶质细胞焦亡,减轻神经炎症。
UC-MSC是人源干细胞中取材最方便、对供体伤害最小的干细胞之一,可以经由剖宫产手术便利地取得。UC-MSC不仅在脑出血动物实验中表现出良好的疗效,成功改善信号的输入与整合,修复丘脑皮层可塑性,改善了神经功能,更在脑室出血新生儿上完成了安全性与可行性验证,后续需要扩大规模的2期临床试验以验证有效性。
脂肪干细胞(adipose-derived mesenchymal stem cell,AD-MSC)是人体最丰富的成体干细胞来源之一,单位体积的脂肪组织,干细胞数目要显著多于骨髓组织(约500倍),且杂质细胞易于剔除。并且中老年人来源的AD-MSC仍表现出明显的治疗效果。由于AD-MSC易提取、易分离、功能不随年龄增长明显下降,因此是一种理想的自身成体干细胞来源。移植AD-MSC可以迁移至脑血肿病灶处,分化成神经元与星形胶质细胞,此外,AD-MSC可通过抑制AQP4蛋白的表达与减轻炎症水平减轻脑组织水肿,还可以在细胞水平减少细胞凋亡,在组织水平减轻神经损伤,在行为学水平改善mNSS评分。
除外MSC,母乳干细胞(human milk stem cell,HMSC)和羊膜干细胞(amniotic stem cell,AMSC)也被用于治疗颅脑出血。母乳中富含多种生物活性分子,但很少有人关注,母乳中具有多系潜能的干细胞,它们的治疗潜能也不容忽视。Titus Keller等人开展的临床研究表明,对脑室出血的早产儿鼻腔内滴入母乳,重度脑室穿孔症(porencephalic defect)、进行性脑室扩张(progressive ventricular dilatation)和手术率都呈现出降低趋势。人类羊膜干细胞分布于胎盘、羊膜以及子宫腔中,可在剖宫产手术中获取。AMSC缺少端粒酶,因此致瘤风险较低,并且AMSC独特的免疫分子表达模式使得它引发受体免疫系统攻击的风险进一步降低。AMSC用于ICH治疗的研究较少,但有相关报道提示AMSC治疗早期ICH,其疗效甚至优于AD-MSC。
此外,Kathiresh Kumar Mani等人针对脑缺血模型,创新性使用肠道上皮干细胞移植改善肠道屏障,从而减轻炎症水平,减轻了MCAO远期神经系统损伤,促进了情感与认知功能的恢复,证实了靶向其他器官系统并最终促使中枢神经系统修复也是一种可行的选择干细胞种类思路。
②移植复合物
除了将干细胞混悬于生理盐水、PBS等平衡液中,也可将干细胞与水凝胶等复合材料结合制备干细胞移植复合物。将干细胞与水凝胶制备成复合物,有如下优势。首先,水凝胶作为一种支撑载体,不仅可以保护和支撑细胞,避免在转移以及移植过程中损伤细胞,还可以形成类似生理环境的微环境,为干细胞提供适当的生长和分化条件,促进移植后细胞的迁移与延伸。其次,水凝胶可以刺激干细胞分泌特定的生长因子和细胞因子,以促进组织再生和修复。此外,干细胞经过特殊工艺接种于水凝胶后,具有更好的空间分布均一性,这样在移植时通过对移植体体积的控制就能较精确控制移植的细胞数目。最后,由于水凝胶是一种生物相容性材料,可以降低干细胞移植后的排异反应。
基于以上原因,Yuhua Gong等人设计出一种复合移植材料用于ICH后治疗:以铁螯合剂/低分子量角蛋白水凝胶作为外壳,从而消除ICH后铁超载的负面影响,维持移植干细胞的活性;以高分子量角蛋白水凝胶与BMSCs作为内芯,这是移植后发挥治疗效果的主体;最后将表皮生长因子和碱性成纤维细胞生长因子包被在聚乳酸-羟基乙酸共聚物(poly lactic-co-glycolic acid,PLGA)纳米颗粒中,进而包裹到核心水凝胶中,以支持内芯BMSC的生长和分化。这一复合移植体系适宜程序化与标准化注射,并且在不良环境下,尤其是血红蛋白毒性,对移植细胞表现出较强的保护作用,促进了细胞存活,减少了铁沉积与脑室扩大,降低ICH后大脑含水量,促进神经功能恢复。
③干细胞来源的非细胞组分
除了干细胞,包括细胞外囊泡(extracellular vesicle,EV)、细胞裂解成分、使用过的培养基在内的干细胞来源成分,也可以作为移植物改善ICH预后,其中EV的应用研究最为引人注目。EV不易被受体免疫系统识别和攻击,造成受体免疫排异反应的风险更小,其较小的直径也避免了血管阻塞和微血管血栓形成等并发症,因此具有更广泛的适用性;EV跨越血脑屏障的能力也更强,作用效率更高;使用EV代替干细胞移植还能减少潜在的疾病传播事故、肿瘤形成风险和道德伦理问题,是一种可行性更高的治疗方式。
移植外泌体以治疗脑出血主要是通过外泌体中包含的miRNA及营养因子的调控作用实现的。有研究报道,BM-MSC来源的外泌体包含有miR-23b,可以调控PTEN/Nrf2通路进而降低NLRP3依赖的细胞焦亡,减轻脑组织水肿,改善ICH预后。So Yoon Ahn等人的研究则证明了BDNF是UC-MSC来源的外泌体改善IVH预后的关键分子,在体外实验中显著减轻凝血酶诱导的神经元死亡,在在体实验中促进神经元存活,减少星形胶质细胞增生和炎症反应,改善了行为学功能。
虽然以EV为代表的干细胞来源的非细胞组分作为移植物可以在一定程度上模拟干细胞的治疗效应,并且风险更低,但这一疗法不能完全替代干细胞治疗。移植干细胞本身可以分化成神经元、胶质细胞等,能够更直接地替代和修复受损的组织和器官。且干细胞可以长期存在并不断分化,因此移植干细胞可以产生更持久的治疗效果。因而在治疗脑出血等疾病时各有其优点和适用范围,具体的治疗方式需要根据具体情况进行综合考虑和决定。
02
移植途径
干细胞移植的途径影响干细胞在受体内的分布与迁移,并与移植时间、细胞直径、注射速度等因素共同影响ICH治疗效果。干细胞治疗ICH的动物实验中常见的移植途径主要包括静脉注射、脑实质注射,其他还有脑室内注射、动脉内注射、经鼻移植。关于这些移植途径的疗效差异鲜有研究关注。
借由机体的脉管系统将干细胞转运至病灶是一种广受关注的移植途径。静脉注射作为一种临床常规操作,对机体伤害小,不需要特殊的设备和技术,可操作性高,可以降低移植手术风险。通过静脉内注射,干细胞可以通过血液循环被输送到身体各个部位,不仅可以治疗ICH后脑组织损伤,还可以靶向脾脏等器官,改善全身状况。静脉注射干细胞治疗ICH时,通常选取尾静脉或股静脉。有趣的是,对于颈静脉移植途径的有效性,似乎出现了截然相反的结论。Huabiao Zhang等人报道,经由颈静脉注射BM-MSC对于治疗ICH无明显疗效,但Min Chen等人的研究表明,颈静脉移植BM-MSC可降低ONOO(-)水平,改善BBB完整性,促进脑出血大鼠的神经功能恢复。这可能与Min Chen等人移植剂量更大、移植时间较早、注射速度更慢有关,但具体的机制还需深入探究。动脉移植似乎是一种比静脉移植效率更高的移植途径。在脑缺血与创伤性脑损伤治疗研究中,与静脉移植组相比,经由动脉移植后,受损脑组织内检测到的干细胞数目相对更多。但由于动脉移植有更高的风险,可能导致血管阻塞、出血、感染等不良反应,限制了这一移植途径的研究。尽管有研究报道,在控制干细胞直径与移植速度的前提下,动脉注射8×106个干细胞,仍未观察到脑血流的明显下降,受体的血流动力学扰乱较小,但这一疗法的安全性仍未得到广泛认同,其在ICH治疗领域有待进一步研究。
经脉管移植的干细胞利用率较低,不能很好地靶向干细胞至脑出血病灶。静脉注射干细胞,其滞留在肺部的比例较高,而动脉注射则虽然可以避免肺部微血管带来的首过效应,但较大直径的干细胞能否顺利透过血脑屏障靶向病灶仍存疑。因此,直接将干细胞注射进脑实质或脑脊液,这可能是一种更具有病灶靶向性的移植方式。脑实质、侧脑室或鞘内注射干细胞,为干细胞通过血脑屏障提供了有效途径,避免了肺的首过效应、脾脏的吞噬作用,移植细胞及其来源的营养因子可以更好地作用于病灶。但直接将干细胞暴露于病灶的炎症、酸性、缺氧微环境中,并不利于移植细胞的存活。因此,结合血肿清除、高压氧疗、干细胞改造等方式,促进移植细胞的存活,才能更好地发挥治疗效应。此外,直接注射干细胞进入中枢神经系统,还要注意避免颅内感染、肿瘤形成、脑疝等严重并发症,对研究者的操作规范提出了更高要求。在此基础上,经鼻移植干细胞成为一种新兴的治疗策略。它作为一种非侵入的移植途径,操作十分简易,可以在很短的时间内完成。干细胞可以通过鼻腔内壁的嗅上皮细胞,经由嗅束或脑脊液进入脑组织,改善ICH预后。但是这一移植方式的效率明显不如直接脑内注射高,相当部分的干细胞经由消化道进入胃肠器官,能够顺利跨过鼻腔内壁进入脑组织的干细胞可能只有移植量的约0.3%,虽然在透明质酸酶的辅助下,这一比例可能增加一倍左右,但到达海马、丘脑、皮层等部位的移植细胞数目增多并不明显。
在临床前实验中,腹腔注射比静脉注射操作更方便,且移植物在腹腔中短暂停留使得作用持续时间相对更长,因此,腹腔注射干细胞在临床前研究中的意义也应当重视。Marzban M等人探究了腹腔注射BM-MSC在多发性硬化症治疗中的意义,虽未见BM-MSC迁移至胼胝体,但脱髓鞘损伤缓解,证明了腹腔注射干细胞在治疗中枢神经系统病变的潜能。目前腹腔注射干细胞的研究多聚焦于糖尿病、结肠炎、卵巢癌等疾病,其是否能够改善脑出血疗效还有待研究。
目前已经在ICH患者上试验过的移植途径包括静脉注射、腰椎穿刺、脑实质注射、脑室内注射、经鼻移植,在缺血性脑卒中治疗中,经动脉输注干细胞也开展了人体试验。总的来说,这些移植方式都没有观察到与移植直接相关的严重不良反应,患者病情在接受干细胞移植后都在不同程度上有所改善。
03
移植时间
移植干细胞治疗脑出血时,选择合适的时间非常关键,会在很大程度上影响治疗效果。
移植时间影响干细胞的存活。移植干细胞的存活是决定治疗效果的重要因素,而随着时间动态变化的移植后微环境在很大程度上影响了这一重要因素。脑出血后,患者血肿周围脑组织可检测到一过性炎症因子的高表达,包括HO-1、TNF-α、IL-1β在内的细胞因子,在脑出血发生后6~72小时内到达高峰。这些急性期的有害物质会引发亚铁离子升高、能量代谢异常、细胞凋亡水平升高,从而对干细胞的生存产生负面影响,导致干细胞数量减少,最终直接影响脑组织的修复和再生。但这并不代表延迟移植会起到更大的收益,如果移植时间过晚,患者可能会因为组织损伤过重,导致神经元损伤不可逆,限制了移植干细胞的治疗效果。
移植时间影响干细胞的归巢。归巢指的是干细胞定向迁移到脑组织的损伤部位这一过程,干细胞能否归巢到病灶周围将直接影响干细胞的修复效果。在脑出血发生后8-12h,血脑屏障通透性显著升高,这使得干细胞相对容易进入脑组织。除外血脑屏障通透性的病理性降低,在干细胞的迁移过程中,诸多细胞因子起到了重要的诱导作用,如SDF-1、PDGF、BDNF。这些诱导因子在脑出血后特定时间窗内均表现出一过性升高,如SDF-1在患者脑出血发作后约7.2h时明显升高,PDGF在动物模型上被观察到在脑出血后约6h时达到峰值,BDNF在ICH患者CSF中的达峰时间则在3天左右。若移植时间过晚,血脑屏障的修复和诱导因子的降低则不利于干细胞的归巢,这大概率会影响最终治疗效果。
移植时间影响干细胞的分化。移植后,干细胞向有益的细胞类型分化,可以起到特定的治疗效果。向神经元方向分化有希望促进神经环路修复;向胶质细胞方向分化可分泌多种生长因子和细胞外基质,调节微环境;向血管内皮方向分化则可以促进血管内皮细胞的再生、修复,预防再出血。研究表明,在脑出血后2天~28天时间段内行干细胞移植手术,随着移植时间的推迟,移植细胞中分化为星形胶质细胞的占比不断下降,而神经元细胞比例不断升高。因此,选取合适的时间点行移植手术,或者选取几个特定的时间点多次移植,从而调整干细胞的分化方向,这有望改善干细胞治疗疗效。
综上所述,在目前开展的脑出血干细胞治疗研究中,采用的移植途径众多,可选的移植时间点也从出血发生即刻跨度至出血后2个月,关于在何时以何种途径行移植手术可以达到最佳治疗效果并没有达成一致的明确结论。但Yang Hu等人一项纳入了40项脑出血临床前研究的Meta分析表明,脑内注射可能是改善脑出血后行为学与结构性损伤的最有效移植途径,超过1周的延迟移植可能是减轻脑出血后结构性损伤的最佳移植时间点。值得注意的是,制定移植策略时,移植途径、移植时间、移植剂量、细胞类型、病情程度等作为相互影响的共同变量,共同决定了最终疗效,因此,一套全面且个体化的治疗方案才有可能使治疗效果达到最大化。

改善干细胞移植疗效的手段

01
移植前对干细胞进行低氧预处理
脑出血发生时,血管结构破坏导致脑部血液供应不足,这将直接导致脑组织缺氧。而受损细胞会释放出多种炎症介质和毒素,引起脑水肿进而压迫脑部血管,血液供应受阻,从而降低脑组织的氧含量。此外,脑出血发生后,脑血管通透性增加,导致血管内液体渗出,加重脑组织的缺氧和缺血。因此,脑出血发生后,脑部微环境中氧含量往往低于正常生理水平,这不利于干细胞存活。
基于上述原因,在移植前对干细胞进行低氧环境预处理有望提高干细胞治疗效果。Takuma Wakai等人的研究表明,5%低氧环境下预先处理24小时可以显著提高神经干细胞移植后的存活率。经过低氧预适应的神经干细胞,血管内皮生长因子(vascular endothelial growth factor,VEGF)的分泌量明显提高,移植于ICH小鼠后,前肢运动功能以及整体运动协调能力的恢复均优于未处理神经干细胞移植组。
02
基因修饰
脑出血后,脑组织缺血缺氧,细胞线粒体功能受损,导致能量代谢紊乱,生成大量有毒ROS,ROS在细胞内积累,损伤细胞的DNA、蛋白质和生物膜,不利于脑出血后的组织修复与功能恢复。而超氧化物歧化酶1(super-oxide dismutase 1)作为细胞内清除ROS的一种重要酶,可以将超氧阴离子催化成较为稳定的氧分子(O₂)和过氧化氢(H₂O₂),后者进一步在谷胱甘肽(glutathione,GSH)、过氧化物酶(glutathione peroxidase,GPx)等酶类作用下转化成相对低毒害物质。基于此,移植前对干细胞进行基因水平调控,上调超氧化物歧化酶1(superoxide dismutase 1,SOD1)蛋白表达水平可以有效降低ICH后脑组织的ROS含量,大幅提高移植细胞的存活率,干细胞来源的旁分泌因子也明显升高,损伤部位的神经元存活数目增加,有效促进了行为功能水平的恢复。
除了上调SOD1因子水平,研究表明上调肝细胞生长因子(hepatocyte growth factor,HGF)、胶质细胞源性神经营养因子(glial cell line-derived neurotrophic factor,GDNF),同样可以改善干细胞疗法疗效:促进髓鞘损伤修复、诱导轴突再生、加速运动功能恢复;降低细胞凋亡水平、减少血肿体积、促使神经功能恢复。
03
联合疗法
由于脑出血后损伤病理生理机制复杂,并且是一个涉及神经系统、循环系统、免疫系统、血液系统等的全身性过程,因此单一运用干细胞移植疗效不免受限。如果从其他器官系统角度出发,运用多种联合疗法,有望提高ICH后干细胞疗法治疗效果。
干细胞移植联合高压氧治疗可以改善治疗效果。高压氧治疗时,患者于高压气室中呼吸高浓度的氧气,从而促进肺部吸入更多氧气,增加血氧浓度。因此氧气能够更加充分地分配到体内的各个组织中,有效提高脑组织微环境的氧气含量,缓解脑组织代谢紊乱。在脑出血后联合使用高压氧治疗与人脐带血干细胞移植治疗,相比于单一疗法,在调节炎症、降低氧化应激、减少自噬与细胞凋亡,促进血管生成和保护神经元等方面都表现出了明显的优势。
干细胞移植联合免疫调节可以改善治疗效果。虽然干细胞移植能够在一定程度上调控炎症反应,下调脑出血后小胶质细胞的活化,但脑出血后IL-17等炎症因子表达水平大幅升高,从而诱发神经炎性反应,导致脑组织的破坏,加重脑出血后的神经损伤。不仅如此,过高的IL-17对干细胞的分化也会产生不利影响,影响干细胞移植疗效。在移植干细胞治疗脑出血的同时,使用IL-17中和抗体辅助治疗,可以结合体内过高的IL-17,降低血肿周围IL-17含量。这能够在一定程度上抵消IL-17的不良影响,促进移植干细胞向星形胶质细胞方向分化。类似地,使用铁-槲皮素复合物(Iron-Quercetin Complex)能够抑制Mincle/syk通路,减轻神经炎症反应,提高干细胞移植疗效。
干细胞移植联合清除血肿可以改善治疗效果。脑出血后血肿中含有多种有毒成分,对脑组织产生不利影响。血红蛋白和铁离子会引起氧自由基和氮自由基的生成,导致细胞膜的脂质过氧化和蛋白质的氧化损伤;炎性细胞和炎性因子导致神经元凋亡和神经元损伤;血小板和凝血因子引起血栓和微血栓形成,加重脑部缺血缺氧损伤。因此,血液可溶成分,尤其是凝血酶(thrombin)对SVZ区的神经干细胞及少突胶质细胞前体细胞(oligodendrocyte precursor cell)有明显毒性。由此,在移植干细胞前通过手术彻底清除血肿以及术后充分引流血性脑脊液,这是一种潜在的改善干细胞移植疗效的治疗策略。
04
诱导迁移与分化
05
其他
除外上述辅助治疗策略,近年来新出现了电刺激、经颅磁刺激等辅助治疗方式,可以诱导移植干细胞分化,上调神经营养因子的表达,促进神经元及胶质细胞存活,改善脑出血后脑组织结构,增强移植干细胞的修复作用。值得关注的是,最近的研究中,低强度脉冲超声波被证实可以增强BM-MSC来源外泌体的抗炎能力,蓝光照射被观察到能够增强UC-MSC的促血管生成能力,因此这也是两种潜在的可能提高ICH后干细胞治疗疗效的辅助手段。
上述手段都是可以改善干细胞移植疗效的有效方法。低氧预处理可以提高干细胞的适应能力,增加存活率;基因修饰可以通过提高细胞的ROS清除能力来保护细胞免受损伤;联合疗法也是一种有效的方法,例如与高压氧治疗、免疫调节和血肿清除等方法相结合,可以提高治疗效果,促进组织修复和功能恢复。总体来说,综合运用各种手段,可以更好地发挥干细胞的治疗潜力,改善脑出血等疾病的疗效,为患者的康复带来更多希望。
干细胞移植疗法的安全性分析
01
肿瘤形成
02
免疫排斥反应
03
其他不良反应
移植前未充分排查潜在的病原菌会增加疾病传播的风险。如果供体本身患有传染病,其来源的干细胞也可能携带病毒等病原体。人巨细胞病毒(human cytomegalovirus,HCMV)就被发现可以在不表达病毒裂解基因(virus lytic gene)的情形下潜伏在髓样树突状细胞祖细胞(myeloid dendritic cell progenitor)中,并在分化为树突状细胞的过程中再活化。此外,干细胞对某些病毒也表现出易感性,提取、保存与移植过程操作不当,同样有造成疾病传播的风险。Yanxin Huang等人的研究证实,乙肝病毒可以侵犯感染造血干细胞并在其内复制,使造血干细胞成为乙肝病毒的肝脏外储存库,故不能排除乙肝病毒从乙肝携带者孕妇侵犯感染胎儿,造成脐带血污染的可能。因此,在干细胞移植前,必须对供体进行详细的筛查和检测;根据不同病原菌的传染途径,有针对性地预防;并对干细胞采用基因测序、RT-PCR、ELISA等手段抽检,尽可能降低干细胞携带病原体的风险。
移植前未充分离心与冲洗干细胞可能导致脑梗或心肌梗死。干细胞分离纯化后,可在10%DMSO条件下低温冻存,从而保护细胞免受冻结损伤,保证干细胞的活性,延长细胞的保存期,方便了干细胞的运输与分享。但是DMSO具有不可忽视的毒性,若连同干细胞一起移植进入患者体内,可导致弥散性血管痉挛,引发脑卒中或心肌梗死。因此移植前充分离心与冲洗以去除DMSO从而避免可能的毒性是必要的。
移植时操作不当可能导致手术并发症。脑出血的干细胞治疗常用的移植途径包括血管内注射、脑实质注射等,理论上来说,血管内注射干细胞可能引发急性栓塞;脑内注射干细胞则可能引发术中出血、颅内感染等严重的脑外科手术并发症。此外,有报道称脑内递送的干细胞可能形成细胞团,不仅阻碍其进一步迁移到受损的大脑部位,限制了疗效,更可能造成脑脊液循环障碍,增加脑积液发病风险。但是,上述严重手术并发症在规范手术操作的前提下是可以避免的,目前开展的脑出血干细胞治疗临床研究均为发现明显手术并发症。
移植后异常的新生血管可能导致动静脉畸形。虽然干细胞治疗可促进新生血管生成,但如果新生血管生成过于快速或不受控制,可能增加动脉和静脉之间异常连接的风险。Makoto Nakamura等人的病例报道中,一位接受了海藻酸盐微囊包被的MSC治疗2周的患者,在干细胞移植术后3年出现新发动静脉畸形,推测可能是干细胞来源的血管生成肽产生的不良反应。
移植后干细胞异常的迁移可能导致癫痫。理论上,如果干细胞在错误的位置分化为神经元,并且这些神经元异常激活,可能导致癫痫的发生。然而,目前的研究表明,干细胞移植治疗并不一定会引发癫痫。实际上,一些研究甚至显示,经过筛选的合适类型神经干细胞可能对癫痫具有治疗效果,可以改善癫痫发作频率和发作时间。目前未见脑出血干细胞治疗发生癫痫的有关报道,但由于研究仍处于早期阶段,还需要更多的研究来全面评估干细胞移植治疗的癫痫发作风险。
虽然理论上来说,干细胞疗法存在以上潜在的风险,但目前开展的临床研究中均未观察到明显与移植相关的严重不良反应,故在充分监测与适当干预的前提下对脑出血患者进行干细胞治疗是安全的。
结 论
作为一种严重威胁人类健康与生活质量的疾病,脑出血的治疗手段还十分有限,正是在这一背景下,干细胞移植疗法被寄予厚望。越来越多的研究证实,移植干细胞可以减轻脑出血后的神经炎症,加速血管新生,促进神经再生与功能恢复,具有不可忽视的治疗潜能。同时,干细胞移植疗法的安全性也在众多研究当中得到初步证实,为干细胞的临床转化铺平了道路。目前脑出血后干细胞移植疗法的研究风向在于不断优化移植方案:选择合适的细胞类型、移植时间与移植途径,改善细胞状态与功能,结合多种治疗方式将治疗效应最大化。然而,仍然需要进一步的研究来解决上述关键问题,并推动大规模临床试验,这也是未来发展的方向,从而为脑出血患者提供更有效的治疗手段。
通讯作者简介
胡荣 教授
陆军军医大学第一附属医院(西南医院)
教授、主任医师、博士生导师
重庆西南医院神经外科(国家重点学科、国家临床重点专科、重庆市神经外科临床研究中心)主任
国家重点研发计划项目首席专家、重庆市杰出青年、重庆英才•创新领军人才、高校创新研究群体负责人
兼任重庆市医学会卒中分会主任委员、中国医师协会神经修复学专业委员会委员、中华医学会神经外科学分会颅脑创伤专家委员会委员等
临床主要从事:1.神经内镜经鼻和经颅微创切除颅底肿瘤;2.脑出血精准诊疗与修复;3.多模态导航与术中唤醒下脑深部肿瘤精准切除
主要研究方向:1.脑卒中后神经损伤与修复;2.微环境与干细胞命运决定;3.脑出血诊治的多中心临床研究
主持国家重点研发计划项目、国家973计划项目子课题、国家自然科学基金项目等各级科研项目28项,牵头国内多中心临床研究1项,参与国际多中心临床研究1项
获批专利12项(其中PCT专利2项,发明专利7项);获“中国医师协会神经外科分会全国手术大赛一等奖”、“王忠诚中国神经外科优秀青年医师奖”、“踏血无痕脑肿瘤显微手术大赛第二名” 和“全军神外手术大赛银奖”
声明:脑医汇旗下神外资讯、神介资讯、神内资讯、脑医咨询、AiBrain 所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。







