德国癌症研究中心的Niklas Grassl等首次将H3K27M疫苗注射给8例进展性H3K27M弥漫性中线胶质瘤患者并证实有效,结果在线发表在2023年9月的《Nat Med》上。
——摘自文章章节
【REF: Grassl N, et al. Nat Med. 2023;29(10):2586-2592. doi:10.1038/s41591-023-02555-6】
研究背景
研究方法
该研究纳入2017年8月至2022年11月在海德堡大学曼海姆医院接种H3K27M疫苗的患者。纳入标准为组织学证实H3K27M+DMG。允许同时进行PD-1单抗治疗,所有患者之前均接受放疗和替莫唑胺化疗。排除标准:①地塞米松(或等效)>4mg/d;②Karnofsky绩效指标(Karnofsky performance index,KPI)<70;③年龄<18岁。磁共振每12±2周进行,每次接种疫苗及此后每12周评估不良反应。H3K27M疫苗由德国蒂宾根大学合成,皮下注射到患者腹部或大腿,注射部位尽可能靠近之前注射部位,注射目标是相同淋巴结引流。影像伪进展定义为T2-FLAIR MRI序列中肿瘤增大然后稳定或缩小。所有统计分析都在R语言版本3.6.1中进行。
研究结果
在标准治疗方案后,共有8位患者组织学证实为H3K27M+DMG而且不符合目前正在进行的多中心I期临床试验(NCT04808245)的入组条件,在同情性用药途径接受了H3K27M疫苗。4名女性,4名男性,年龄为28.0±5.3岁, KPI至少70%。接种疫苗前在神经肿瘤治疗反应评估标准下,所有患者评定为明确的进行性疾病。肿瘤3例位于丘脑,2例位于脑桥,2例位于脊髓,1例位于顶叶,其中一例在小脑和腰髓有多发病灶。2例完全切除,3例部分切除,3例活检。第一次给药时,2例服用地塞米松(2mg),1例(4mg)。所有患者均已接受30次放疗,总剂量为54-60Gy,并接受替莫唑胺化疗。1例接受洛莫司汀治疗,并在接种疫苗后继续治疗。中位肿瘤大小为407.8±589.4 mm2。患者接受H3K27M疫苗皮下注射,每两周一次,持续6周,然后每月一次,持续4月,然后每季度给药一次。5例接受H3K27M疫苗联合抗PD-1,每次接种疫苗前,根据不良事件通用标准对不良事件进行评估。此外治疗计划包括每月抽血进行免疫监测,为期6个月,此后每3个月抽血一次,以及每3个月影像评估一次。如果有临床指征则进行脑脊液分析。H3K27M疫苗治疗的持续时间为78-1295天(中位数158天)。
自H3K27M疫苗给药开始,观察持续时间为191至1414天(中位数391天)。患者接受了8±4.9次疫苗接种。一名患者在接种了八次疫苗后停止H3K27M疫苗接种,但20个月后恢复治疗。两名患者经历了1级注射部位反应,归因于H3K27M疫苗。观察期内的其他8例1级事件被判断为与治疗相关,但与H3K27M疫苗无关,没有发生更高级别的治疗相关毒性。5例观察到H3K27M疫苗诱导的外周T细胞免疫应答,首次检测到H3K27M特异性免疫反应为2次疫苗注射(四分位数范围2-4),时间为治疗开始后4周(四分位数范围4-10)。4例有反应患者中,外周血中检测到特异性ELISpot反应。H3K27M特异性外周免疫反应与年龄(P=0.60)、性别(P=0.46)、KPI(P=0.75)、切除程度(P=0.94)、肿瘤大小(P=0.08)、组织学诊断到开始接种疫苗时间(P=0.06)、伴PD-1单抗治疗(P=0.57)、地塞米松(P=0.15)之间没有明显相关。6例观察到短暂的放射学改善,其中5例为首次检测到H3K27M特异性免疫反应后不久发生(图1a,b)。所有患者开始接种疫苗后的中位无进展生存期(progression free survival, PFS)为6.2月,OS为12.8月(图1b、c)。在首次检测到突变特异性外周免疫反应后6周内,1例(ID1)接种H3K27M疫苗但未同时进行PD-1单抗治疗的患者显示出影像伪进展(图1a,d)。另一例(ID8)同时行PD-1单抗治疗显示早期放射学进展,随后疾病稳定(图1e)。福尔马林固定石蜡包埋肿瘤组织蛋白质邻近连接分析技术(Proximity ligation assay,PLA)表明,H3K27M新表位与HLA II-DR类共定位于7名患者肿瘤细胞和髓细胞,采用4,6-联脒-2-苯基吲哚(4',6-diamidino-2-phenylindole,2-(4-amidinophenyl)-1H–indole,DAPI)、胶质纤维酸性蛋白(glial fibrillary acidic protein, GFAP)和离子化钙结合适配分子(ionized calcium-binding adaptor molecule 1,IBA1)共染色(图2a–c),结果表明H3K27M疫苗刺激下出现H3K27M新表位和H3K27M特异性肿瘤浸润HLA DR限制性T细胞。免疫组化结果显示,MHC Ⅱ表达的个体差异很明显,阳性细胞数为22%至85%,两名患者(ID1和ID8)在检测到H3K27M特异性外周免疫反应后疗效显著(图2d,e)。在H3突变肽或野生肽刺激下外周CD4+和CD8+T细胞结果表明,H3K27M特异性免疫反应是CD4+T细胞介导的,可以由MHC II类抗体抑制,但不能被MHC I类抗体抑制(图3a-e)。肽刺激下外周血单核细胞细胞因子染色证实存在H3K27M特异性CD4+T细胞反应,没有证据表明存在H3K27M疫苗诱导的CD25+FoxP3+调节T细胞(图3f-j)。患者(ID1)影像伪进展后,脑脊液中检测到前十个疫苗诱导H3K27M扩展CD4+T细胞受体(T cell receptor,TCR),显示这10个TCR的CDR3β区序列相似性,随后该患者31月后肿瘤完全缓解(图3k,l)。
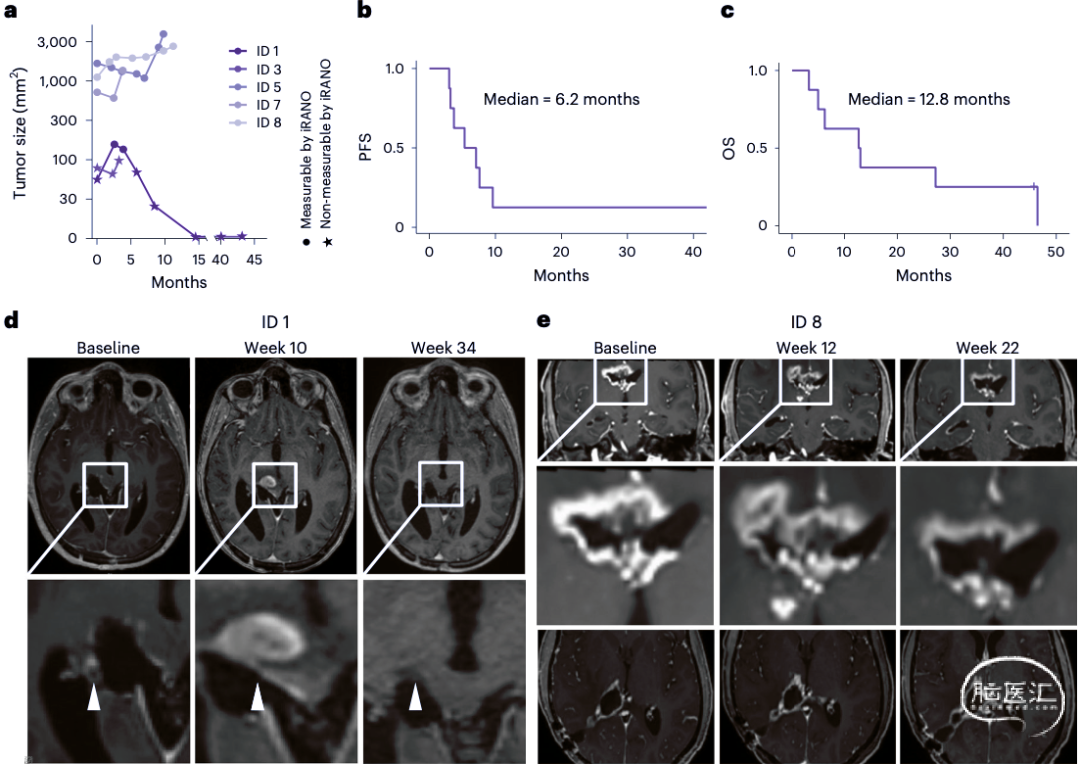
图1. H3K27M疫苗的临床反应。a.肿瘤大小与疫苗接种开始时间的函数。b.PFS与疫苗接种开始时间的函数。c.OS与疫苗接种开始时间的函数。d.患者(ID1)在开始、第10周和第34周的T1增强序列。白色箭头表示在第10周出现影像伪进展。e.患者(ID 8)的T1增强序列,开始和第12周之间有早期进展,随后疾病稳定,同时在第18周外周血中首次检测到H3K27M特异性免疫反应。

图2. H3K27M新表位与HLA II-DR抗体共定位于肿瘤细胞和髓细胞。a.患者(ID1)和(ID8)原发性肿瘤组织的PLA与H3K27M和HLA-DR抗体(红色)DAPI核染色为蓝色。b. GFAP染色为绿色。c. IBA1染色为绿色。独立重复两次,结果相似。比例尺为白色(30μm)和灰色(10μm)。d.在7例有福尔马林固定石蜡包埋组织样本的患者中,每个视野的PLA斑点与HLA-DR表达的免疫组织化学评分进行Pearson相关性分析。采用双侧t检验。e.滚球算法去除背景、高斯滤波快速算法和最大值检测后进行自动分割。比例尺为白色(30μm)。

图3. H3K27M特异性免疫应答是CD4+T细胞介导的。a.通过抗MHC II类抗体抑制H3K27M特异性干扰素-γELISpot应答,而不是通过抗MHC I类抗体,与基线相比自疫苗接种以来18周(P=0.002;P=0.008,自上而下)和22周(P=0.001;P=0.006,自上而下)差异明显。双侧t检验,不针对多重比较进行调整。点表示单个数据点,条形图显示平均值,误差条形图表示标准差,**表示p<0.01,***表示p<0.001。b-e.通过流式细胞仪检测H3K27M肽扩增外周血单个核细胞IFN-γ和TNF-α,在用H3野生肽(b,d)或H3突变肽(c,e)刺激下的CD4+(b,c)和CD8+(d,e)T细胞亚群。f.体外和扩增后胞内细胞因子染色证实H3突变肽和H3野生肽刺激下表达TNF-α的T细胞在所有CD4+T细胞中百分比。ELISpot应答用柱状图表达。g-j. H3K27M反应性TNF-α+CD4+T细胞(橙色)与H3K27M无反应性CD4+T细胞(灰色),不包含CD25+FoxP3+调节性T细胞。描述了来自患者(ID1)18周(g)和118周(h)以及患者(ID8)0周(i)和18周(j)的体外胞内细胞因子染色数据。k.在患者(ID1)不同时间点,十个H3K27M扩增最丰富的CD4+T细胞占原发组织、脑脊液和外周血中所有T细胞的比例。i.去除重复出现的CAS序列后,k中10个TCRs的CDR3β区序列相似性的模式图。在脑脊液中检测到的TCR3、TCR4和TCR6的CDR3β与基序的重叠由颜色和下划线表示。
研究结论
该研究结果表明,①使用长肽(如27个氨基酸的H3K27M疫苗)无论是否同时行PD-1单抗治疗都是安全的,并且能在H3K27M+DMG患者体内诱导与突变相关的CD4+T细胞反应。②H3K27M疫苗和IDH1疫苗都靶向肿瘤细胞蛋白质的克隆驱动突变,并且这些突变对肿瘤生长很重要。③H3K27M疫苗诱导的T细胞克隆在外周血和脑脊液中均被检测到,并与影像上肿瘤回缩同时扩增。将H3K27M疫苗用于新诊断的H3K27M+DMG患者,并与标准一线治疗同时进行,可以使CD4+T细胞介导的抗肿瘤免疫提供治疗效益最大化。

声明:脑医汇旗下神外资讯、神介资讯、神内资讯、脑医咨询、AiBrain 所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。






