
【大家说】栏目,关注脑疾病转化医学前沿,综合研究成果概述、研究作者自述和国内权威专家解读。本期栏目,我们特别邀请到中山大学肿瘤防治中心的陈忠平教授,为我们解读并分享最新发表在《Cancer Discovery》上关于ONC201对H3K27M突变型弥漫性中线胶质瘤的临床疗效及其作用机制的研究成果。
一、研究概述
弥漫性中线胶质瘤(DMG)的H3K27M组蛋白突变(包括H3.3和H3.1/H3.2)与侵袭性临床行为和中位总生存期(OS)11~15个月相关。H3K27M突变最常见于儿童和青年位于中枢神经系统(CNS)中线结构的胶质瘤。大多数突变携带患者的肿瘤位于丘脑和脑干;因生长部位的原因,这些肿瘤的手术切除受到限制,且目前尚无有效的系统疗法。
在研小分子ONC201是一种多巴胺受体D2(DRD2)拮抗剂。通过激活整合应激反应(ISR)并让AKT和ERK失活,ONC201可在治疗浓度下表现出大脑透过性以及针对胶质瘤和其他实体瘤的临床前活性。与历史对照组相比,无分子分层的ONC201治疗成人复发胶质母细胞瘤(GBM)并未改善无进展生存期(PFS);然而,在偶然纳入该试验2个GBM组的4例H3K27M突变型患者中,有2例表现出多发病变的持续消退。一项随访研究表明,在多项持续治疗研究的混合队列中,H3K27M-DMG患者(n=18)表现出持久的治疗反应。目前尚无研究对已完成的H3K27M-DMG相关试验的结果进行报告,H3K27M-DMG对ONC201的反应机制也不明确。
近日,一项研究报告了最近完成的2项临床研究中ONC201治疗H3K27M-DMG的临床结果,并对接受治疗的患者进行了基线肿瘤RNA测序(RNA-seq)和肿瘤组织/脑脊液(CSF)相关分析,以确定H3K27M突变型肿瘤的潜在反应机制,相关结果于2023年11月1日发表在《Cancer Discovery》(IF:28.2)上。

在这项研究中,研究者报告的2项试验分别是“ONC201治疗儿童H3K27M胶质瘤”(ONC201 in Pediatric H3K27M Gliomas [NCT03416530],以下简称“ONC201-014”),以及“将ONC201治疗扩大至H3K27M突变型和/或高级别中线胶质瘤患者”(Expanded Access to ONC201 for Patients With H3K27M-mutant and/or Midline High Grade Gliomas [NCT03134131],以下简称“ONC201-018”)。在ONC201-014中,30例患者符合预先设定的疗效分析标准,其中24例在放疗后、复发前入组,6例为复发患者。ONC201-018中41例符合标准,11例在放疗后、复发前入组,30例为复发患者。
OS相关结果显示,ONC201治疗的非复发H3K27M-DMG患者(n=35)中位OS为21.7个月(自诊断起);ONC201-014(n=24)和ONC201-018(n=11)的中位OS差异无统计学意义,分别为21.7个月和13.9个月。ONC201-014/018复发患者(n=36)中位OS(自复发起)为9.3个月(因ONC201-014复发患者较少[n=6]而合并计算),中位PFS(自复发起)为3.4个月。

接受ONC201治疗的患者按照高级别胶质瘤(HGG)神经肿瘤学反应评估(RANO)标准进行影像学分析。结果显示,在ONC201-014患者中,部分缓解(PR)6例(31.6%),疾病稳定(SD)7例(36.8%),疾病进展(PD)6例(31.6%);治疗期间,中位至PR时间为8个月(2.3~20.7),影像学缓解的中位持续时间为14个月(0~31.0)。在ONC201-018患者中,PR为9例(40.9%),SD为8例(36.4%),PD为5例(22.7%);中位至PR时间为7.6个月(2.5~11.7),影像学缓解中位持续时间为8个月(0~16)。此外,ONC201-014非复发患者的脑灌注成像分析显示,表化的基线相对脑血容量(nrCBV)与OS(r=-0.74,P=0.004)、PFS(r=-0.76,P=0.002)之间呈显著负相关。

在与H3K27M-DMG确诊患者的历史队列进行探索性比较时,调整潜在混杂因素后的多变量Cox分析显示,ONC201治疗具有显著性(P=0.0005);进一步剔除早期失败的患者(OS<3个月)后,调整后的多变量Cox分析结果依然显示出ONC201治疗在统计学上的显著性(P=0.0003)。比较ONC201治疗的非复发DMG患者(n=35)和未治疗的H3K27M-DMG历史对照组患者(n=274)的生存分析显示,前者的OS显著延长(中位OS 21.7个月 vs 12个月,P<0.0001)。探索性比较的相关数据均表明,ONC201对H3K27M-DMG患者有益。
为了探索对ONC201有影像学缓解的H3K27M-DMG患者的分子属性,研究者分析了一个单中心队列,对其进行了基线肿瘤DNA(n=20)/mRNA(n=13)测序(MiOncoSeq)。他们发现,与线粒体代谢(包括类固醇生物合成、氧化磷酸化和三羧酸[TCA]循环)相关的基因和基因集上调的肿瘤,与临床影像学缓解呈正相关。相比之下,T细胞受体信号通路和Wnt通路相关基因(包括GLI3、WNT10B和APC),与不良的影像学缓解相关。
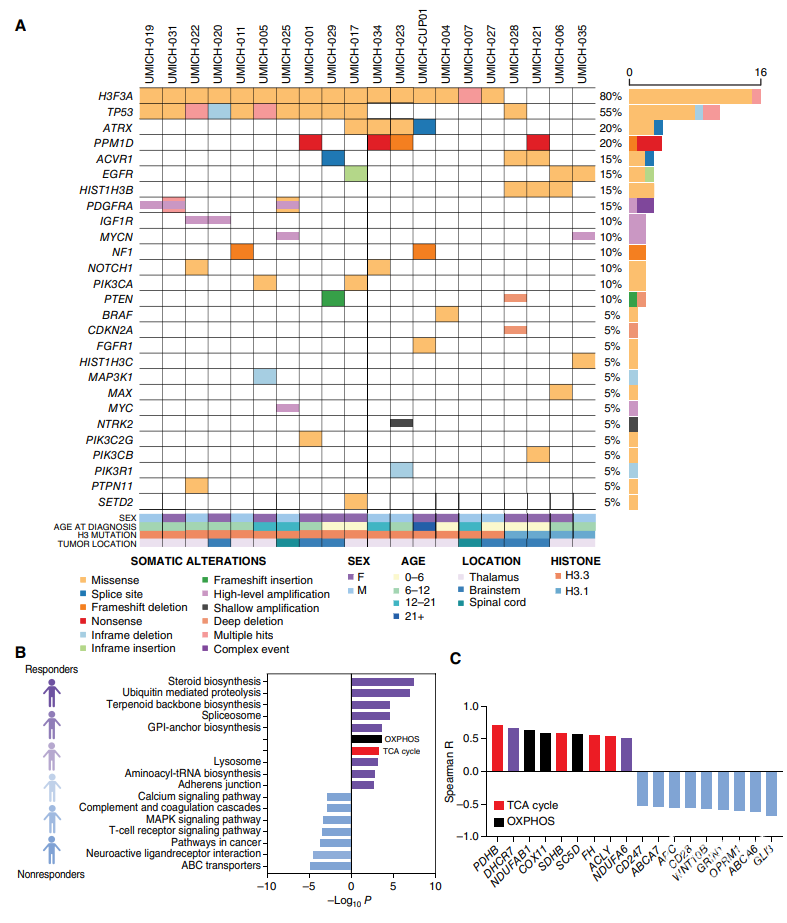
随后,研究者聚焦于ONC201治疗中关键的代谢变化。他们对经过ONC201处理的H3.3K27M DIPG007细胞进行了无偏倚整合基因表达(RNA-seq)和代谢组学分析。综合结果显示,TCA循环、糖酵解和丙酮酸途径的下调最显著,与糖酵解和TCA循环相关的关键因子下调相对应。H3.3K27M突变型DMG细胞也相应出现糖酵解和糖酵解能力的下降。多个线粒体功能相关参数在细胞外流量分析中亦有所降低。

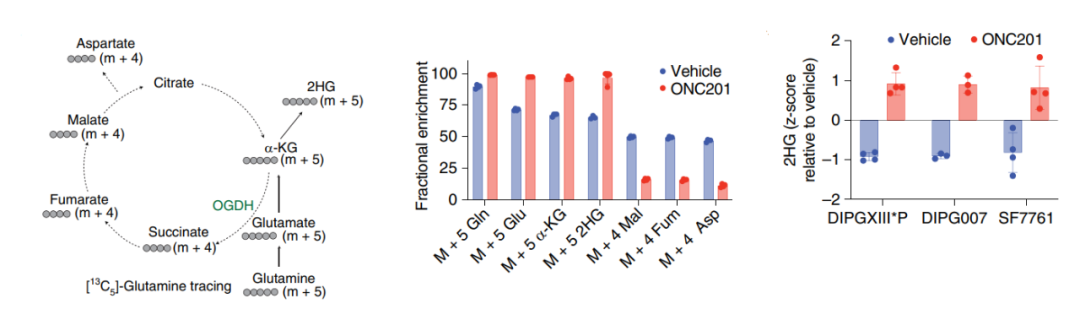
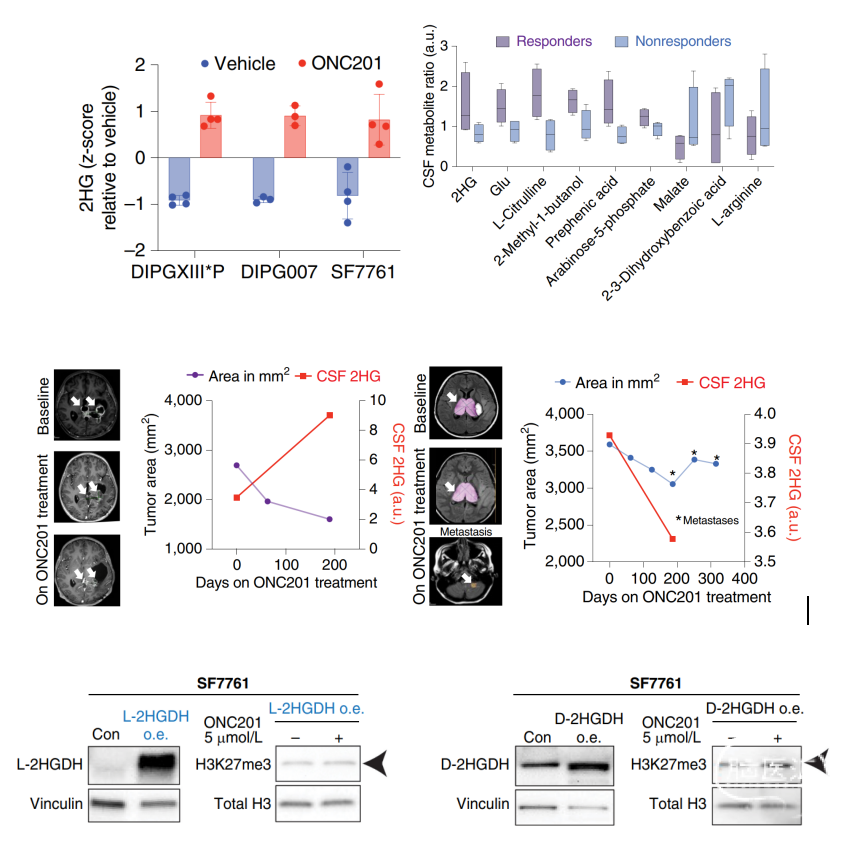
由于ONC201处理的H3K27M细胞中α-酮戊二酸(α-KG)的水平较高,因此研究者推测,ONC201治疗可能会导致代谢和表观遗传整合通路发生异常。代谢示踪研究显示,ONC201处理细胞的谷氨酰胺代谢水平升高,谷氨酰胺衍生的α-KG也对应增加;相反,葡萄糖衍生的α-KG水平有所下降。出乎意料的是,谷氨酰胺衍生的α-KG在ONC201处理细胞中被代谢成了2-羟基戊二酸(2HG)。随后,研究者评估了接受ONC201治疗的H3K27M-DMG患者脑脊液样本中的2HG水平变化。结果显示,与无影像学缓解的患者相比,在有影像学缓解患者的脑脊液中,代谢产物2HG和谷氨酸有增加的趋势。
此外,2HG会以L和D对映体的生理形式存在(L-2HG和D-2HG)。研究者在携带H3.3K27M突变的细胞系中发现,在经过/未经过ONC201处理的H3.3K27M细胞中,D-2HG水平可忽略不计;相反,L-2HG水平在ONC201处理细胞中显著增加。另外,H3K27M突变肿瘤的H3K27me3水平会全面下降,而有趣的是,ONC201处理导致多个H3.3/3.1K27M细胞系的H3K27me3水平发生了剂量依赖性增加。L-2HG和D-2HG有特异性脱氢酶(分别为L-2HGDH和D-2HGDH),可将每种亚型变回α-KG;在H3.3K27M细胞系中,L-2HGDH(而非D-2HGDH)的过度表达,逆转了ONC201介导的H3K27me3增加。因此,ONC201可能会诱导H3K27M-DMG细胞生成L-2HG对映体,进而导致H3K27me3的增加。
随后,研究者探索了ONC201是否会改变H3K27M细胞中与基因表达相关的染色质可及性。由于H3K27M肿瘤会对增强子产生成瘾性,因此基因组H3K27ac的变化也纳入到评估中。结果显示,启动子和增强子的染色质可及性(ATAC-seq)均下降;ONC201处理的细胞中,1161个染色质可及性降低的基因被下调;基因集富集分析(GESA)显示,与细胞周期和神经元发育相关的通路有所下调。H3K27ac主要在增强子处降低,ONC201处理细胞中1602个H3K27ac减少的基因有所下调;GSEA中主要与细胞周期调节相关的通路相应下调。
此外,H3K27M肿瘤会出现异常的H3K27ac富集型超级增强子。研究者发现,在ONC201处理的细胞中,预先设定的H3K27M特异性、H3K27ac标记的超级增强子全面减少;超级增强子相关的基因表达相应减少。下调的H3K27ac标记基因主要对应周期性肿瘤细胞。这些数据表明,ONC201在H3K27M-DMG细胞中,通过表观遗传的方式下调了与神经胶质分化和细胞周期相关的基因。

最后,研究者对2个非重叠独立队列中ONC201治疗患者的尸检肿瘤样本进行了H3K27me3免疫组化检测(IHC),以确认部分关键的体外发现。像ONC201处理的H3K27M细胞一样,在2个队列经ONC201治疗的H3K27M-DMG肿瘤样本中,H3K27M肿瘤细胞的H3K27me3水平全面上升。组合IHC证实,H3K27M阳性肿瘤细胞的H3K27me3有所增加。与2例未经治疗的患者相比,接受治疗的H3K27M-DMG患者的全基因组H3K27me3水平更高,且长期治疗患者的H3K27me3水平最高。ONC201治疗患者中H3K27me3显著增加的基因GSEA主要与形态发生/分化相关通路(包括神经元分化)相对应。此外,研究者注意到,启动子、外显子、内含子和3'UTR区域的基因组H3K27me3增加;相反,基因间区域的H3K27me3减少,表明ONC201使H3K27me3从基因间区域重新分布至基因区域。

综上,ONC201通过干扰代谢和表观遗传整合通路、逆转特殊病征性H3K27me3的减少,对H3K27M-DMG产生疗效。
+ + + + + + + + + + +
文章来源
Venneti S, Kawakibi AR, Ji S, et al. Clinical Efficacy of ONC201 in H3K27M-Mutant Diffuse Midline Gliomas Is Driven by Disruption of Integrated Metabolic and Epigenetic Pathways. Cancer Discov. 2023;13(11):2370-2393. doi:10.1158/2159-8290.CD-23-0131
二、作者自述
三、陈忠平教授的权威解读
专家介绍
陈忠平 教授
中山大学肿瘤防治中心
主任医师、教授、博士生导师
中山大学肿瘤防治中心神经外科创科主任,胶质瘤单病种首席专家
中国名医百强榜“脑胶质瘤手术Top 10医生”
王忠诚神经外科医师奖(2006年学术奖)
中国抗癌协会神经肿瘤专业委员会(第一、二、五届)主任委员
中华医学会神经外科分会神经肿瘤专业委员会第一届委员
中国医师协会神经外科医师分会神经肿瘤专业委员会第一届委员
广东省/广州抗癌协会神经肿瘤专业委员会第一届主任委员
广东省神经外科学会第七、届八副主任委员
《Glioma》主编
声明:脑医汇旗下神外资讯、神介资讯、神内资讯、脑医咨询、AiBrain 所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。






