
Hu, L., Shi, J., Shen, D. et al. Osimertinib induces paraptosis and TRIP13 confers resistance in glioblastoma cells. Cell Death Discov. 9, 333 (2023). https://doi.org/10.1038/s41420-023-01632-6
背 景
脑胶质瘤是起源于脑神经胶质细胞的肿瘤,是最常见的原发性颅内肿瘤,2021年版WHO中枢神经系统肿瘤分类将胶质瘤分成1-4级,其中胶质母细胞瘤(GBM)属于恶性程度最高的4级胶质瘤,一年生存率10%,五年生存率不足5%,中位生存期15-18个月。而在原发性GBM中最常见的分子生物学改变为表皮生长因子受体(EGFR)的扩增、过表达及突变,因此靶向EGFR已然成为了GBM的潜在治疗策略。
奥希替尼(Osimertinib),是一种第三代表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI),在临床试验及临床应用中已证明对肺癌等多种癌症具有显著疗效[1]。然而已批准的第一代和第二代EGFR-TKIs,如厄洛替尼,对改善GBM患者预后并无太大作用,部分原因在于其穿透血脑屏障(BBB)能力较差,而奥希替尼则表现出较强的血脑屏障穿透能力,并在临床前和临床试验中显示出对GBM细胞的抑制作用,从而为EGFR驱动的GBM的临床治疗提供了巨大的潜力。
结 果
1.Osimertinib在体内外对GBM具有显著的抑制作用
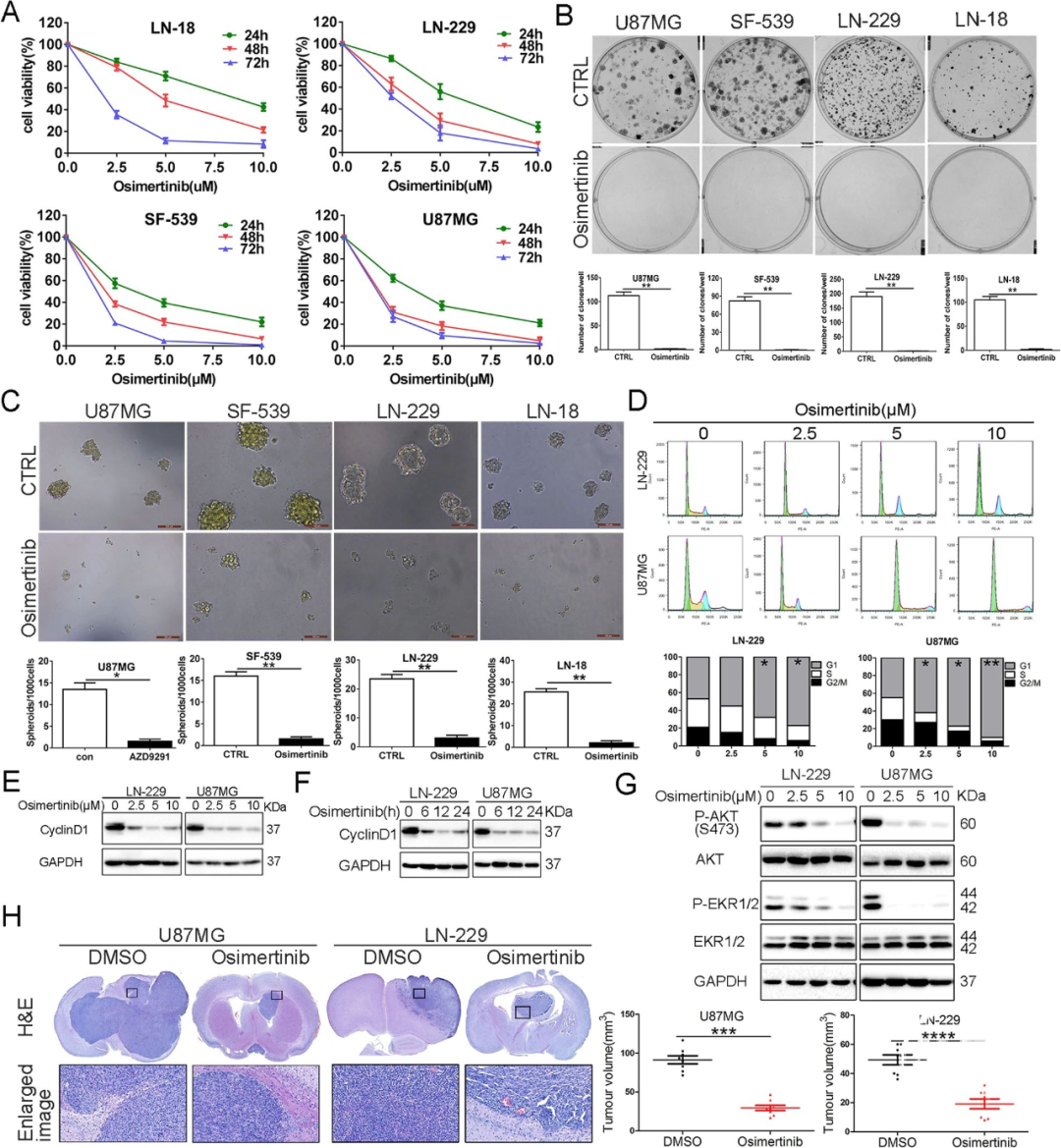
Osimertinib显著抑制了GBM细胞(LN-18、LN-229、SF-539和U87MG)的细胞活力、克隆形成、3D成球能力,并将GBM细胞的细胞周期阻滞在G2/M期(图1A-D);暴露于Osimertinib的GBM细胞中Cyclin D1蛋白水平呈剂量和时间依赖性减少(图1E、F)。同时,Osimertinib显著降低了细胞中EGFR下游两个主要的信号:AKT和ERK1/2的活化(图1G)。此外,Osimertinib显著减缓了异种移植小鼠脑肿瘤生长速度(图1H),佐证了体外实验结果。
2.Osimertinib可以诱导GBM细胞发生副凋亡样死亡
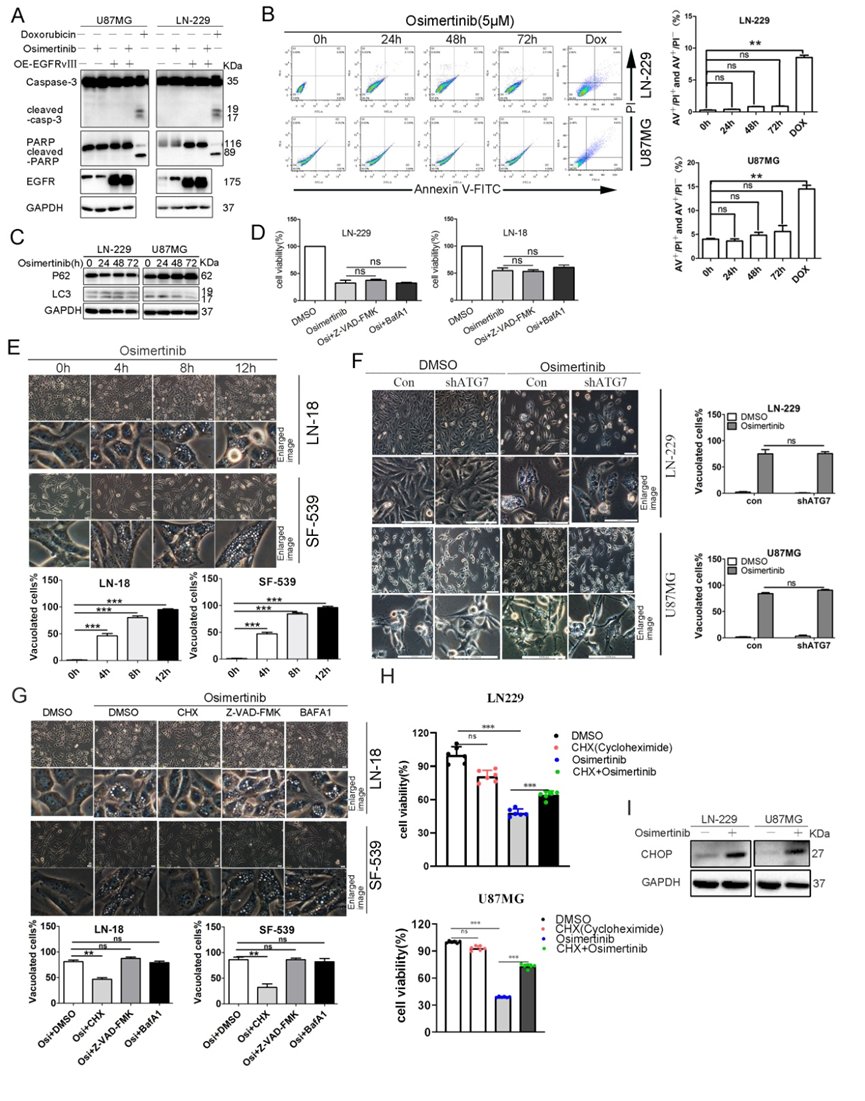
用不同浓度的Osimertinib处理GBM细胞不同时间,观察到Caspase-3和PARP这两种凋亡标志物的剪切水平没有显著的变化(图2A、B),我们在过表达EGFRvIII的GBM细胞中也得到了类似的结果。此外,Osimertinib处理GBM细胞也没有显著改变典型的自噬标志物LC3II和p62的表达水平。凋亡抑制剂z-VAD-FMK、自噬抑制剂BafA1也均未回复奥希替尼诱导的细胞死亡,以上结论证实了Osimertinib引起的GBM细胞死亡与凋亡或自噬无关。
随后,我们对Osimertinib处理的GBM细胞进行了细胞形态学观察,发现细胞质空泡呈时间依赖性积累,而细胞膜和细胞核基本保持完整(图2C)。为了研究细胞质中空泡的来源,对Osimertinib处理的LN-229细胞进行了电镜分析,发现了线粒体肿胀和内质网结构扩张(图2D),这种结构改变正是副凋亡的典型特征。
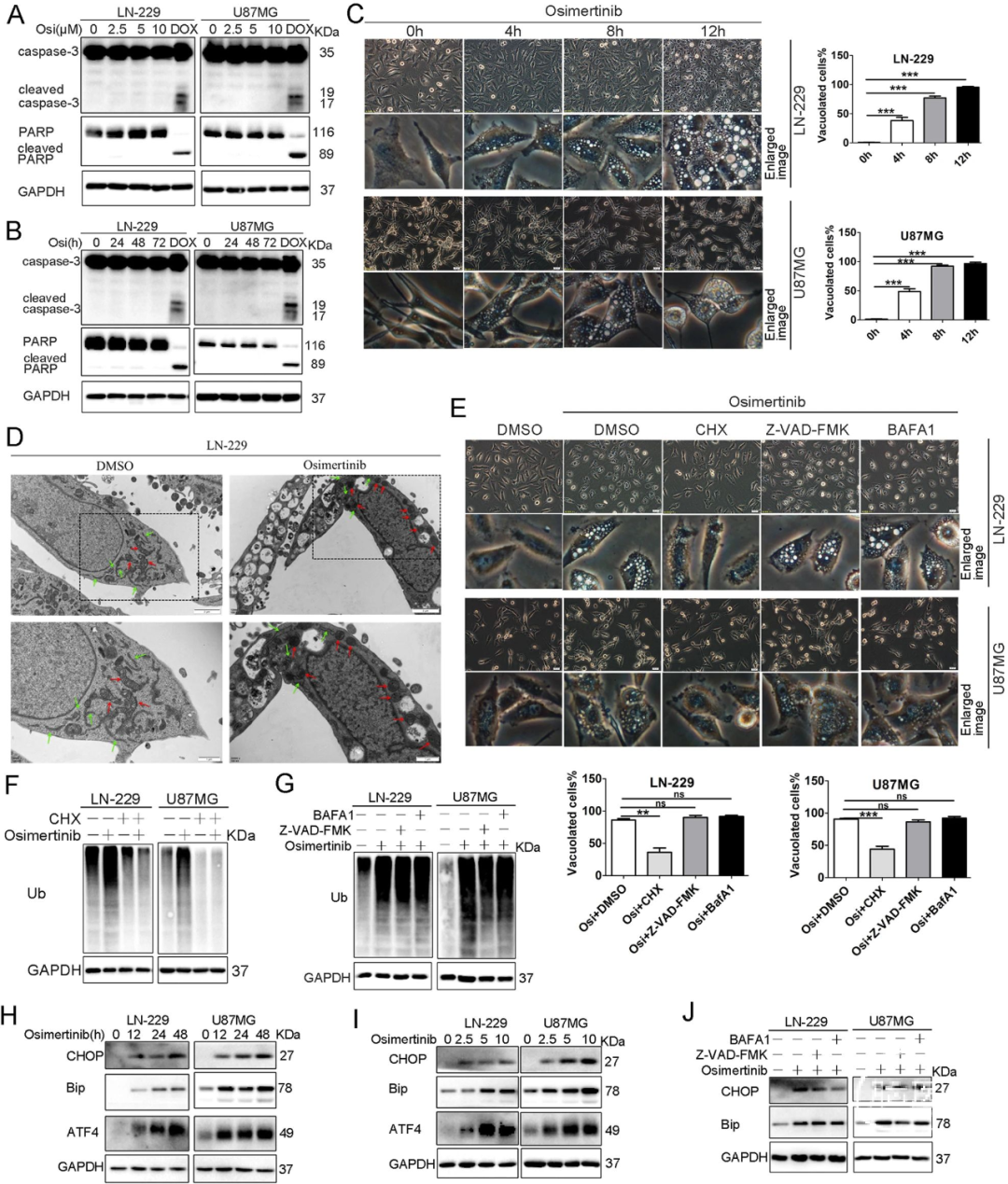
Osimertinib处理后,细胞中蛋白泛素化水平显著增加(图2F),CHX预处理可逆转Osimertinib引起的泛素化。进一步的研究表明,胞质空泡化主要来自内质网应激。错误折叠和未折叠蛋白的积累可能导致内质网应激的增加,Osimertinib上调了内质网应激的几个关键蛋白水平,包括CHOP、GRP78/BiP和ATF4(图2H)。此外,Osimertinib也上调了GBM细胞球中CHOP的蛋白水平,而无论是BafA1还是z-VAD-FMK都不能显著阻止Osimertinib诱导的细胞泛素化水平以及CHOP、BiP的上调(图2G、J)。因此,Osimertinib诱导的GBM细胞死亡具有副凋亡的形态学和生物学特征。
3.内质网应激参与Osimertinib诱导的细胞副凋亡
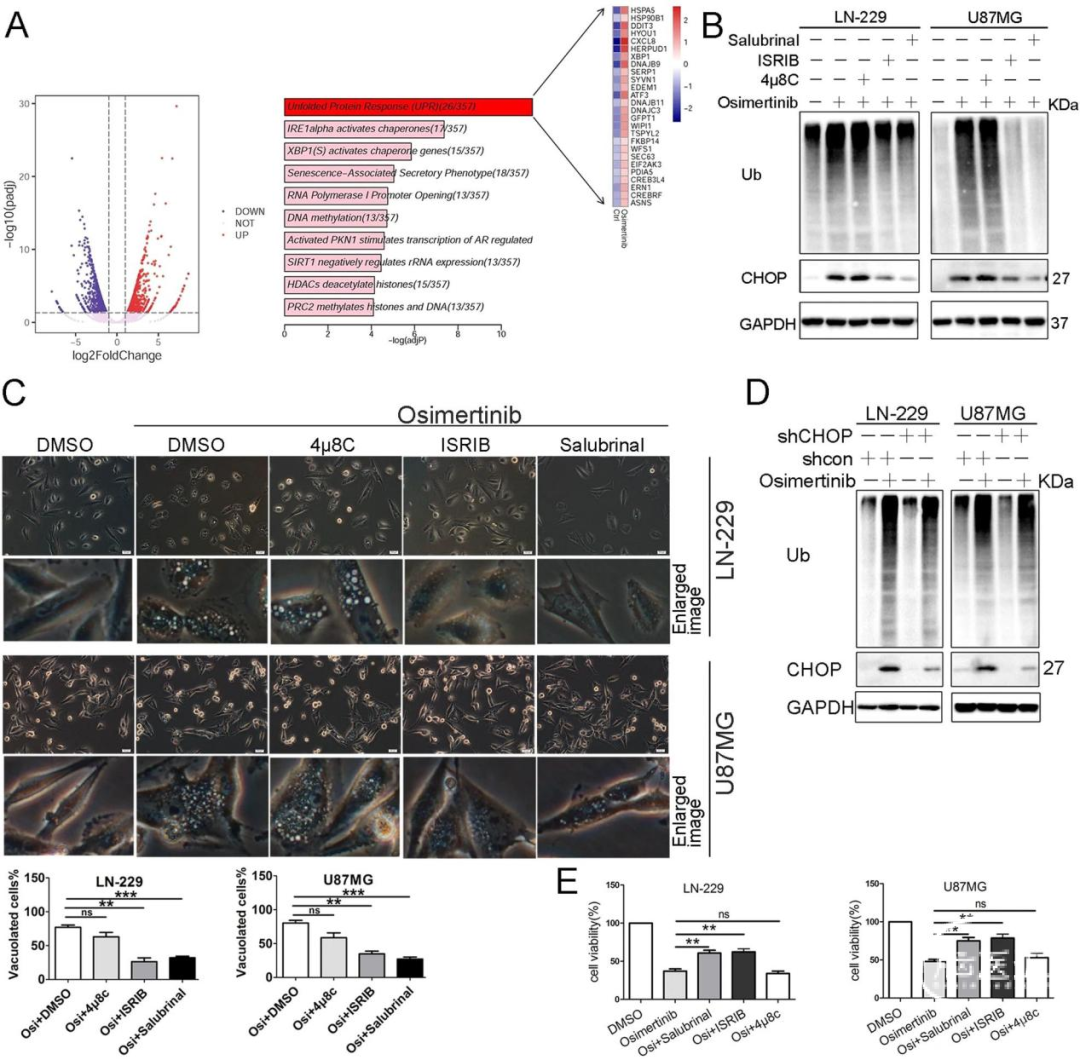
通过转录组测序比较Osimertinib和对照处理细胞的基因表达谱,结果显示上调的差异表达基因显著富集在未折叠蛋白反应(UPR)、IRE1α激活伴侣基因以及XBP1(s)激活伴侣基因相关的通路(图3A)。同时检测了内质网应激途径的两个主要参与者(PERK)-eIF2α和IRE1α的活性,用靶向PERK(ISRIB)或eIF2α(Salubrinal)的化合物进行预处理,显著减弱了Osimertinib诱导的CHOP表达、多泛素化蛋白的积累、细胞空泡化以及细胞死亡(图3B、C、E)。然而,用IRE1α抑制剂4μ8C进行预处理却未能逆转上述现象。此外,GBM细胞中敲低CHOP不会改变Osimertinib诱导的多泛素化蛋白水平的增加,表明Osimertinib阻断了CHOP上游的蛋白酶体活性,且在此过程中,内质网应激途径中的PERK-eIF2α轴发挥着关键作用(图3D)。
4.TRIP13赋予细胞对Osimertinib诱导的副凋亡的抵抗力
通过整合多基因组数据集,在EGFR-TKIs耐药的六种潜在调节因子(CDK6、GBP1、TRIP13、ERBB3、NTN4、MYH14)中确定了唯一的EGFR结合蛋白TRIP13(图4A)。此外,我们的前期研究发现TRIP13通过增强EGFR信号传导以促进GBM进展。因此,TRIP13可能为Osimertinib在GBM中的潜在的耐药基因。与对照组相比,过表达TRIP13的GBM细胞对Osimertinib表现出显著的耐药性,Osimertinib诱导的CHOP蛋白表达上调以及ERK1/2磷酸化水平下调都可以被过表达TRIP13所逆转,而敲低中现象相反(图4B-E)。形态学结果显示,过表达TRIP13减少了Osimertinib诱导的细胞质空泡的形成,而敲低TRIP13增加了细胞质中空泡的形成(图4F、G),以上结果表明TRIP13可能会干扰Osimertinib诱导的GBM细胞副凋亡,并赋予Osimertinib耐药性。
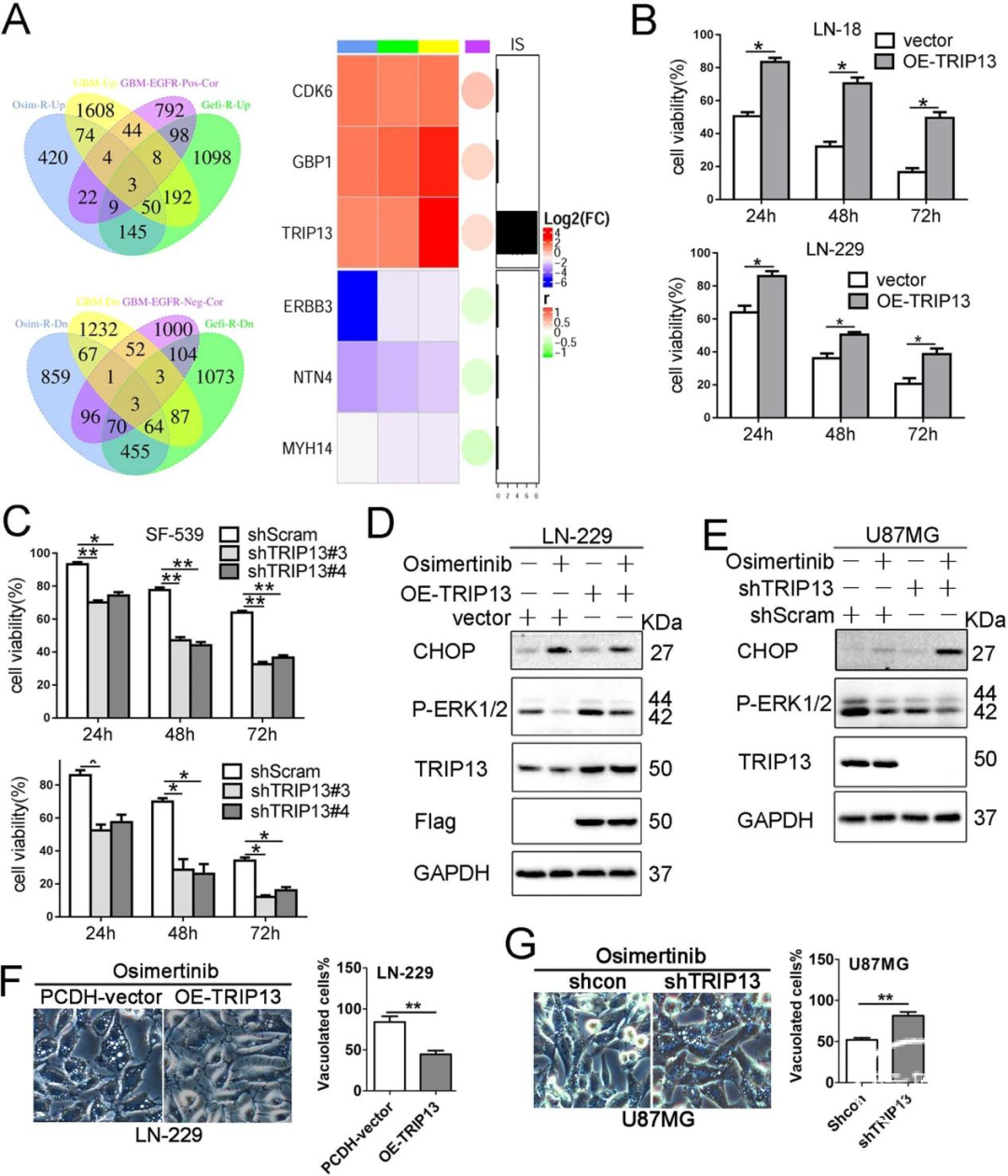
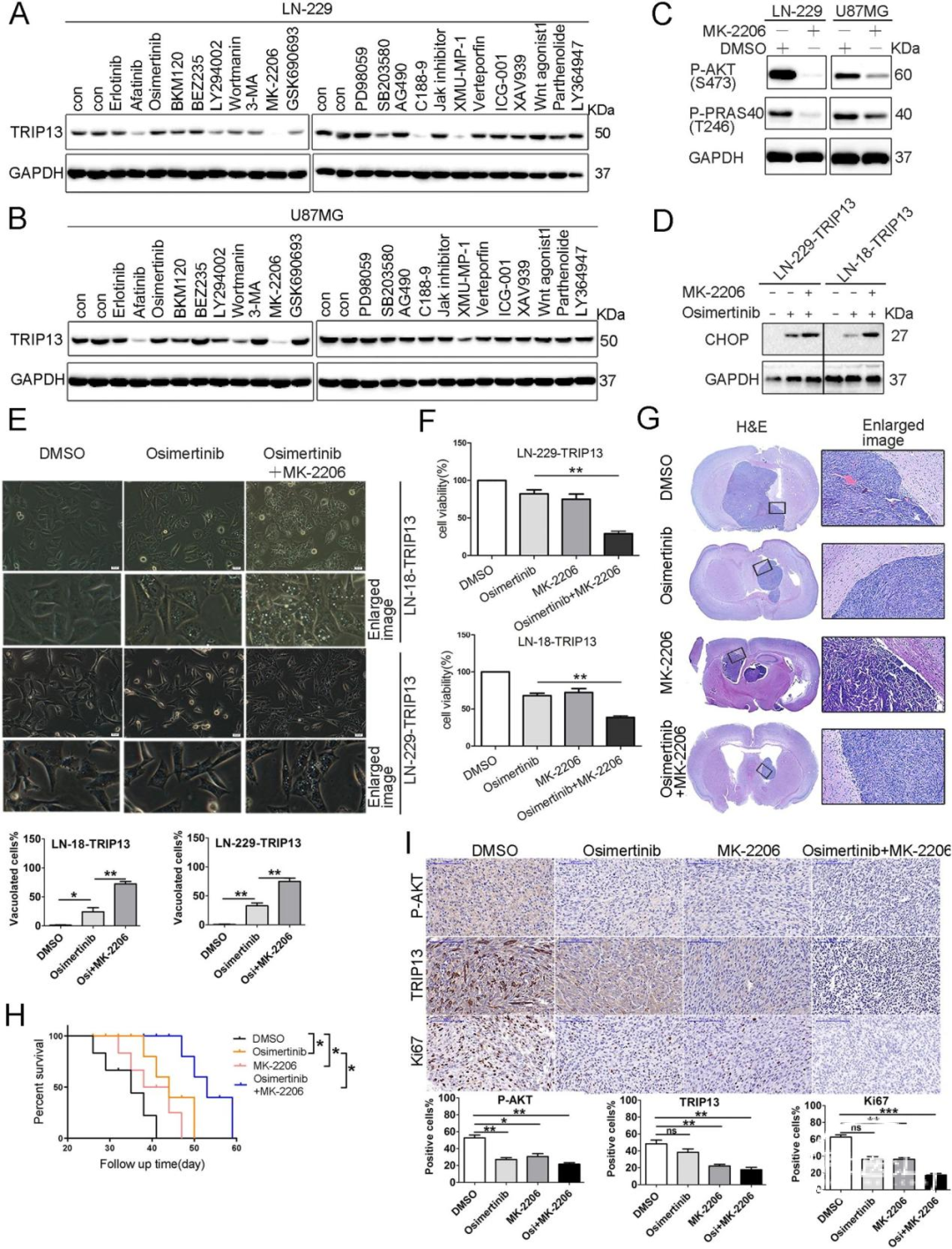
5.AKT抑制剂MK-2206能够有效克服TRIP13介导的GBM细胞对Osimertinib的内在耐药性
基于以上发现,我们在细胞水平上试图筛选出GBM中EGFR-TKI耐药的潜在调节因子,发现只有AKT抑制剂MK-2206能够显著降低GBM细胞中的TRIP13水平(图5A-C)。在Osimertinib处理的细胞中,MK-2206能够拮抗过表达TRIP13诱导的CHOP下调和细胞空泡化(图5D、E)。同时,MK-2206与Osimertinib能够协同抑制过表达TRIP13细胞的生长(图5F)。
在裸鼠原位成瘤模型中,与单独使用任一药物相比,MK-2206和Osimertinib联用能够更有效地抑制肿瘤生长,并显著延长生存期(图5G、H)。免疫组化结果显示,与单独用药组相比,MK-2206和Osimertinib联用的小鼠肿瘤切片中的Ki67和TRIP13染色显著减少(图5I)。
讨 论
参考文献
通讯作者简介
朴浩哲 教授
辽宁省肿瘤医院
辽宁省肿瘤医院党委书记,神经外科主任,二级教授
大连理工大学、中国医科大学、大连医科大学、辽宁中医药大学博士研究生导师
中国抗癌协会副理事长、中国抗癌协会第六届神经肿瘤专业委员会主任委员
担任辽宁省胶质瘤重点实验室主任,沈阳市神经胶质瘤临床医学研究中心主任
现主持国家科技部重点研发项目、国家自然联合基金重点支持项目、国家自然科学基金面上项目、辽宁省卫健委重大科研项目等多项课题,研究经费近1850余万元。在国内外医学期刊上发表科研论文63余篇,SCI收录43篇,合计影响因子(IF)近190分
研究成果获“中国抗癌协会科技奖”二等奖、辽宁省科学技术进步奖一等奖、辽宁省科学技术研究成果奖。现已培养博士、硕士研究生33人,其中博士后2人,博士14人
作为主编、副主编出版《神经系统恶性肿瘤》、《整合肿瘤学》、《常见恶性肿瘤诊疗规范》、《肿瘤细胞免疫治疗及基因检测实验技术图解》等专著
从事神经外科工作35年,始终致力于神经系统肿瘤的诊疗工作。朴浩哲教授在脑胶质瘤、脑转移癌及淋巴瘤等中枢神经系统恶性肿瘤诊疗方面具有丰富经验,于国内率先提出针对颅脑恶性肿瘤诊疗的多学科协作模式(MDT)的理念,使颅脑恶性肿瘤患者能够获得个体化综合诊疗方案。朴浩哲教授尤其擅长经鼻蝶入路神经内镜下颅底及鞍区病变切除术,开展了东北地区第一例神经内镜下垂体瘤手术。近年来开展了脑干肿瘤、三脑室、四脑室肿瘤及巨大颅底肿瘤等一系列高难度外科手术
声明:脑医汇旗下神外资讯、神介资讯、神内资讯、脑医咨询、AiBrain 所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。




