江苏省人民医院神经外科的尤永平教授等通过对胶质瘤标本和细胞系的转录组学数据的综合分析,发现放疗抵抗的胶质瘤中线粒体代谢途径被抑制,结果发表于2023年4月《Cancer Research》杂志。
——摘自文章章节
【Ref: Zhao M, et al. Cancer Res. 2023 Apr 4;83(7):1094-1110. doi: 10.1158/0008-5472.CAN-22-3083.】
研究背景
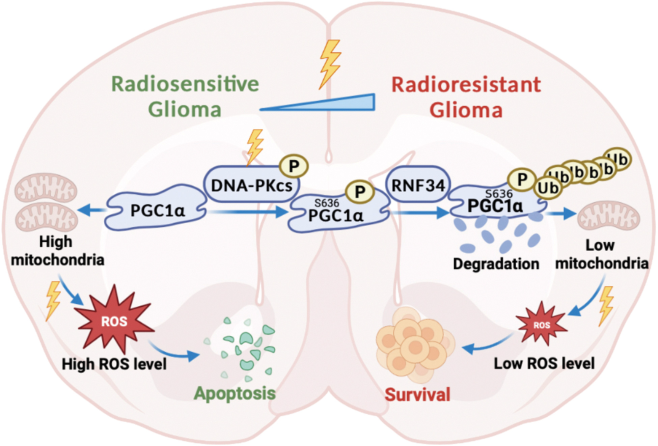
图1. 胶质瘤细胞通过促进PGC1α降解对放疗的抵抗,减少线粒体生物合成,可能是增强放射敏感性的潜在治疗策略。
研究结果
过氧化物酶体增殖物激活受体-γ共激活因子1α(peroxisome proliferator-activated receptor-gamma coactivator 1 alpha,PGC1α)是线粒体生物合成和代谢的关键调节因子,其表达降低与胶质瘤复发相关,并可预测胶质瘤患者的不良预后和对放疗的反应。研究发现,胶质瘤中线粒体含量低的细胞亚群PGC1α表达水平降低,并对放疗治疗的抵抗力增强,呈现明显的抵抗作用。研究者深入探究其中的分子机制,揭示PGC1α在第636位丝氨酸被DNA依赖性蛋白(DNA-PK)激酶磷酸化修饰,与放疗效果相关。S636的磷酸化通过促进PGC1α与E3连接酶RNF34的结合,促进PGC1α的泛素化降解作用。在体外和体内,抗磷酸化突变体PGC1αS636A或小分子PGC1α激活剂ZLN005的表达恢复PGC1α活性,通过重新激活线粒体相关活性氧的产生和诱导凋亡效应,可以明显提高放疗抵抗胶质瘤细胞的放疗敏感性,增加放疗后ROS的产生和细胞凋亡,从而为改善胶质瘤放疗敏感性提供参考依据。
研究结论
综上所述,该项研究明确胶质瘤细胞中自我保护机制,其中放疗诱导的PGC1α的降解和线粒体生物合成的抑制起核心作用。靶向激活PGC1α有助于改善胶质瘤患者对放疗的反应。

声明:脑医汇旗下神外资讯、神介资讯、神内资讯、脑医咨询、AiBrain 所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。






