
【大家说】栏目,关注脑疾病转化医学前沿,综合研究成果概述、研究作者自述和国内权威专家解读。本期栏目,我们特别邀请到来自复旦大学附属华山医院神经外科的吴劲松教授,为我们解读并分享最新发表在The NEW ENGLAND JOURNAL of MEDICINE上的有关新药Vorasidenib用于治疗IDH1或IDH2突变低级别胶质瘤的INDIGO研究成果。
一、研究概述
胶质瘤是最常见的成人原发性恶性脑肿瘤,世界卫生组织(WHO)根据其组织学和分子特征,将之分类成不同的亚型和分级。异柠檬酸脱氢酶1(IDH1)或异柠檬酸脱氢酶2(IDH2)基因突变存在于70%左右的成人型弥漫性低级别胶质瘤当中。健康的IDH基因可生成有助于分解营养物质并为细胞产生能量的酶,IDH基因突变会产生受损的酶,导致细胞生长失控并演变成癌症。鉴于胶质瘤具有独特的分子发病机制,WHO的最新分类将其归类为不同的疾病实体:具有IDH突变伴有1p/19q联合缺失的弥漫性胶质瘤被定义为少突胶质细胞瘤,而没有1p/19q联合缺失的IDH突变型弥漫性胶质瘤则被定义为星形细胞瘤。IDH突变型胶质瘤会慢慢浸润正常脑组织,最终变得更具侵袭性,并在新生血管的供血下加速生长。

目前,辅助放化疗已成为IDH突变型2/3级胶质瘤患者在术后治疗中的标准治疗方法,这些患者被认为是早期疾病进展的高危人群。虽然辅助放化疗可以长期缓解疾病,但并不能使患者得到治愈,反过来还与放疗诱导的神经认知功能障碍、化疗相关的DNA超突变以及其他毒性反应有关。
在众多新型药物治疗手段中,IDH抑制剂靶向治疗的研究进度尤其引人瞩目。2023年3月14日,一项比较IDH抑制剂Vorasidenib与安慰剂治疗残留或复发性IDH突变2级胶质瘤患者的全球、随机、双盲、3期临床试验——INDIGO研究,宣布达到了主要终点(无进展生存期,PFS)及关键次要终点(至下次干预的时间,TTNI)(推荐阅读:《吴劲松教授 | 见微知著:从INDIGO研究看IDH突变胶质瘤靶向治疗的新动态与新趋势》)。与安慰剂组的患者相比,Vorasidenib单药治疗组患者的PFS和TTNI均有统计学显著差异且有临床意义的改善;此外,Vorasidenib单药治疗的安全性良好。

时隔82天,2023年6月4日,INDIGO研究的具体研究数据在美国临床肿瘤学会(ASCO)年会上正式公布,并同步发表在《新英格兰医学杂志》(The NEW ENGLAND JOURNAL of MEDICINE)上。

Vorasidenib是一种针对IDH1和IDH2突变的双重抑制剂,可穿透血脑屏障。INDIGO是一项在全球范围内进行的随机、双盲、安慰剂对照3期临床试验,对仅接受手术治疗的残留或复发性IDH1/2突变型2级胶质瘤患者进行Vorasidenib疗效分析。
研究纳入了来自10个国家77个中心共计331例年龄在12岁及以上的患者,所有患者都经组织学证实有残留或复发性2级少突胶质细胞瘤或星形细胞瘤(2016年WHO分类标准),并且经中心确诊存在IDH1和IDH2突变。其他关键的入组标准包括KPS评分(Karnofsky performance-status score)≥80分(范围为0-100分,分数越低,功能障碍严重程度越高)、至少接受过1次手术(最近一次手术发生在随机分组之前的1-5年之间)、未接受过其他抗胶质瘤治疗、未因胶质瘤征象或症状使用糖皮质激素、可接受观察等待策略(watch-and-wait)的患者、肝肾功能合格等。患者还需在中心接受过一系列相关评估,至少包括在造影前后通过T1WI扫描确认存在可测量的无强化疾病(定义为有≥1个靶区病变,在最长的两个维度上测得≥1cm×≥1cm),并且在入组前的盲审中通过T2W FLAIR扫描再次确认;并且,出现的任何强化必须是微小、无结节且不可测量的。其他主要的排除标准包括出现任何被研究人员评估为“高风险”的特征(包括未经控制的癫痫发作、脑干受累以及肿瘤引起的临床相关功能或神经认知障碍等),以及根据Fridericia公式校正后的心率Q-T间期(QTcF)≥0.45s。
参与试验的168例患者被随机分配接受Vorasidenib治疗,其余163例则接受安慰剂治疗,连续接受28天周期。结果显示,在接受Vorasidenib治疗的患者中,平均疾病无进展时间(PFS)为27.7个月,明显长于接受安慰剂治疗的11.1个月。此外,在接受Vorasidenib治疗的患者中,85.6%的患者直到18个月后才进行下一次治疗干预(包括再手术或辅助放化疗),83.4%的患者甚至坚持了24个月以上。

总体而言,在接受Vorasidenib治疗的患者中,只有28%的患者病情进展,而在接受安慰剂治疗的患者中,病情进展的比例达到54%。截至2022年9月,也就是研究开始30个月后,Vorasidenib治疗组中有72%的患者仍在服用这种药物,他们的疾病没有进展。
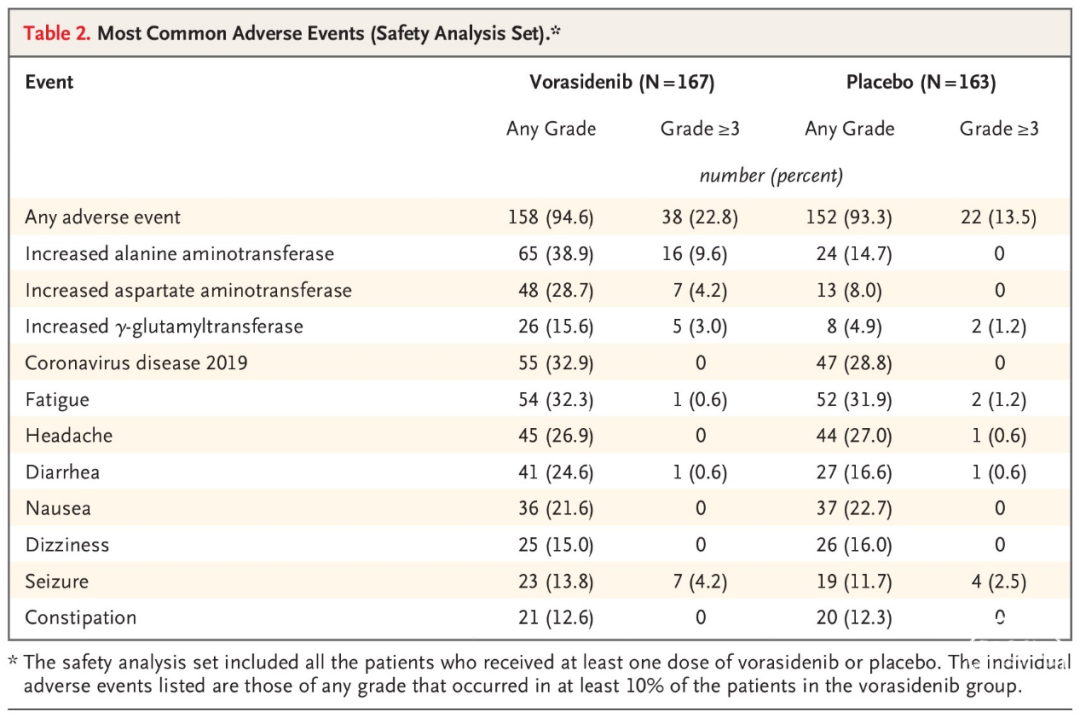
在安全性方面,Vorasidenib的评价结果显示患者的耐受性良好,并与I期试验结果相一致。在Vorasidenib治疗组 vs. 安慰剂组中,最常见的3级及以上的不良事件是谷丙转氨酶升高(9.6% vs. 0)、谷草转氨酶升高(4.2% vs. 0)和癫痫发作(4.2% vs. 2.5%)。
值得一提的是,Vorasidenib已于2023年3月获得了美国食品药品监督管理局(FDA)的快速通道认证。此外,有研究人员目前正在进行Vorasidenib与帕博丽珠单抗(Keytruda®)联合治疗2/3级胶质瘤患者的I期试验,并正考虑对Vorasidenib联合其他药物的使用做进一步探索。
+ + + + + + + + + + +
文章来源
Mellinghoff IK, van den Bent MJ, Blumenthal DT, Touat M, Peters KB, Clarke J, Mendez J, Yust-Katz S, Welsh L, Mason WP, Ducray F, Umemura Y, Nabors B, Holdhoff M, Hottinger AF, Arakawa Y, Sepulveda JM, Wick W, Soffietti R, Perry JR, Giglio P, de la Fuente M, Maher EA, Schoenfeld S, Zhao D, Pandya SS, Steelman L, Hassan I, Wen PY, Cloughesy TF. Vorasidenib in IDH1- or IDH2-Mutant Low-Grade Glioma. N Engl J Med. 2023 Jun 4. doi: 10.1056/NEJMoa2304194. Epub ahead of print. PMID: 37272516.
二、作者自述
最后作者、加州大学洛杉矶分校大卫•格芬医学院的神经肿瘤学教授Timothy Cloughesy博士介绍说,“如果有一种治疗方法能让患者在放化疗之间有更长的间隔时间,可能会产生重大影响。这是第一个在目标人群中显示出明确疗效的靶向治疗方法,对(IDH突变2级胶质瘤)这种疾病来说是开创了先例。”
第一作者暨通讯作者、纪念斯隆凯特琳癌症中心的神经肿瘤学主席Ingo Mellinghoff博士补充道,“2级胶质瘤是一种进展性的恶性脑瘤,患者预后很差;其当前的治疗范式与短期和长期毒性反应有关,且在20多年里没有任何进展。该疾病多影响40岁左右的患者群体,这些年轻患者都正处于职业和个人生活的巅峰状态,肩负着许多责任。胶质瘤的标准治疗方案是联合放化疗,但这种治疗会严重损害年轻成年人的大脑。因此,许多胶质瘤患者会选择观察等待,直到迫不得已才开始接受治疗。”
“本项试验中,Vorasidenib的治疗效果非常好,该研究的安全监察委员会也因此呼吁提前结束随访,以便安慰剂治疗组患者可以转而使用该药物获得治疗,”Mellinghoff博士接着说,“对于经分子检测确定为IDH突变型低级别胶质瘤的患者来说,采用诸如Vorasidenib这样的靶向疗法可能会为其带来具有变革意义的益处。”
Servier公司是Vorasidenib的研制单位,其临床开发副总裁Susan Pandya博士表示,“INDIGO研究的极佳结果有力地证明了在癌症生物学早期靶向IDH突变的影响,在此当中,单药疗法对复发或残留性IDH突变型2级胶质瘤患者具有深远意义。IDH突变是定义IDH突变型弥漫性胶质瘤的基础,而这些关键数据以及Vorasidenib穿越血脑屏障的能力,为此类恶性肿瘤患者提供了改善治疗前景的机会。我们期待能够积极配合FDA,对Vorasidenib作为IDH突变型弥漫性胶质瘤的潜在疗法进行相关审查。”
三、吴劲松教授的权威解读
2023年初,本项研究的共同最后作者、美国布莱根妇女医院神经内科和Dana-Farber癌症研究所神经肿瘤学中心的Patrick Y. Wen教授带领团队在Neuro-Oncology杂志发表了《IDH突变胶质瘤SNO专家共识:诊断、治疗和未来方向》,该共识被作为2023新年首刊的封面文章,预示IDH突变胶质瘤可能将迎来一场诊疗手段变革。

WHO CNS5分类中“成人型弥漫性胶质瘤,IDH突变,WHO 2级”患者多见于中青年患者。由于疾病进展缓慢,中位生存期近十年,部分患者存活期可达二十年以上,因此也可被称为“慢性肿瘤性疾病”(chronic tumoral disease)。此类患者多为社会和家庭中坚人群,如何策略个体化序贯疗法,是一个值得深入探究的临床问题。既往临床研究已经明确的答案是:(1)基于影像学边界的手术全切除可以显著延长患者生存时间(overall survival, OS);(2)术后辅助放疗可以显著延缓肿瘤复发时间(progression of survival, PFS);(3)术后辅助PCV化疗可以显著延长患者的OS;(4)术后辅助TMZ化疗的治疗反应时间(duration of response, DOR)为44.5~52.4个月,可以显著延缓放疗介入时间点。
但是,新的临床问题随之出现:(1)出于脑功能保护的考虑,只有40.3%~78.8%的WHO 2级弥漫性胶质瘤可以获得影像学全切除;(2)放疗造成患者认知功能损害,降低健康相关生活质量(health-related quality of life);(3)我们并不确认放疗是否延长患者OS,术后辅助放疗的最佳切入时间点也不清楚;(4)传统的PCV(甲基苄肼+洛莫司汀+长春新碱)联合化疗方案的副反应重,患者耐受性差;(5)如果以耐受性较好的替莫唑胺(Temozolomide, TMZ)代替PCV联合化疗方案,30% IDH突变型星形细胞瘤,化疗后存在超突变(hypermutation)的风险,导致肿瘤迅速恶性进展(malignant progression)。
因此,针对“成人型弥漫性胶质瘤,IDH突变,WHO 2级”患者,如何策略个体化序贯疗法?这依旧是一个没有最优答案的重要临床问题。
针对上述的临床困境,今年3月我们迎来了INDIGO研究阳性结果的好消息,以及最近的研究数据正式发表。INDIGO研究是近20年来胶质瘤药物治疗领域、化疗药物之外少有的获得成功的大型3期临床研究,其中期分析的积极结果具有里程碑意义,为IDH突变胶质瘤精准治疗注入了新动力。
INDIGO研究采用口服、靶向、耐受性良好的疗法,延迟手术后辅助放、化疗的介入。INDIGO研究的结果显示,对于选定的IDH突变型低级别胶质瘤患者,我们有可能推迟放化疗介入达数年,并因此延缓这些长期生存患者因放疗产生的潜在神经毒性反应,避免化疗诱导的肿瘤恶性变。
目前全球已有多个IDH抑制剂开展了治疗IDH突变胶质瘤的临床研究并初步显示出积极疗效与良好安全性,包括艾伏尼布(IDH1抑制剂)、Enasidenib(IDH2抑制剂)、Olutasidenib及DS-1001等。IDH抑制剂在IDH突变胶质瘤中临床应用的确定性将进一步提升。

值得一提的是,INDIGO研究纳入的是“可见病灶非强化”的“经组织学证实有残留或复发性2级少突胶质细胞瘤或星形细胞瘤(2016年WHO分类标准)”。参照WHO CNS5标准,即“成人型弥漫性胶质瘤,IDH突变,WHO 2级”。因此,一个新的临床问题引申而出,对于已出现明显强化灶的IDH突变型高级别胶质瘤患者,即“成人型弥漫性胶质瘤,IDH突变,WHO 3~4级”患者,是否同样可以从Vorasidenib治疗中获益?
在未来,IDH抑制剂有望进入临床应用阶段,更多的临床问题将有待探索,包括:最佳介入时机、对OS的远期生存预后评估、联合疗法(例如与免疫检查点抑制剂的联合方案)的有效性、长期毒副反应、经济效益比等。相信随着临床研究的深入开展,IDH突变型胶质瘤的治疗将迎来新的篇章。
参考文献:
专家介绍
吴劲松 教授
复旦大学附属华山医院
医学博士,主任医师
复旦大学教授,复旦大学博士研究生导师
复旦大学附属华山医院神经外科副主任(科研)
复旦大学神经外科研究所副所长
复旦大学附属华山医院生物样本库主任
国家神经疾病医学中心脑胶质瘤专业组长
复旦大学附属华山医院伦理委员会委员
上海市抗癌协会常务理事,兼神经肿瘤专业委员会主任委员
中国抗癌协会神经肿瘤专业委员会副主任委员,兼脑胶质瘤学组组长
中国神经科学学会脑机接口与交互分会副主任委员
中国研究型医院学会精准神经外科委员会副主任委员
上海市神经科学学会理事
ASNO科学委员会委员
WFNS教育委员会委员
上海市浦东新区政协委员
声明:脑医汇旗下神外资讯、神介资讯、神内资讯、脑医咨询、AiBrain 所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。






