本文为 天津医科大学总医院放射科、天津市功能影像学重点实验室 于春水 教授作为通讯作者 2017 年发表于 Schizophrenia Bulletin 的工作,题为“Altered Coupling Between Resting-State Cerebral Blood Flow and Functional Connectivity in Schizophrenia”。DOI:0.1093/schbul/sbx051。
Background: 研究报道了精神分裂症患者静息态脑血流量(CBF)和功能连接的变化。然而,它们在精神分裂症中的耦合变化在很大程度上仍然未知。Methods: 89 例精神分裂症患者和 90 例性别和年龄匹配的健康对照者接受静息态功能 MRI 计算功能连接强度(FCS),动脉自旋标记成像计算 CBF。比较两组之间整个灰质的 CBF-FCS 耦合和每个体素的 CBF/FCS比率(每单位连接强度的血液供应量)。Results: 与健康对照组相比,精神分裂症患者的全灰质 CBF-FCS 耦联降低。在精神分裂症患者中,CBF/FCS 比率降低主要发生在认知和情绪相关的大脑脑区,包括背外侧前额叶皮层、岛叶、海马和丘脑,而CBF/FCS 比值增加主要发生在感觉运动脑区,包括壳核、感觉运动、中扣带和视觉皮层。Conclusion: 脑内神经血管解耦联可能是精神分裂症的神经病理学机制之一。Key words: arterial spin labeling; cerebral blood flow; functional magnetic resonance imaging; functional connectivity; resting-state; schizophreniaIntroduction
精神分裂症是一种病因不明的毁灭性疾病,在普通人群中的患病率约为 1%。近几十年来,神经成像技术为连接障碍假说提供了证据,该假说将精神分裂症与大脑结构和功能连接中断联系起来。使用功能 MRI(fMRI),静息态功能连接(rsFC)测量大脑各脑区血氧水平依赖性(BOLD)信号低频波动的时间相关性,已被提出反映大脑的内在功能组织。基于种子的 rsFC分析,独立成分分析(ICA)和基于图论的分析已被用于量化精神分裂症患者 rsFC 的变化,并揭示了广泛的功性连接障碍,包括特定区域(如前额叶皮层)、回路(如皮层-皮层下回路)、子网络(如默认模式网络和凸显网络)以及整个大脑网络的连接障碍。
基于种子的 rsFC 方法因其固有的简单、灵敏和易于解释而被广泛使用。然而,该方法需要先验地定义种子区域;因此,如果疾病的潜在病理学未知,分析可能会很困难。ICA 方法部分克服了这个问题,该方法自动将整个大脑的信号分离为统计上独立的成分,从而产生空间上不重叠的功能子网络。然而,ICA 可能会遇到关于最合适数量的成分的不确定性、用于区分噪声和信号的有争议的标准以及复杂算法引入的解释复杂性。全脑功能连接强度(FCS)分析是一种新开发的数据驱动方法,用于测试大脑中每个体素与所有其他体素的连接。FCS 在图论中也被称为加权网络的“度中心性”,具有高 FCS 的大脑区域被认为是与大脑其他部分高度连接的功能中枢。FCS 方法已被应用于研究精神分裂症的连接变化,并显示前额叶的 FCS 增加或减少,感觉运动和视觉皮层的 FCS 减少(supplementary table S1)。
脑血流量(CBF)是指在给定时间内输送到给定质量脑组织的血液量。静息态 CBF 与大脑代谢密切相关,包括葡萄糖利用、耗氧量和有氧糖酵解。正电子发射断层扫描(PET)和单光子发射计算机断层扫描(SPECT)已被广泛用于识别精神分裂症的 CBF 缺陷。使用这些技术,许多先前的研究表明,精神分裂症患者在多个大脑区域表现出静息态 CBF 增加或减少,尤其是前额叶皮层的 CBF 减少。然而,这两种技术都是侵入性的,采集时间长,空间分辨率低。相比之下,动脉旋转标记(ASL)MRI 是一种非侵入性技术,可以使用内源性对比快速量化 CBF。这项技术已被用于探索精神分裂症患者的 CBF 变化,并证明纹状体的 CBF 增加,前额叶和前扣带皮质的 CBF减少,丘脑和颞叶皮层的 CBF 增加或减少(supplementary table S2)。
人类大脑消耗了近 20% 的能量,这比其相对于身体的相对大小预期的消耗高出 10 倍。大部分能量被消耗来支持自发的大脑活动。基于神经-血管耦合假说,连接更强的大脑区域往往具有更高的自发神经元活动,代谢需求更大,导致灌注增加。正如预期的那样,在健康受试者中,更高程度的功能连接与葡萄糖代谢(能量消耗)的增加有关。此外,几项研究已经确定了 CBF 与大脑连接之间的关联。例如,网络分析发现 CBF 与解剖和功能连接之间存在相关性;基于种子的连接性分析揭示了几个大脑区域的 CBF 和 rsFC 之间的相关性;ICA 显示 CBF 与几个静息脑网络的连接之间存在相关性。
在先前的一项研究中,跨体素 CBF-FCS 相关性和 CBF/FCS 比值用于表征大脑中血管反应和神经元活动之间的耦合。对于个体而言,跨体素 CBF-FCS 相关反映了 CBF 和 FCS 在整个灰质水平上的空间分布一致性。CBF/FCS 比值测量每单位连接强度的血液供应量,反映特定体素或脑区的神经-血管耦合。跨体素 CBF-FCS 相关性和 CBF/FCS 比值可用于识别精神分裂症患者神经-血管耦合的变化,而这些变化无法通过单独研究 CBF 和FCS 来检测。
由于精神分裂症中 CBF 和 FCS 变化的大脑区域在空间上不一致(supplementary table S1 and S2),我们假设精神分裂症患者与健康受试者相比,CBF-FCS 耦合减少。由于精神分裂症患者大脑区域在 CBF 和 FCS 变化中表现出不同的影响大小和方向,我们假设精神分裂症病人在CBF/FCS 比率中会表现出区域特异性变化。在精神分裂症中,CBF 增加和 FCS 减少的脑区将显示 CBF/FCS 比值增加;相反,CBF 降低和 FCS 增加的大脑区域将显示出CBF/FCS 比值降低。为了验证这些假设,我们收集了89 名精神分裂症患者和 90 名性别和年龄匹配的健康对照的静息态 BOLD 和 ASL 数据。比较两组之间以全脑灰质方式的 CBF-FCS 耦合和以体素方式的 CBF/FCS 比值。
本研究共招募了 179 名右撇子,其中包括 89 名精神分裂症患者和 90 名健康对照。获得了所有参与者的书面知情同意书,该研究得到了天津医科大学总医院伦理委员会的批准。每个患者都符合基于 DSM-IV 轴 I 障碍(SCID,患者版)结构化临床访谈的精神分裂症标准。阳性和阴性症状量表(PANSS)用于评估精神病症状的严重程度。使用 SCID 的非患者版对所有健康对照进行筛查,以确认没有精神疾病。所有参与者的排除标准如下:MRI 禁忌症、存在会影响大脑功能的系统性疾病或中枢神经系统紊疾病、头部创伤史、过去 3 个月内药物滥用史或终身药物依赖史。健康对照的其他排除标准包括有精神病史和有精神病发作史的一级亲属。这些参与者的详细人口统计和临床数据如 Table 1 所示。
在从对照图像减去标签图像之后,使用单隔室模型计算 ASL 差异图像。对3 幅 ASL 差异图像进行平均(注:作者采用的假连续脉冲 ASL 序列,采集了 3 组标记和对照(参考)图像),以结合质子密度加权参考图像计算 CBF 图。使用 SPM8 软件将 CBF 图像标准化到蒙特利尔神经研究所(MNI)空间,使用以下步骤:(1)将健康对照的个体空间 ASL 差异图非线性标准化到 MNI 空间,然后平均到生成研究特定的标准 ASL 模板;(2)将每个受试者的个体空间 ASL 差异图像非线性地配准到研究特定的标准 ASL 模板;以及(3)使用从先前步骤导出的变形参数将每个受试者的 CBF 图像写入 MNI 空间,并将其重采样为 3 mm 立方体素。然后,从每个共同配准的 CBF 图去除非脑组织,并用 6mm×6mm×6mm 的半峰全宽(FWHM)高斯核进行空间平滑。Whole Gray Matter Functional Connectivity Analysis我们计算了灰质掩模内所有体素对的 BOLD 时间序列之间的 Pearson 相关系数(Nvoxels=34911),并获得了每个参与者的整个灰质功能连接矩阵。由于全脑信号的去除可能引起有争议的负相关性,我们将我们的分析限制在 0.2 阈值以上的正相关性,以消除可能由背景噪声引起的弱相关性。之所以选择该相关性阈值,是因为较低的阈值可能包括假阳性连接,而较高的阈值可能排除一些有意义的连接。如果功能连接小于阈值,则该条目为零。对于给定的体素 x0,FCS 被计算为 x0 和所有其他体素(包括 0 的条目)之间的功能连接的平均值。FCS图用 6mm×6mm×6mm FWHM 高斯核进行空间平滑。Whole Gray Matter CBF-FCS Coupling Analysis对于每个被试,通过减去灰质掩码内全局值的平均值并除以 SD,将 CBF 和 FCS 图进一步归一化为 z 分数,以便在受试者之间对其进行平均和比较。为了定量评估 CBF 和 FCS 之间的耦合,对每个被试进行了跨体素的相关性分析。由于包括配准和空间平滑在内的空间预处理,相邻体素将高度依赖于彼此,因此跨体素相关性分析中的有效自由度 dfeff 将远小于灰质掩模内的体素数量。因此,使用以下方程估计跨体素相关性的 dfeff:其中 v 是体素的体积(3×3×3 mm³),N 是分析中使用的体素的数量(N=34 911)。FWHMx×FWHMy×FWHMz 是使用 REST 软件估计的 CBF 和 FCS 图的平均平滑度(14.0×15.5×20.1mm³)。本研究中跨体素相关性的dfeff 为 214。因此,每个参与者都有一个 CBF-FCS 相关系数值,反映了CBF 和 FCS 在整个灰质水平上空间分布的一致性。然后使用 2 样本 t 检验来比较精神分裂症患者和健康对照之间 CBF-FCS 相关性系数的差异。为了评估每单位连接强度的血液供应量,我们计算了每个体素的 CBF/FCS 比值(两者都是没有 z 变换的原始值)。为了增加正态性,将每个被试的每个体素的 CBF/FCS 比率转换为 z 分数。以年龄和性别为协变量,采用 2 样本 t 检验,以体素方式检验 CBF/FCS 比值的组间差异。使用体素水平错误发现率(FDR)方法校正多重比较,校正阈值为P<0.05。对于每个被试,提取具有显著组间差异的每个团块的平均 CBF/FCS 比值,并用于基于感兴趣区域(ROI)的分析。进行非参数 Spearman 秩相关分析,以检验每个显著 ROI 的 CBF/FCS 比值与精神病症状严重程度(PANSS 的阳性、阴性和一般评分)之间的相关性。使用 Bonferroni 方法对多重比较进行校正(P<0.05/45=0.0011)。Voxel-Wise Comparisons in CBF and FCS为了更好地了解是什么导致了 CBF/FCS 比值的差异,我们在控制年龄和性别的同时,以体素水平方式比较了两组之间的 CBF 和 FCS 差异。也使用体素水平 FDR 方法校正了多重比较(P<0.05)。将 CBF、FCS 和 CBF/FCS 比值的组间差异图投影到叠加图上,以显示 CBF/FCS 比值差异的驱动因素。Effects of Antipsychotic Medications先前的研究揭示了抗精神病药物对静息状态 CBF 的影响。为了检验抗精神病药对 CBF 相关分析的可能影响,我们对精神分裂症患者的抗精神病药物剂量氯丙嗪当量与成像测量值(包括整个灰质的整体 CBF,以及各测量值之间存在显著组间差异体素水平 CBF 和 CBF/FCS 比值)之间进行了相关性分析(P<0.05,未校正)。在 FCS 计算中,我们使用 0.2 的相关系数阈值来消除可能由噪声信号引起的弱相关性。为了进一步评估主要结果的可重复性,我们使用两个其他相关阈值(即0.1和0.3)重新计算了 FC S图,然后重复所有分析。鉴于精神分裂症患者表现出灰质萎缩,我们重复了体素水平 CBF/FCS 比值比较,每个体素的灰质体积(GMV)作为不感兴趣的额外协变量,以排除灰质萎缩的影响。先前的研究报道了健康受试者的年龄和性别对静息状态 CBF 和 FCS 的显著影响,因此我们分别在对照组和患者中测试了年龄(相关性分析)和性别(女性和男性之间的比较)对整个灰质的整体 CBF 和 FCS 的影响。我们还重复了 CBF、FCS 和 CBF/FCS 比值的体素比较,在不控制控制年龄和性别的影响的情况下。
Spatial Distribution of the FCS, CBF and CBF/FCS Ratio
精神分裂症患者和健康对照组的 FCS、CBF 和 CBF/FCS 比值的空间分布相似(Fig.1)。CBF 较高的大脑区域主要位于后扣带皮层/楔前叶、内侧前额叶皮层、前扣带皮层、构成默认模式网络(DMN)的外侧颞叶和顶叶皮层,以及岛叶、外侧前额叶皮质、感觉运动和视觉皮层。FCS 较高的大脑区域主要分布在 DMN、外侧前额叶皮层和视觉皮层。内侧前额叶皮层、前扣带皮层、感觉运动皮层和丘脑的 CBF/FCS 比值较高。
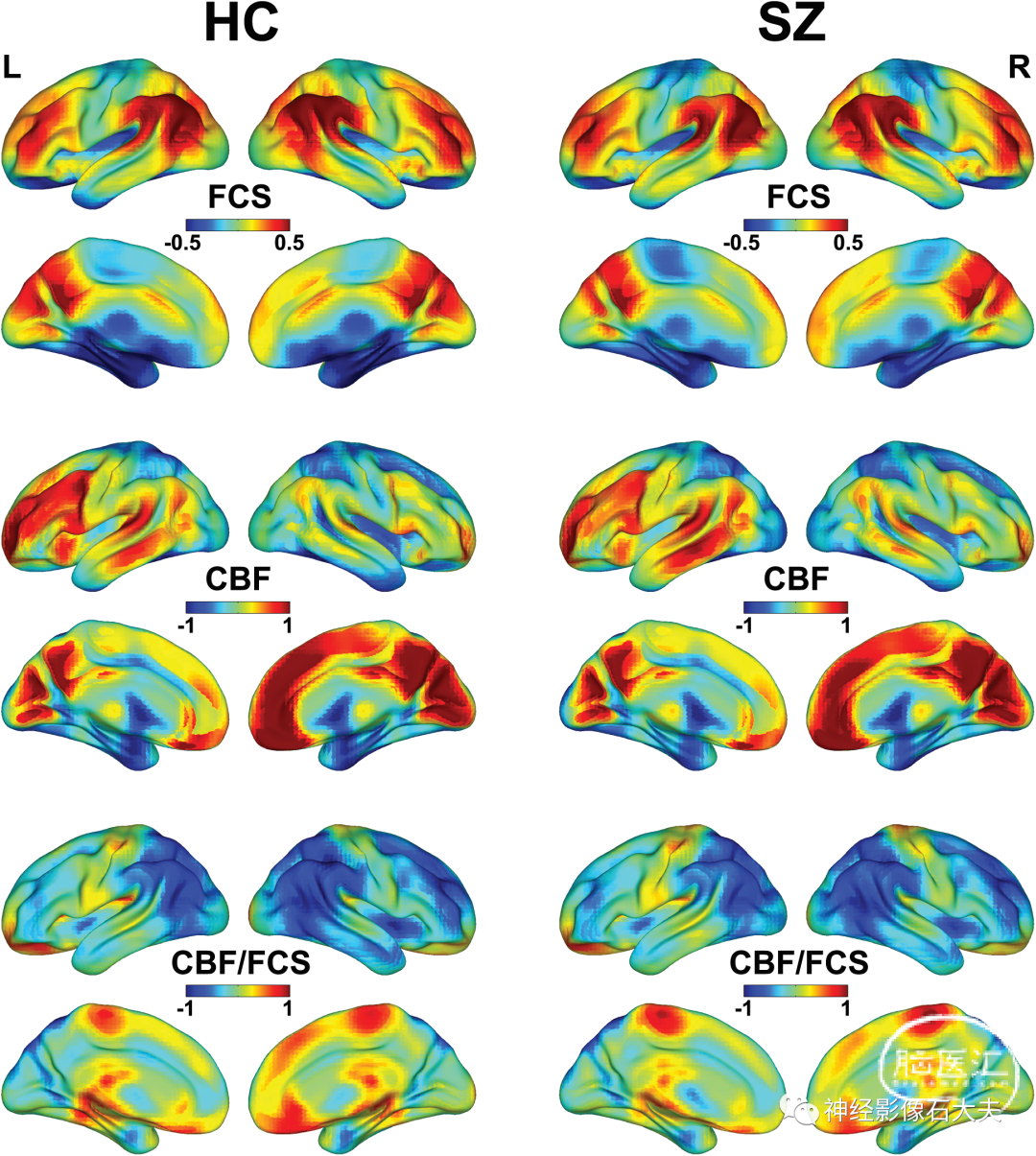
Fig. 1. Spatial distribution maps of FCS, CBF, and CBF/FCS ratio. The FCS, CBF, and CBF/FCS ratio maps are normalized to z-scores and averaged across subjects within groups. The FCS is calculated using a connectivity threshold of 0.2. CBF, cerebral blood flow; FCS, functional connectivity strength; HC, healthy controls; L, left; R, right; SZ, schizophrenia patients.
Whole Gray Matter CBF-FCS Coupling Changes in Schizophrenia与健康对照组相比,精神分裂症患者在整个灰质中表现出整体 CBF(患者:51.5±9.3 ml/100g/min;对照组:55.5±8.8 ml/100g/min,2 样本 t 检验,t=−3.0,P=0.003)和整体 FCS(患者:0.0378±0.0058;对照组:0.0393±0.0042;2 样本 t 试验,t=-2.1,P=0.038)降低。尽管在精神分裂症组和对照组中,CBF 与 FCS 显著相关(Fig.2A),但与健康对照组相比,精神分裂症患者的 CBF-FCS 耦合显著降低(t=-2.5,P=0.015,降低 15%)(Fig.2B)。
 Fig. 2. Whole gray matter level CBF-FCS coupling changes in schizophrenia. Scatter plots (A) of the spatial correlations across voxels between CBF and FCS in a healthy subject (blue) and a schizophrenia patient (red), respectively. The mean whole gray matter level CBF-FCS coupling in schizophrenia patients and healthy controls (B). Although CBF is significantly correlated with FCS in both schizophrenia and control groups, schizophrenia patients have a significantly reduced CBF-FCS coupling relative to healthy controls. Significant difference was found between patients and controls on CBF-FCS correlation coefficients across voxels. Error bars represent the SE. CBF, cerebral blood flow; FCS, functional connectivity strength; HC, healthy controls; SZ, schizophrenia patients.
Fig. 2. Whole gray matter level CBF-FCS coupling changes in schizophrenia. Scatter plots (A) of the spatial correlations across voxels between CBF and FCS in a healthy subject (blue) and a schizophrenia patient (red), respectively. The mean whole gray matter level CBF-FCS coupling in schizophrenia patients and healthy controls (B). Although CBF is significantly correlated with FCS in both schizophrenia and control groups, schizophrenia patients have a significantly reduced CBF-FCS coupling relative to healthy controls. Significant difference was found between patients and controls on CBF-FCS correlation coefficients across voxels. Error bars represent the SE. CBF, cerebral blood flow; FCS, functional connectivity strength; HC, healthy controls; SZ, schizophrenia patients.
CBF-FCS Ratio Changes in Schizophrenia与健康对照组相比,精神分裂症患者双侧海马和丘脑、左额中回、岛叶和辅助运动区的 CBF/FCS 比值降低,双侧感觉运动皮层、壳核和中扣带皮层、左角回和梭状回和右舌回的 CBF/FC 比值增加(P<.05,FDR 校正)(figure 3 and supplementary table S3)。
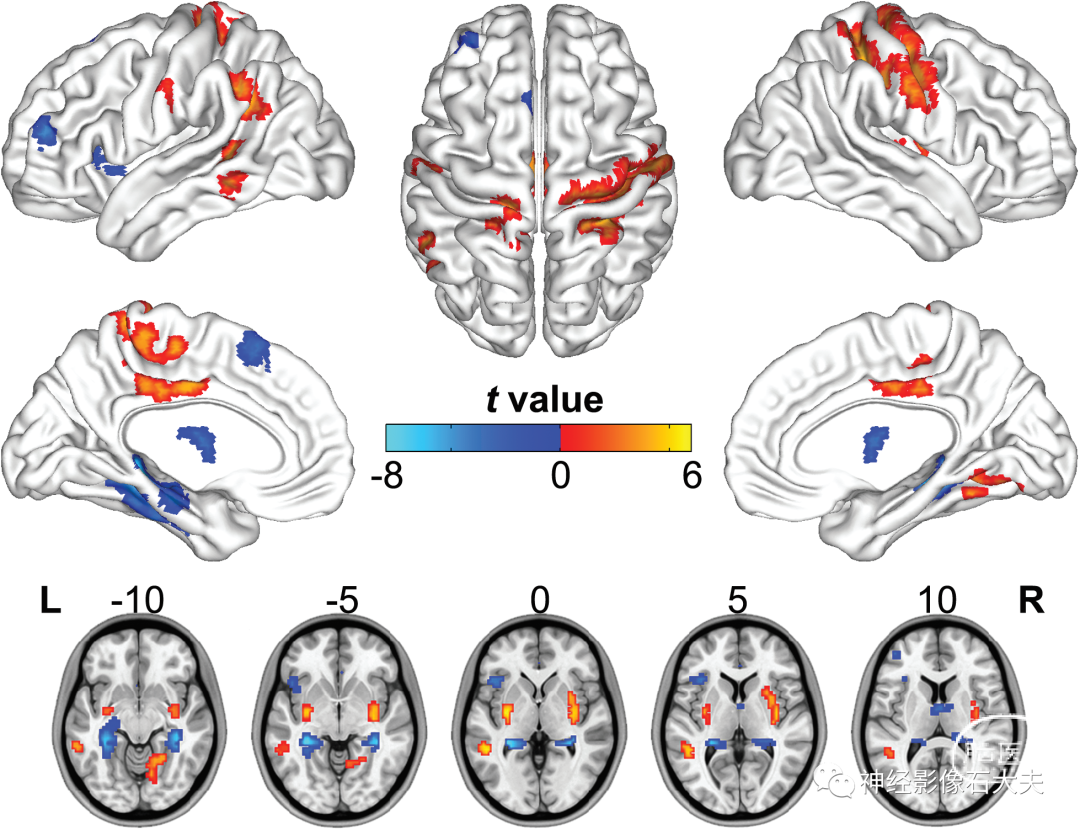
Fig. 3. Group differences in CBF/FCS ratio between schizophrenia patients and healthy controls (P < .05, FDR corrected) while controlling for the effects of age and sex. The warm and cold colors denote significantly increased and decreased CBF/FCS ratio in the schizophrenia patients, respectively. CBF, cerebral blood flow; FCS, functional connectivity strength; L, left; R, right.
Correlation Between CBF/FCS Ratio and Psychotic Symptoms每个显著 ROI 的 CBF/FCS 比率与精神病症状严重程度(PANSS 的阳性、阴性和一般评分)之间的相关性如 supplementary table S4 所示。在精神分裂症患者中,我们仅发现左侧海马的 CBF/FCS 比率与 PANSS 阴性评分之间存在显著相关性的趋势(Spearmanρ=−0.231,P=0.029)。然而,在Bonferroni 校正后,这种显著性并未保持(P<.05/45=.0011)。CBF and FCS Changes in Schizophrenia与健康对照组相比,精神分裂症患者双侧前额叶皮层、前扣带皮层、枕叶皮层、岛叶和辅助运动区的 CBF 降低,双侧颞叶皮层、感觉运动皮层、中扣带皮层和纹状体的 CBF 增加(P<.05,FDR 校正)(supplementary figures S1 and S2)。精神分裂症患者双侧枕叶皮层、左顶叶下小叶和右感觉运动皮层的 FCS 降低,双侧颞叶皮层、海马体、纹状体和丘脑以及左前额叶皮层的FCS增加(P<0.05,FDR 校正)(supplementary figures S3 and S4)。Figure S1. Group differences in CBF between
schizophrenia patients and healthy controls (P < 0.05, FDR corrected). The warm and cold colors denote
significantly increased and decreased CBF in the schizophrenia patients,
respectively. Abbreviations: CBF, cerebral blood flow; L, left; R, right.Figure S3. Group differences
in FCS between schizophrenia patients and healthy controls (P < 0.05, FDR corrected). The warm
and cold colors denote increased and decreased FCS in the schizophrenia
patients, respectively. Abbreviations: FCS, functional connectivity strength; L,
left; R, right.
Associations Between the CBF/FCS Ratio and CBF and FCS Changes in Patients精神分裂症患者的CBF/FCS 比值(红色)与 CBF(蓝色)和 FCS(绿色)变化之间的关系如 supplementary figure S5 所示。红色区域是那些具有CBF/FCS 比值改变但没有 CBF 和 FCS 变化的区域,包括左中央旁小叶、感觉运动皮层和上缘回以及右舌回的部分区域。CBF/FCS 比值与 CBF 变化的重叠(粉红色)主要位于双侧中扣带皮层和壳核、左额中回、岛叶、辅助运动区和梭状回。CBF/FCS 比值和 FCS 变化之间的重叠(黄色)主要分布在双侧海马、前丘脑和右侧感觉运动皮层。双侧海马体和右侧感觉运动皮层(白色)的部分在所有 3 项测量中都表现出显著变化。
Figure S5. The overlaps of
CBF/FCS ratio (red), CBF (blue) and FCS (green) changes in schizophrenia. The
red color represents brain regions with CBF/FCS ratio but without CBF and FCS
changes. The pink color indicates the overlap between CBF/FCS ratio and CBF
changes. The yellow color denotes the overlap between CBF/FCS ratio and FCS
changes. The white color suggests significant changes in all the three
measures. Abbreviations: L, left; R, right.
Effects of Antipsychotic Medications on CBF-Related Measures我们没有发现抗精神病药物剂量与整个灰质的整体 CBF 之间存在显著相关性(Spearmanρ=−0.205,P=0.053)。抗精神病药物剂量与双侧纹状体和颞叶皮层、左侧中央旁小叶和中扣带皮层的 CBF 呈正相关,与双侧枕叶和外侧前额叶皮层以及左侧顶叶皮层的CBF呈负相关(P<0.05,未校正)(supplementary figure S6)。然而,在对多次比较进行 FDR 校正后,这些相关性并不显著。此外,我们没有发现抗精神病药物剂量与 CBF/FCS 比值之间有任何显著相关性(P<.05,未校正)。Figure S6. Brain regions of
significant correlation between antipsychotic dosages and CBF in schizophrenia
patients (P < 0.05, uncorrected).
Warm color denotes positive correlation and cold color represents negative
correlation.
在 FCS 计算中,我们使用了r=0.2的相关阈值。为了测试相关阈值对我们结果的潜在影响,我们使用0.1和0.3的相关阈值重复了我们的分析。当r=0.1(supplementary figure S7)和r=0.3(supplementary figure S8)时,FCS和 CBF/FCS 比率的空间分布与 r=0.2 时非常相似。与健康对照组相比,精神分裂症患者在r=0.1(t=−2.2,P=.029,减少 14%)(supplementary figure S9)和r=0.3(t=-2.6,P=.010,减少 16%)(supplementary figure S10)时,全灰质 CBF-FCS 偶联仍显著减少。此外,当 r=0.1(supplementary figure S11)和r=0.3(supplementary figure S12)时,在 CBF/FCS 比值方面显示出显著组间差异的大脑区域在很大程度上得到了保留。最后,在r=0.1(supplementary figure S13)和r=0.3(supplementary figure S14)时具有显著 FCS 差异的大脑区域与r=0.2时的大脑区域一致。由于 GMV 萎缩可能影响精神分裂症患者 CBF/FCS 比值的变化,我们在控制GMV 的同时,也重复了 CBF/FCS 比值的组间比较。我们发现,GMV 校正后CBF/FCS 比值改变的大脑区域的空间分布与未经 GMV 校正的大脑区域相似(supplementary figure S15),这表明大多数 CBF/FCS 比值改变与精神分裂症患者的 GMV 萎缩无关。我们发现,在健康对照组中,年龄和性别都显著影响整个灰质的整体 CBF,即年龄与平均 CBF 呈负相关(r=−0.227,P=0.032),女性的平均 CBF 大于男性(t=2.807,P=0.006)。我们没有发现健康对照组的年龄或性别对平均FCS 有任何显著影响(r=0.098,P=0.358;t=−0.298,P=0.767),或年龄或性别对精神分裂症患者的整个灰质平均 CBF(r=−0.093,P=0.385;t=1.537,P=0.128)和 FCS(r=−0.051,P=0.638;t=0.956,P=0.342)的任何显著影响。此外,我们发现,在控制和不控制年龄和性别影响的情况下,在 CBF、FCS 和 CBF/FCS 比值方面表现出显著的组间差异的大脑区域的空间分布相似(supplementary figures S16–18)。Discussion
据我们所知,这是首次结合 BOLD 和 ASL 技术研究精神分裂症患者 CBF-FCS 偶联变化的研究。与健康对照组相比,精神分裂症患者的全灰质 CBF-FCS 偶联减少。此外,精神分裂症患者在认知和情绪相关脑区的 CBF/FCS 比值降低,在感觉运动区的 CBF/FCS 比值增加。这些发现可能从神经-血管耦合的角度提高我们对精神分裂症神经机制的理解。
我们发现 CBF 在精神分裂症中的变化,这可能通过以下机制来解释。首先,CBF 变化可能反映了精神分裂症中神经元活动的改变,因为基于神经-血管耦合假设,CBF 的变化由神经元活动控制。例如,神经元活动增强的大脑区域具有更高的代谢需求,导致灌注增加。其次,CBF 的变化可能是精神分裂症中神经递质(如多巴胺和 GABA)和非特异性物质(如一氧化氮)变化的结果,因为这些化学物质也在调节血管反应中发挥作用。最后,CBF 的改变可能与精神分裂症神经炎症相关的微血管改变有关,导致 CBF 的调节不精确。
FCS 从全局网络的角度描绘了每个体素的全脑功能连接概况,并反映了每个体素在全脑网络中信息传输中的作用。精神分裂症中 FCS 的降低可能是结构损伤的结果,即灰质减少和白质改变。结构完整性的丧失可能会损害脑区间功能同步的精确协调。此外,精神分裂症患者在某些神经系统中也表现出功能连接增加,与本研究结果一致。尽管抗精神病药物治疗、头部运动和全局信号校正可能是促成因素,但 Fornito 和Bullmore 为精神分裂症患者的功能连接增加提供了其他可能的机制:(1)对结构损伤的代偿反应;(2) 神经活动的未分化状态,其特征是正常分离的神经活动的分解;以及(3)神经发育驱动的网络中枢解剖连接减少的矛盾但拓扑上可预测的影响。
与之前的研究一致,我们发现健康受试者的 CBF 和 FCS 之间存在显著的跨体素相关性,代表了正常的神经血管耦合。神经血管耦合取决于神经血管单元(即神经元、神经胶质细胞和血管成分)的完整性。在该单元中,星形胶质细胞在桥接神经元活动和血管反应中发挥着重要作用。尽管我们也发现精神分裂症患者的 CBF 和 FCS 之间存在跨体素相关性,但它低于健康受试者,可能表明精神分裂症患者的神经-血管解耦联。这种神经-血管解耦联的一种可能解释是精神分裂症中星形胶质细胞异常,这可能会减少神经元活动与血管反应之间的联系。精神分裂症患者的 GABA 中间神经元异常也可能有助于神经-血管解耦联,因为正常 GABA 中间神经在调节神经-血管耦合中发挥重要作用。此外,影响血管成分(CBF)而不影响神经元活动(FCS)的其他因素(如一氧化氮和神经炎症)也可能导致神经-血管解偶联。
在体素水平分析中,在患者和对照组之间,几个在 CBF 和 FCS 方面没有显著组间差异的大脑区域显示,在 CBF/FCS 比值存在显著组间差异。进一步的基于 ROI 的分析表明,与健康对照组相比,精神分裂症患者的这些区域表现出相对较高的 CBF 和较低的 FCS(supplementary figure S19)。在这种情况下,CBF/FCS 比值可能会扩大组间差异,以识别使用相同统计阈值的 CBF 或 FCS 分析无法发现的精神分裂症异常区域。相反,在 CBF、FCS 或两者均具有显著组间差异的几个脑区,两组之间的 CBF/FCS 比值没有显示出显著差异。总之,这些发现表明,CBF、FCS 和 CBF/FCS 比值可以提供互补信息,应共同用于揭示精神分裂症的病理变化。
精神分裂症患者的背外侧前额叶皮层、岛叶、海马和丘脑的 CBF/FCS 比值降低,这些脑区主要参与认知控制和情绪调节。其中,背外侧前前额叶皮层和岛叶的 CBF 降低,FCS 正常,表明这些区域的 CBF/FCS 比值的下降主要是由 CBF 的下降驱动的。这种异常可能至少部分解释了精神分裂症中这些区域的认知和行为缺陷。相反,海马和丘脑表现出正常的 CBF 和 FCS 的增加,表明这些区域的 CBF/FCS 比值降低主要是由 FCS 增加驱动的;这一发现与先前报道精神分裂症患者海马和丘脑功能连接增加的研究一致。丘脑是支持认知功能的多个功能回路的关键节点,包括注意力和信息处理的记忆和执行功能。丘脑中 CBF/FCS 比值的降低可能会影响丘脑皮层回路,这可能与精神分裂症的认知障碍有关。
精神分裂症患者的壳核、中扣带皮层、梭状回、感觉运动皮层和舌回的CBF/FCS 比值增加,这些脑区主要与感觉处理和运动调节有关。精神分裂症患者这些大脑脑区的损伤已被广泛报道。许多研究报告了精神分裂症的感觉和运动症状,包括躯体感觉、听觉和视觉功能障碍以及异常的非自主运动、帕金森综合征、神经软征、紧张症、 心理运动迟缓。壳核、中扣带皮层和梭状回的 CBF/FCS 比值的增加主要是由 CBF 的增加驱动的。因为我们还在这些区域发现了抗精神病药物对 CBF 的影响,CBF 的增加可能是由药物诱导的多巴胺转换(抗精神病药-拮抗 D2 受体-多巴胺转换增加-CBF增加)增加引起的。此外,感觉运动皮层 CBF/FCS 比值的增加主要是由 FCS 的减少驱动的,这在精神分裂症中一直有报道。
我们发现,海马中的 CBF/FCS 比值与阴性症状的严重程度之间存在趋势性负相关,这表明CBF/FCS比值越低(主要由 FCS 增加驱动),精神分裂症的阴性症状越严重。先前的研究表明,认知障碍与阴性症状的相关性比与阳性症状的相关性更强。结构成像研究表明,精神分裂症患者的海马体积减少,并与认知能力和阴性症状相关。在最近的一项功能成像研究中,精神分裂症患者的静息状态海马高激活与认知呈负相关,与阴性症状呈正相关。鉴于这些发现,可以推测海马的高激活降低了该区域根据任务需求被招募的能力,这会导致认知能力受损和阴性症状。另一种可能性是,CBF/FCS 比值的降低反映了神经血管解耦联,这会损害海马体的功能,可能会导致阴性症状。
在本研究中有几个局限性需要提及。首先,这些精神分裂症患者中的大多数正在接受抗精神病药物治疗,这可能会影响我们的解释。未来需要未用药、首发精神分裂症患者的研究消除药物影响并证实这项研究的结果。其次,CBF 是血管反应的间接测量,FCS 是神经元活动的间接测量。这使我们无法就这些测量的生物学意义得出确切结论。第三,包括零条目的优点是反映了每个体素的平均 FCS;包括零条目的缺点是在 FCS 计算中包括弱连接或无意义连接。排除零条目的优点是从 FCS 计算中排除弱连接或无意义连接;排除零条目的缺点是夸大了强连连接对 FCS 的贡献。选择主要取决于研究的重点。在这项研究中,我们旨在使用每个体素的平均 FCS 作为神经元活动的衡量标准。因此,包含零条目更为合适。最后,尽管我们发现 CBF/FCS 比值与 PANSS 评分之间存在显著相关性的趋势,但更敏感和特异的神经心理学量表可能会提供关于这些 CBF/FCS 异常的功能意义的进一步信息。
总之,我们通过结合 BOLD 和 ASL 技术揭示了精神分裂症患者静息态 CBF 和功能连接之间的耦合被破坏。具体而言,我们发现,在涉及认知控制和情感调节的高级大脑系统中,CBF/FCS 比值降低,而在涉及感觉处理和运动调节的低级大脑系统中 CBF/FCS 比值增加。这些发现表明,大脑中的神经-血管解耦联可能是精神分裂症病理生理学的潜在神经机制。









![]()





