本文来源于公众号:神经影像石大夫
本文为南京大学医学院附属金陵医院医学影像中心主任 卢光明 教授作为通讯作者 2011 年发表于 Brain 的工作,题为“Altered functional-structural coupling of large-scale brain networks in idiopathic generalized epilepsy ”(Google 学术被引次数:525)。DOI:10.1093/brain/awr223。
人脑是一个功能和结构领域的大规模集成网络。图论分析为分析这种复杂的网络提供了一个新的框架。尽管先前的神经影像学研究已经发现以强直-阵挛发作为特征的特发性全身性癫痫患者的几个特定脑网络异常,但对全脑功能和结构连接网络的变化知之甚少。对于功能和结构连接,网络密切相关,并具有共同的小世界拓扑特征。我们预测特发性全身性癫痫患者将表现出功能和结构网络之间的解耦联。在本研究中,招募了26名以强直-阵挛发作为特征的特发性全身性癫痫患者和26名年龄和性别匹配的健康对照。静息态功能磁共振成像信号相关性和扩散张量图像纤维束追踪技术用于生成功能和结构连接网络。图论分析表明,患者在功能和结构连接网络中都失去了最佳拓扑组织。此外,与对照组相比,患者在包括内侧额叶皮层、壳核、丘脑和杏仁核在内的几个皮层和皮层下区域的节点拓扑特征显著增加,这支持了在网络分析中在癫痫发病机制中发挥重要作用的区域可能显示异常中枢特性的假设。与对照组相比,患者在默认模式网络区域(如后扣带回和颞下回)的节点拓扑特征进一步降低。最重要的是,患者的功能和结构连接网络之间的耦合程度降低,并与患者癫痫病程呈负相关。我们的研究结果表明,功能和结构连接的解耦联可能反映了特发性全身性癫痫长期损害的进展,并可能被用作检测癫痫中细微大脑异常的潜在生物标志物。总的来说,我们的研究结果首次表明,特发性全身性癫痫反映在大尺度大脑功能和结构网络中的拓扑组织被破坏,从而为更好地理解全身强直-阵挛发作的病理生理机制提供了有价值的信息。
Keywords: idiopathic generalized epilepsy; generalized tonic–clonic seizures; structural connectivity network; functional connectivity network; coupling
人脑是一个大尺度的复杂网络,通过特定的连接模式同时分离和整合。复杂大脑网络的定量分析主要基于图论,通常通过结构或功能域进行。结构连接网络可以基于通过弥散纤维束追踪技术量化的白质纤维束或形态学测量的相关性来构建;它们可以深入了解结构建筑学特点。另一方面,功能连接网络可以通过来自不同大脑区域的血氧水平依赖功能性MRI信号之间的时间相关性或相干性来计算;这些功能连接网络为大脑动力学提供了一个网络视角。研究表明人类网络的组织是为了优化效率,因为小世界拓扑结构允许同时进行全局和局部并行信息处理。事实上,功能连接网络和结构连接网络显示了都显示了小世界架构。
功能和结构连接网络的分析为评估健康和患病大脑的复杂网络特性提供了新的途径。事实上,研究显示了在几种精神和神经疾病中大脑网络拓扑结构的改变,如阿尔茨海默病、精神分裂症、中风、多发性硬化症和颞叶癫痫。此外,功能和结构连接网络的同时评估允许研究它们的关系。研究表明结构连接网络可能是功能连接网络的物理基础。几项研究表明,结构连接对整个人脑网络的功能交互作用具有高度的预测性,并对其施加了限制。此外,先前的研究记录了全脑大尺度网络中这两种连接模式之间的巨大空间相似性。最后,发现功能和结构连接网络的耦合随着年龄的增长而增加,并在疾病特异性状态下被破坏。因此,来自功能和结构连接网络的功能和结构信息的整合可能比任何单一模式更灵敏地检测细微的大脑病理生理异常。
特发性全身性癫痫(IGE)是一组以广泛的全身性棘波或多棘波为特征的癫痫疾病。全身强直-阵挛发作(GTCS)是IGE最常见的表型,是最需要医疗护理的类型。IGE-GTCS最危险的癫痫症状,包括肌强直、全身肌肉剧烈收缩和完全意识丧失,可能导致受伤或死亡。常规MRI上无法检测到的局灶性解剖性脑损伤、发作期头皮EEG上的高肌电污染以及有限的手术病例使对IGE-GTCS的理解具有挑战性。
尽管IGE-GTCS的传统观点是整个大脑可能同质参与,来自几种成像模态的证据特别表明,这种形式的癫痫通过特定的丘脑-皮层和皮层皮层网络影响广泛的大脑。最近的网络分析表明,几种分布式脑网络参与了IGE的发生和症状。作为病理生理学的全局特征,广泛的脑区和广泛的网络参与了IGE-GTCS,基于图论的复杂脑网络研究可能比局部连接研究更有价值,以了解IGE-GTCS的机制。在本研究中,我们检验了三个具体的假设:
除IGE-CTCS外,癫痫患者的网络分析表明,大脑网络拓扑结构发生了变化。癫痫电生理学研究通常显示,在超同步癫痫活动后,网络组织更加规则。另一方面,发作间期研究提供了不太一致的结果。电生理学和功能性MRI研究表明,拓扑结构更为随机化,但在最近的皮层厚度相关网络分析中也观察到了更为规则的拓扑结构。在本工作中,我们将研究IGE-GTCS中发作间期功能和结构连接网络的拓扑变化。由于这些变化可能与癫痫病程导致的长期损伤有关,我们还将测试IGE-GTCS中的这种渐进效应。 先前在功能和结构域中的发现表明,IGE-GTCS与几种特定皮层下-皮层网络的局部异常相关。在本研究中,我们希望采用节点拓扑的测量方法,如局部连接强度和效率,来表征单个区域在整个大脑网络功能整合中的作用。我们检验了癫痫网络中与癫痫活动的产生、传播和调节相关的重要区域将在网络分析中显示异常中枢特性(hub property)的假设。 假设结构连接限制功能连接,而功能连接通过可塑性机制反过来影响结构连接。对于功能连接和结构连接之间的相互联系,功能连接和结构性连接网络密切相关,并具有共同的小世界拓扑特征。在本研究中,我们预测IGE-GTCS的病理状态可能会改变这种网络耦合,因为这种类型的癫痫具有广泛的功能连接异常。功能-结构连接耦合可能提供一种生物标志物,比任何单一模式更灵敏地检测细微的大脑异常,并可能为理解IGE-GTCS的病理生理机制提供新的见解。
患者组由通过南京大学医学院金陵医院招募的26名IGE-GTCS患者组成[年龄(mean±SD):24.12 ± 6.85岁;首次发作年龄:18.15 ± 5.80岁;病程:6.92 ± 5.80年]组成。这些患者均符合以下纳入标准:(i)存在典型的GTCS临床症状,包括四肢抽搐、意识丧失、无部分癫痫发作;(ii)在他们的头皮EEG中存在普遍的棘波或多棘波放电;(iii)常规结构MRI检查中无局灶性异常;和(iv)没有明显的病因史。根据国际抗癫痫联盟(ILAE)的分类,所有患者诊断为仅伴GTCS的IGE。15名患者接受了抗癫痫药物治疗,包括丙戊酸钠、苯妥英、卡马西平、拉莫三嗪和托吡酯(Supplementary Table 1)。
从金陵医院的工作人员中招募26名年龄和性别匹配的健康对照组(年龄:22.62 ± 2.06岁,均为右撇子)。健康对照组接受了访谈,以确认没有神经系统疾病或精神疾病史,大脑MRI图像也没有明显异常。两组患者年龄、性别差异无统计学意义(P > 0.05)。
All patients during interictal state and healthy controls underwent structural, functional and diffusion tensor imaging scanning using a Siemens Trio 3T scanner at Jinling Hospital, Nanjing, China. Foam padding was used to minimize head motion for all subjects. Functional images were acquired using a single-shot, gradient-recalled echo planar imaging sequence (repetition time = 2000 ms, echo time = 30 ms and flip angle = 90°). Thirty transverse slices (field of view = 240×240 mm², in-plane matrix = 64×64, slice thickness = 4 mm, interslice gap = 0.4 mm, voxel size = 3.75×3.75×4 mm³), aligned along the anterior commissure–posterior commissure line were acquired. For each subject, a total of 250 volumes were acquired, resulting in a total scan time of 500 s. Subjects were instructed simply to rest with their eyes closed, not to think of anything in particular, and not to fall asleep. The diffusion tensor images covering the whole brain were obtained using spin echo-based echo planar imaging sequence, including 30 volumes with diffusion gradients applied along 30 non-collinear directions (b = 1000 s/mm²) and one volume without diffusion weighting (b = 0 s/mm²). Each volume consisted of 45 contiguous axial slices (repetition time = 6100 ms, echo time = 93 ms, flip angle = 90°, field of view = 240×240 mm², matrix size = 256×256, voxel size = 0.94×0.94×3 mm³). To improve the signal to noise ratio, the entire sequence was repeated four times. Subsequently, high-resolution T1-weighted anatomical images were acquired in the sagittal orientation using a magnetization-prepared rapid gradient-echo sequence (repetition time = 2300 ms, echo time = 2.98 ms, flip angle = 9°, field of view = 256×256 mm², matrix size = 256×256 and zero filled and interpolated to 512×512, slice thickness = 1 mm, without interslice gap, voxel size = 0.5×0.5×1 mm³ and 176 slices) on each subject.
为了确定大脑功能和结构连接网络的节点,我们使用自动解剖标记(AAL)算法将整个大脑皮层以低分辨率划分为90个非小脑解剖感兴趣区(每个半球45个感兴趣区域)。这种分割方案被称为 AAL-90。节点的解剖标签列表如补 Supplementary Table 2 所示。考虑到节点尺度的范围和模板划分的差异可能导致功能连接网络和结构连接网络的图论参数的显著变化,根据先前研究建议,我们还使用了具有1024个感兴趣区的高分辨率分割网络来研究大脑功能和结构连接网络。为此,我们将3D灰质体积划分为n个连续区域,同时尽可能均匀地约束节点的大小。具体而言,为了生成高分辨率的节点规模,组成低分辨率自然AAL模板的每个节点被细分为一组微节点。每个微节点被限制在由其父低分辨率AAL节点封装的体积内,并且每个微节点都被确保是连续的。反过来,将自然AAL分割分割成两个半球上大小大致相同(1.2cmm³)的1024个感兴趣微区(每个半球512个感兴趣区)。这种分割方案被称为 AAL-1024((Supplementary Fig. 1)。这两种类型的划分方案被并行应用于以下网络分析,以交叉验证我们的结果。

Figure S1. Low-resolution AAL-90 parcellation

对于每个受试者,使用非扩散加权B0图像(b = 0 s/mm²)对扩散加权图像进行几何校正和场图来校正涡电流失真。使用仿射变换将扩散加权图像B0图像共同配准,以最小化轻微的头部运动。使用 Diffusion Toolkit,通过线性最小二乘拟合方法对每个体素的扩散张量模型进行估计。使用 Diffusion Toolkit中嵌入的连续追踪纤维分配(FACT)算法,在自然扩散空间中对每个受试者进行全脑纤维束追踪。我们之前的研究,路径跟踪一直进行到分数各向异性<0.15,或者当前路径段和先前路径段之间的角度超过35°。为了确定每个受试者的结构连接网络的节点,在自然扩散空间中定义了感兴趣区域。因此,首先使用线性变换将每个被试的结构图像(即T1加权图像)与它们在自然扩散空间中的B0图像进行配准。然后,通过应用具有12个自由度的仿射变换以及一系列非线性翘曲,将共配准的结构图像映射到ICBM-152 MNI T1模板,这些非线性翘曲的特征在于7×8×7基本函数。将导出的变换参数转置并用于将感兴趣的AAL区域从MNI空间扭曲到自然扩散空间。该程序已应用于先前的研究中。在自然扩散空间中,感兴趣区域(i)和感兴趣区(j)被认为通过边e =(i,j)连接,在它们之间存在至少一条纤维(f)。对于每条边(e),我们计算了端节点之间的连接密度(每单位表面的连接数)作为其权重w(e),根据以下公式计算:
![]()
特别地,Si和Sj分别是个体白质与AAL感兴趣区(i)和感兴趣(j)的2D相交;Fe表示连接感兴趣区i和j的所有纤维的集合(因此对边e有贡献);I(f)表示纤维f沿着其轨迹的长度。通过计算边的权重,我们获得了每个参与者的加权结构连接网络。对于加权结构连通性网络构建的更多细节,请参见Supplementary Fig.3。由于目前在纤维束追踪成像测量中量化结构连接的指标选择方面还没有达成正式共识,我们还评估了加权结构连接性网络中各种替代条目的影响,包括与纤维数量相关的纤维数量;与纤维完整性相关的平均分数各向异性值;以及这些测量的组合(纤维数量 × 分数各向异性) (Supplementary Fig. 4)。
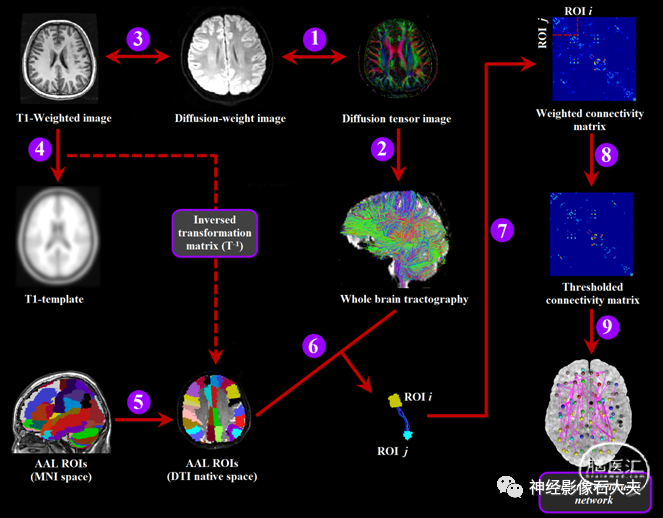
使用 Brain connectivity Toolbox 对IGE-GTCS患者和健康对照组的功能和结构连接网络进行图论分析。对于每个被试的结构连接网络,连接权重按该矩阵的最大值进行缩放,以使每个受试者的成本保持在相同水平。
Statistical analysis
最后,我们通过置换检验比较了IGE-GTCS患者与健康对照组之间的功能连接网络-结构连接网络的耦合。测试了功能-结构连通性耦合强度的差异(即在非零结构连通性网络边约束下,功能连接和结构连接之间的相关系数)。
为了测试我们的结果的再现性,我们进行了分 split-half 分析。具体而言,我们将健康对照组分为两个亚组,年龄和性别匹配(HC1:13名参与者,4名女性,年龄:22.54 ± 2.14岁;HC2:13名参与者,5名女性,年龄:22.69 ± 2.06岁)。同样,我们将GTCS组分为两个匹配的亚组(IGE-GTCS1:13名参与者,5名女性,年龄:24.08 ± 7.03岁;IGE-GTCS2:13名参与者,4名女性,年龄:24.15 ± 6.96岁)(P 均> 0.43)。对于每个亚组,类似于上述全组分析,构建和分析了功能和结构连接网络。为了确定组中是否存在一致的拓扑组织,我们计算了HC1和HC2亚组之间以及IGE-GTCS1和IGE-GTCS2亚组之间的功能和结构连接网络的相关模式的Pearson相关系数。我们还使用置换检验比较了每对亚组之间拓扑参数。
对于低分辨率AAL-90或高分辨率AAL-1024分割方案(Fig. 1 and Supplementary Fig. 5),在所有连接密度[w(e)]构建的功能和结构连接网络中,IGE-GTCS和健康对照都显示出小世界组织( σ>1)。但是,对于AAL-90方案的特定网络组织特征,患者与健康对照组比较有显著性差异(P < 0.05)而对于AAL-1024方案则没有。对于前者,IGE-GTCS患者的功能和结构连接网络显示出类似的网络变化模式:小世界拓扑结构(σ)减少,归一化聚类系数(γ)减少,但归一化特征最短路径长度(λ)没有变化。而在功能连接网络中,IGE-GTCS显示出总连接强度(![]() )增加 ,没有发现结构连接网络发生变化(Fig.1)。分数各向异性、纤维数和分数各向异性× 纤维数也表现出小世界属性,但IGE-GTCS患者和健康对照组之间的小世界属性(σ)没有发现差异。因此,没有进一步分析由这些指数构建的结构网络。对于功能和结构连接网络的总体拓扑指数,我们发现与癫痫病程和发作频率无关。
)增加 ,没有发现结构连接网络发生变化(Fig.1)。分数各向异性、纤维数和分数各向异性× 纤维数也表现出小世界属性,但IGE-GTCS患者和健康对照组之间的小世界属性(σ)没有发现差异。因此,没有进一步分析由这些指数构建的结构网络。对于功能和结构连接网络的总体拓扑指数,我们发现与癫痫病程和发作频率无关。

我们使用替代特征加权度、效率和介数中心性确定了类似的枢纽区域。与之前的报告一致,我们发现,几个节点通常在三个度量中呈现网络中枢特性(对于功能连接网络包括双侧岛叶、左额上回内侧眶部、中额上回、缘上回和额中回、右中央后回等7个节点;对于结构连接网络,包括包括左额上回、中央旁小叶和额上回眶部、右中央后回、岛回、额上回眶部、直肌回、额中回眶部、距状裂和枕中回)。此外,AAL-90(Supplementary Fig. 6)和AAL-1024方案(Supplementary Fig. 7)之间存在收敛结果。
脑区度(![]() ), 效率(
), 效率(![]() ) 和介数中心性(
) 和介数中心性(![]() ) 揭示了IGE-GTCS中节点属性的变化,AAL-90和AAL-1024分割方案的结果相似(Fig. 2 and Supplementary Fig. 8)。
) 揭示了IGE-GTCS中节点属性的变化,AAL-90和AAL-1024分割方案的结果相似(Fig. 2 and Supplementary Fig. 8)。


在功能连接网络中,IGE-GTCS 双侧前扣带回、右杏仁核、壳核、丘脑、左侧颞中回和额上回背外侧部的![]() 增加;左罗兰迪克岛盖、颞上极和右颞下回
增加;左罗兰迪克岛盖、颞上极和右颞下回![]() 减少(Fig.2A)。IGE-GTCS 中
减少(Fig.2A)。IGE-GTCS 中 ![]() 差异与
差异与![]() 相似。双侧前扣带回、左额上回背外侧部、右侧壳核、杏仁核和钙距状裂
相似。双侧前扣带回、左额上回背外侧部、右侧壳核、杏仁核和钙距状裂 ![]() 增加;左罗兰迪克岛盖、颞上极、右颞下回和后扣带回
增加;左罗兰迪克岛盖、颞上极、右颞下回和后扣带回 ![]() 减少(Fig.2C)。左侧颞中回和右侧杏仁核
减少(Fig.2C)。左侧颞中回和右侧杏仁核![]() 增多;右后扣带回
增多;右后扣带回![]() 减少。右侧杏仁核
减少。右侧杏仁核![]() (r = 0.4275,P = 0.0293)和
(r = 0.4275,P = 0.0293)和 ![]() (r = 0.4157,P = 0.0347)均与癫痫病程呈正相关。
(r = 0.4157,P = 0.0347)均与癫痫病程呈正相关。
在结构连接网络中,IGE-GTCS 左侧海马![]() 增加;双侧前扣带回、右侧苍白球和额下回三角形部
增加;双侧前扣带回、右侧苍白球和额下回三角形部![]() 减少(Fig.2B)。IGE-GTCS 右侧嗅皮层、梭状回和舌回
减少(Fig.2B)。IGE-GTCS 右侧嗅皮层、梭状回和舌回 ![]() 增加;双侧前扣带回、右额下回三角部、杏仁核、海马和直回
增加;双侧前扣带回、右额下回三角部、杏仁核、海马和直回 ![]() 减少(Fig.2D)。双侧前扣带回的节点的
减少(Fig.2D)。双侧前扣带回的节点的![]() 和
和 ![]() 表现出相似的模。右侧额回三角部三角部
表现出相似的模。右侧额回三角部三角部![]() 增多;左前扣带回
增多;左前扣带回![]() 减少。在结构连接网络中,没有发现节点特征与癫痫变量之间的相关性。
减少。在结构连接网络中,没有发现节点特征与癫痫变量之间的相关性。
总之,![]() 变化的模式与
变化的模式与 ![]() 相似, 但与
相似, 但与 ![]() 存在一些差异. 根据一个脑区在这三个节点测量中显示显著组差异的频率,我们将解剖亚区确定为与IGE-GTCS变化相关的核心区域的成员,包括至少两个特征(Table 1)和一个特征(Supplementary Table 3)发生变化的脑区。
存在一些差异. 根据一个脑区在这三个节点测量中显示显著组差异的频率,我们将解剖亚区确定为与IGE-GTCS变化相关的核心区域的成员,包括至少两个特征(Table 1)和一个特征(Supplementary Table 3)发生变化的脑区。

Upward arrow = region showing increase in the nodal topological characteristic in patients with IGE-GTCS. Downward arrow = region showing increase in the nodal topological characteristic. Dash = region showing no significant group difference of the nodal topological characteristic.
ACG = anterior cingulate gyrus; AMYG = amygdala; FCN = functional connectivity network; IFGtriang = triangular part of inferior frontal gyrus; ITG = inferior temporal gyrus; L = left; LING = lingual gyrus; MTG = middle temporal gyrus; PCG = posterior cingulate gyrus; PUT = putamen; R = right; ROL = rolandic operculum; SCN = structural connectivity network; SFGdor = superior frontal gyrus, dorsolateral part; TPOsup = superior temporal gyrus, temporal pole.
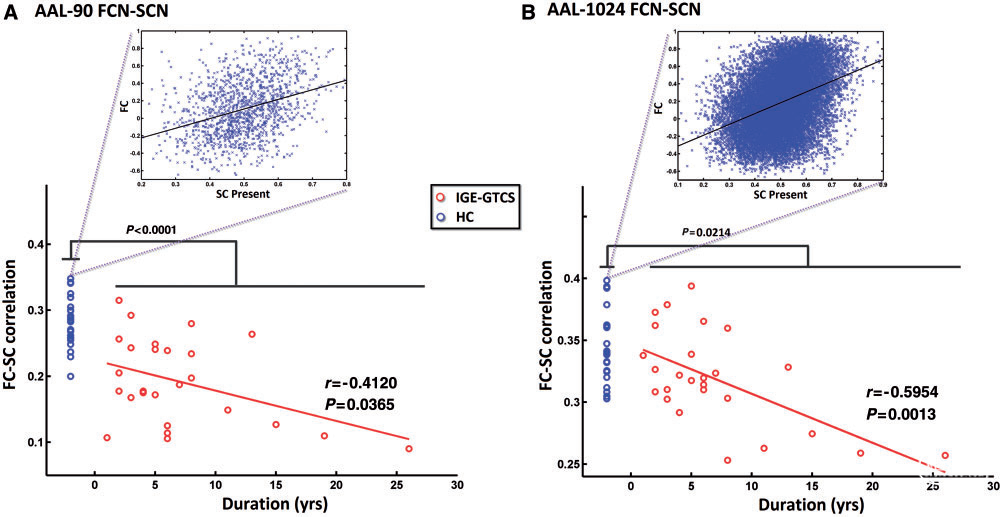
Figure 3 Disrupted functional–structural connectivity coupling in IGE-GTCS. Compared to healthy controls (HC), IGE-GTCS showed decreased functional–structural connectivity coupling (permutation testing, P 50.05) in AAL-90 (A) and AAL-1024 (B). The strength of functional–structural connectivity coupling negatively correlated with duration of epilepsy in patients. The inset plots show the functional–structural connectivity coupling of selected individuals. FCN = functional connectivity network; SCN = structural connectivity network
与健康对照组相比(AAL-90和AAL-1024方案分别为0.2822 ± 0.0355和0.3412 ± 0.0279),IGE-GTCS患者( AAL-90和AAL-1024方案分别为0.1924 ± 0.0647和0.3190 ±0.0386)显示功能-结构连接耦合强度降低( AAL-90和AAL-1024方案分别为P <0.0001;P=0.0214)。此外,在患者中,功能-结构连接耦合的强度与癫痫病程呈负相关(AAL-90:r = −0.4120,P = 0.0365;AAL-1024:r = −0.5954,P = 0.0013)(Fig.3)。
对于AAL-90或AAL-1024方案,先前构建和匹配的 split-half 亚组在拓扑组织上功能连接网络和结构连接网络都是相似的。目视检查显示,这些亚组的连接模式相似。此外,比较两个健康对照亚组(HC1和HC2),我们观察到加权网络显著相关(AAL-90功能连接网络和结构连接网络分别为r = 0.9495和AAL-1024功能和结构连接网络分别为r = 0.9659;r = 0.8795和r = 0.9255)。对于IGE-GCTS的两个亚组也如此(AAL-90功能连接网络和结构连接网络分别为r = 0.9401和r = 0.9633;AAL-1024功能和结构连接网络分别为r = 0.8787和r = 0.9218)(Fig. 4 and Supplementary Fig. 10)。仅对AAL-90进行了拓扑参数的比较。两个健康对照亚组之间的比较(HC1与HC2,P > 0.05)或两个IGE-GTCS亚组之间的比较(IGE-GTCS1与IGE-GTCS2,P > 0.05)均未发现![]() 显著差异。另一方面,将患者组与对照组进行比较,我们观察到功能连接网络
显著差异。另一方面,将患者组与对照组进行比较,我们观察到功能连接网络![]() (HC1与IGE-GTCS1、HC1与IGE-GTCS2、HC2与IGE-GTCPS1和HC2与IGE-GTCPS2)和
(HC1与IGE-GTCS1、HC1与IGE-GTCS2、HC2与IGE-GTCPS1和HC2与IGE-GTCPS2)和![]() (HC2与伊格-GTCS1)存在显著差异(Fig.4A)。此外,结构连接网络
(HC2与伊格-GTCS1)存在显著差异(Fig.4A)。此外,结构连接网络![]() (HC1与IGE-GTCS2和HC2与IGE-GTCPS1)和
(HC1与IGE-GTCS2和HC2与IGE-GTCPS1)和![]() (HC1和IGE-GTCS1,HC2与IGE-GTCS1和HC2和IGE-GTCS2)存在显著差异(Fig.4B)。这些结果表明我们的发现具有很高的可重复性。
(HC1和IGE-GTCS1,HC2与IGE-GTCS1和HC2和IGE-GTCS2)存在显著差异(Fig.4B)。这些结果表明我们的发现具有很高的可重复性。

Figure 4 Evaluation of the reproducibility of the results for the functional connectivity network (A) and structural connectivity network (B). Top: mean network matrices of each subgroup (HC1, HC2, IGE-GTCS1 and IGE-GTCS2); the edge represents the connection weight between nodes. (Bottom left): the correlation between two healthy controls subgroups and between two IGE-GTCS subgroups. (Bottom right): significant differences in the two nodal characteristics between the two healthy controls subgroups and between the two IGE-GTCS subgroups. FCN = functional connectivity network; SCN = structural connectivity network.
|
与先前关于癫痫的图论研究一致,我们的结果表明,IGE-GTCS患者和健康对照者在功能和结构连接网络中都有小世界拓扑属性。这种拓扑结构与同时进行的全局和局部并行信息处理相关,并与正常的人类认知功能和其他病理状态相关,如结构和功能脑网络所示。目前的工作提供了一个新的案例,即IGE-GTCS患者在功能和结构连接网络中都有异常的小世界属性(Fig.1)。这些结果表明,与对照组相比,IGE-GTCS患者与特定病理状态相关的网络组织优化程度可能较低。
在IGE-GTCS患者中,功能和结构连接网络都显示出归一化聚类系数(γ)的显著降低。γ是检查网络小世界属性的变化是否更规则或更随机的关键指标之一。目前的结果表明,IGE-GTCS中的大脑网络结构发生了随机变化。关于癫痫患者全脑网络拓扑结构的改变,现在已经发表了许多使用功能连接网络的图论分析的研究,其中大多数使用电生理记录。记录的周期(发作间期与发作期)可能有助于网络拓扑组织的转变。通常,癫痫发作期间的功能网络拓扑结构修改显示出复杂的转变,但在部分性和全身性癫痫中基本上是向更规则的网络转变。最近一项使用脑电图和脑磁图的发作间期研究报告称,与对照组相比,网络更规则。此外,在大样本耐药颞叶癫痫患者,使用由皮层厚度相关性构建的结构网络也观察到了更规则的拓扑结构。相反,在相对年轻的双侧颞叶癫痫患者中使用静息态功能MRI,Liao及其同事在发作间期观察到了更随机的拓扑结构。可能不仅癫痫表型,而且连接测量的模态也部分解释了其中的一些差异。事实上,由于当前的结果是基于功能连接网络的功能MRI和结构连接网络的弥散加权成像,因此它们可能不一定与来自同一队列中功能连接网络电生理学和结构连接网结构相关性分析的数据可比。尽管如此,我们在IGE-GTCS的功能和结构域都检测到了一致的拓扑变化,因此可能交叉验证了我们对这两种模态的发现。
在IGE-GTCS中,连接强度的(![]() ) 总体水平仅在功能连接网络中增加,而在结构连接网络中没有增加。
) 总体水平仅在功能连接网络中增加,而在结构连接网络中没有增加。![]() 测量大脑网络中的全局连接强度。IGE-GTCS在静息状态下发作间期功能连接水平的增加与先前几项功能MRI研究的结果一致。有人认为,这种增加可能与功能重组和可塑性有关。与功能连接网络
测量大脑网络中的全局连接强度。IGE-GTCS在静息状态下发作间期功能连接水平的增加与先前几项功能MRI研究的结果一致。有人认为,这种增加可能与功能重组和可塑性有关。与功能连接网络![]() 增加的发现相反,IGE-GTCS患者的结构连接网络
增加的发现相反,IGE-GTCS患者的结构连接网络![]() 没有变化。先前已经报道了功能连接网络和结构连接网络之间不一致的拓扑特征。一般来说,功能连接网络被认为更灵活;而结构连接网络相对稳定。因此,我们推断,IGE-GTCS患者对结构连接网络的影响可能较小。相反,通过血氧水平依赖性波动测量的功能连接网络可能对癫痫活动的扰动具有高度响应性。
没有变化。先前已经报道了功能连接网络和结构连接网络之间不一致的拓扑特征。一般来说,功能连接网络被认为更灵活;而结构连接网络相对稳定。因此,我们推断,IGE-GTCS患者对结构连接网络的影响可能较小。相反,通过血氧水平依赖性波动测量的功能连接网络可能对癫痫活动的扰动具有高度响应性。
hub 性增加的脑区与先前显示参与IGE病理性皮质下网络的区域部分重叠。类似的发现以前也在颞叶癫痫中得到了证实,作者还观察到患者的边缘旁(paralimbic) hub 比例高于对照组。
在丘脑中,我们观察到功能连接网络![]() 增加。这些发现可能是这种结构在IGE癫痫活动的产生、传播和调节中的核心作用的基础。影像学证据也显示IGE中丘脑皮质网络的功能连接增加。我们的发现与文献一致。此外,这些发现可能支持癫痫灶可能对应于强连接网络节点的假设。
增加。这些发现可能是这种结构在IGE癫痫活动的产生、传播和调节中的核心作用的基础。影像学证据也显示IGE中丘脑皮质网络的功能连接增加。我们的发现与文献一致。此外,这些发现可能支持癫痫灶可能对应于强连接网络节点的假设。
与对照组相比,在双侧前扣带回,我们观察到功能和结构连接网络的![]() 和
和![]() 改变。该区域被认为是健康大脑中可能参与多种情感、认知和运动过程的主要 hub。在IGE的病理生理过程中,额叶内侧区和前扣带回也被证明在癫痫放电和丘脑-皮质联系的传播和泛化中发挥着重要作用。
改变。该区域被认为是健康大脑中可能参与多种情感、认知和运动过程的主要 hub。在IGE的病理生理过程中,额叶内侧区和前扣带回也被证明在癫痫放电和丘脑-皮质联系的传播和泛化中发挥着重要作用。
出乎意料的是,我们还观察到IGE-GTCS患者的杏仁核在所有三个节点拓扑特征上都有所增加。此外,这些变化显示癫痫病程与![]() 和
和![]() 特征呈正相关。虽然杏仁核一直被证明与颞叶癫痫有关,但其在IGE中的作用尚不清楚。另一方面,杏仁核与丘脑和前扣带回紧密相连,如人类的功能连接和扩散纤维束追踪所示,在癫痫泛化过程中,杏仁核可能参与与这两个病理 hub 区域相似的病理过程。值得注意的是,杏仁核点燃是动物研究中引发全身性癫痫发作的一项重要技术。另一种可能性是杏仁核连接的增加可能反映了IGE的情绪症状。未来结合行为和神经影像学数据进行研究可能会检验这些假设。
特征呈正相关。虽然杏仁核一直被证明与颞叶癫痫有关,但其在IGE中的作用尚不清楚。另一方面,杏仁核与丘脑和前扣带回紧密相连,如人类的功能连接和扩散纤维束追踪所示,在癫痫泛化过程中,杏仁核可能参与与这两个病理 hub 区域相似的病理过程。值得注意的是,杏仁核点燃是动物研究中引发全身性癫痫发作的一项重要技术。另一种可能性是杏仁核连接的增加可能反映了IGE的情绪症状。未来结合行为和神经影像学数据进行研究可能会检验这些假设。
另一个意想不到的发现是IGE-GTCS中改变节点的空间分布不对称。通常认为IGE的大脑是双侧对称地参与IGE的。尽管如此,我们的发现与最近的研究一致,这些研究证明了IGE中的不对称和偏侧。
在本研究中,我们结合功能MRI和弥散张量成像技术,研究了IGE-GTCS患者和健康受试者的大规模脑网络中的结构-功能关系。功能网络评估血氧水平依赖性波动的时间一致性,而结构网络利用了沿着髓鞘神经纤维束的水扩散。从单个皮层层面到静息态网络甚至到大规模全脑网络,在不同水平上都发现了收敛的功能和结构连接。目前认为,结构连接对功能连接具有高度的预测性,并对功能连接施加约束。相反,功能连接通过可塑性机制对结构连接产生影响。先前已经观察到,功能-结构连接耦合可以在生理状态或病理状态下配置。这项研究首次涉及病理状态下大规模全脑网络的功能-结构关系。
在本研究中,我们将功能连接网络(功能连接MRI)和结构连接网络(弥散纤维束追踪)相结合,研究IGE-GTCS患者复杂脑网络组织的变化。尽管IGE-GTCS和健康对照组在功能和结构连接网络中表现出小世界拓扑属性,但患者在功能和结构连接网络中显示出最佳拓扑组织的减少。此外,功能和结构连接网络在与IGE-GTCS中涉及的皮层和皮层下区域相关的几个关键节点内显示出节点属性的改变。重要的是,我们在IGE-GTCS中发现了功能-结构连接网络耦合的降低,这种解耦联与疾病的病程相关,这表明功能-结构连接性网络耦合可能反映了IGE-GTCS的进展。总的来说,本研究首次证明IGE-GTCS与大规模大脑结构和功能网络拓扑组织的破坏有关,为更好地理解这种疾病开辟了新的途径。
![]()
声明:脑医汇旗下神外资讯、神介资讯、神内资讯、脑医咨询、Ai Brain 所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。






