脑医汇,由外而内,融“汇”贯通
2023年4月20日,浙江大学医学院系统神经与认知科学研究所王朗课题组与基础医学院谷岩课题组合作的研究论文“GRM2 regulates functional integration of adult-born DGCs by paradoxically modulating MEK/ERK1/2 pathway”作为本期《Journal of Neuroscience》封面文章正式上线发表,揭示了2型代谢型谷氨酸受体(GRM2)通过MEK/ERK1/2信号通路调控成体海马新生神经元的发育及功能整合的分子机制。浙江大学医学院系统神经与认知科学研究所王朗副研究员与基础医学院谷岩教授为本文共同通讯作者;博士研究生马骄与博士后胡哲纯为共同第一作者。本研究受到了科技部重点研发计划、国家自然科学基金、浙江省自然科学基金等多项目资助。

[Ma J, Hu Z, Yue H, Luo Y, Wang C, Wu X, Gu Y, Wang L. GRM2 Regulates Functional Integration of Adult-Born DGCs by Paradoxically Modulating MEK/ERK1/2 Pathway. J Neurosci. 2023 Apr 19;43(16):2822-2836. doi: 10.1523/JNEUROSCI.1886-22.2023. Epub 2023 Mar 6. PMID: 36878727; PMCID: PMC10124958.]
1
研究背景
成体神经发生是指哺乳动物中枢神经系统在成年后仍然能够持续产生新生神经元的现象,主要存在于侧脑室下区(SVZ)和海马齿状回颗粒层下区(SGZ)。在成年大脑海马齿状回中产生的新生神经元经过大约4周的发育,与原有的海马神经环路进行突触整合,从而发挥其生理功能。以往的研究表明,成体海马神经发生对海马相关的认知功能及情绪调节中发挥重要作用。此外,成体新生神经元的发育异常也与多种神经系统疾病所伴随的认知功能障碍密切相关。因此,探究成体海马新生神经元发育及功能整合的调控机制对于深入理解成体神经发生的生理功能是必不可少的关键环节,并且有助于寻找海马相关认知功能障碍的干预靶点。
2
研究方法&研究结果
2型代谢型谷氨酸受体(GRM2/mGluR2)属于G蛋白偶联受体家族。GRM2的激活可以抑制神经元兴奋性和神经元轴突末梢的递质释放,从而参与调控突触传递和突触可塑性。研究表明,在癫痫和阿尔兹海默症等神经系统疾病中,GRM2在脑内的表达均有显著变化。在海马齿状回颗粒神经元中,GRM2具有特异性的高表达。以往的研究表明,海马成体新生神经元在发育到4周时,其轴突末梢突触传递可以被GRM2/3激动剂抑制,表明这时的新生已经表达较高水平的GRM2,具有和原有的成熟齿状回颗粒神经元相同的生理特性。然而,GRM2何时在新生神经元中开始表达,以及是否参与调控新生神经元的发育整合并进而调控海马依赖性的认知功能,尚不清楚。
研究人员首先通过RNA-scope方法确定GRM2在海马新生神经元和成熟神经元中的表达水平存在差异(图1A)。利用逆转录病毒特异性标记结合单细胞qRT-PCR的方法,作者阐明了GRM2在成体新生神经元中的表达发育谱线(图1B)。特异性敲降成体海马新生神经元中的Grm2后,作者发现神经元树突的总长度、分支数目及复杂程度均显著降低(图1C-F)。这一结果表明GRM2的表达是成体海马新生神经元正常形态发育的必要条件。
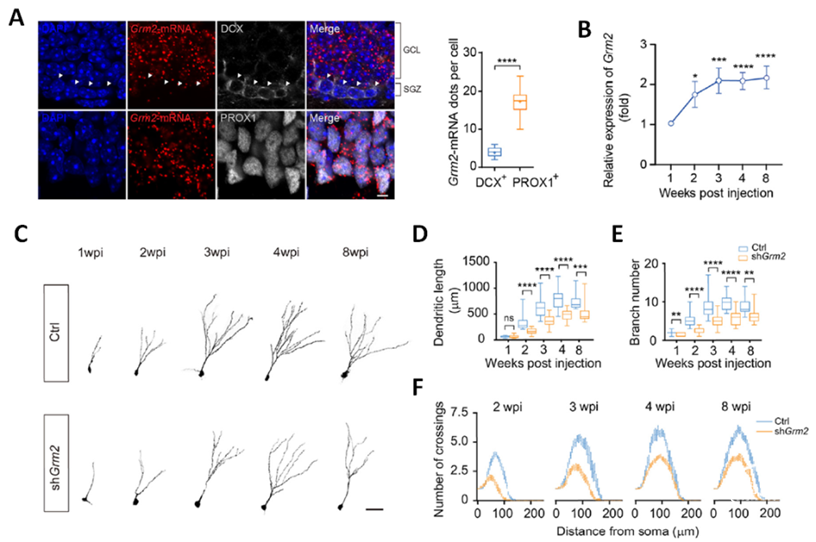
图1. 特异性敲降Grm2抑制成体海马新生神经元的形态发育
研究人员进一步发现,敲降Grm2抑制了新生神经元树突棘的形成(图2A-C),并显著降低了新生神经元mEPSCs的频率(图2D-H)。同时,敲降Grm2也显著减少了新生神经元轴突末梢膨大的面积(图2I, J)。这些结果表明GRM2对于成体海马新生神经元在已有神经环路中进行树突与轴突的功能整合至关重要。
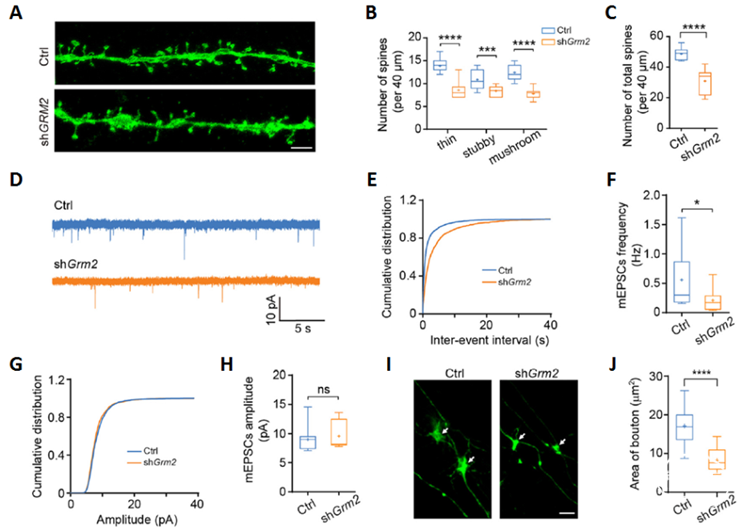
图2. 敲降Grm2抑制成体海马新生神经元的突触整合
为了进一步探究GRM2调控神经元发育的分子机制,在体外原代培养的小鼠海马神经元中敲降Grm2的表达,发现敲降Grm2激活了MEK/ERK1/2信号通路,引起pERK1/2和pMEK水平升高(图3A-E),并引起pERK1/2的入核(图3F-G)。同时,研究人员还发现在体外培养的海马神经元中用药物激活MEK/ERK1/2通路可以模拟敲降Grm2后pERK1/2磷酸化水平的增加和神经元发育障碍(图3H-K)。

图3. 敲降Grm2激活MEK/ERK1/2信号通路
在成体海马新生神经元中敲降Grm2的同时,利用dnMapk1抑制MEK/ERK1/2信号通路的过度激活,则能够挽救因敲降Grm2导致的神经元发育障碍(图4A-E),以及小鼠认知功能缺陷(图4F-H)。因此,以上研究结果表明,GRM2通过调节成体海马新生神经元的发育与整合,进而调控海马依赖性的认知功能。
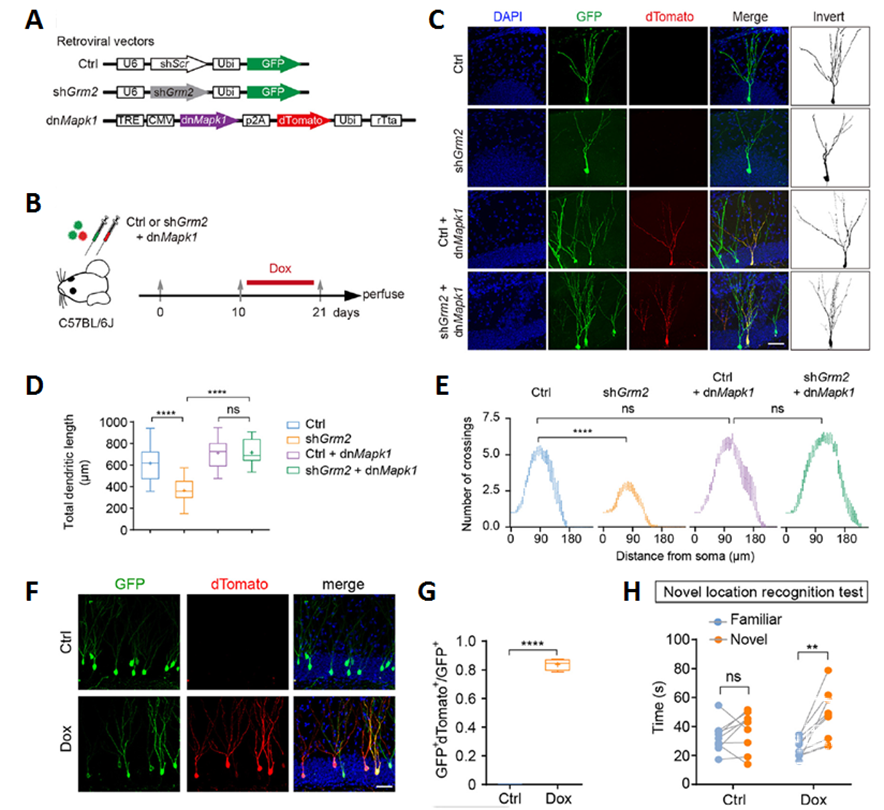
图4. 敲降Grm2导致海马依赖性认知功能障碍及挽救
3
研究结论
综合以上实验结果,该研究发现了GRM2调控成体新生神经元发育和整合的分子机制,揭示了GRM2表达的降低导致MEK/ERK1/2信号通路的异常激活,从而导致新生神经元的发育缺陷。因此,GRM2除了参与调控海马齿状回成熟颗粒神经元的突触传递与可塑性,对新生神经元的发育过程也有重要的调控作用。这项研究揭示了成体海马新生神经元发育的一种新的内在调控机制,同时也为海马依赖的特定认知功能障碍的治疗提供了潜在的药物靶点。
通
讯
作
者
*本文转载自浙江大学医学院公众号
声明:脑医汇旗下神外资讯、神介资讯、神内资讯、脑医咨询、Ai Brain 所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。





