REF: Wang C, Ji Y, Zhang H, et al. Increased level of exosomal miR-20b-5p derived from hypothermia-treated microglia promotes neurite outgrowth and synapse recovery after traumatic brain injury. Neurobiol Dis. 2023;179:106042. doi:10.1016/j.nbd.2023.106042
PMID: 36804284

介 绍
结 果
亚低温处理小胶质细胞源外泌体促进TBI后神经突起及突触再生
体外实验中,我们使用PKH26标记常温处理的LPS激活小胶质细胞来源外泌体(MG-LPS-EXONT)及亚低温处理的LPS激活小胶质细胞来源外泌体(MG-LPS-EXOHT),并将上述外泌体分别与牵张损伤的神经元共培养(图1A)。72小时后通过MAP2免疫荧光染色检测神经元形态改变;免疫印迹实验检测神经元突触再生相关蛋白PSD-95及GluR1表达水平改变。结果显示:神经元可摄取小胶质细胞来源外泌体(图1B);MG-LPS-EXOHT可显著增加体外牵张损伤神经元神经突起数量及总长度(图1D,1E);MG-LPS-EXOHT可显著促进体外牵张损伤神经元PSD-95及GluR1表达(图1F,1G)。




亚低温处理小胶质细胞源外泌体改善TBI后小鼠运动功能障碍


亚低温调控小胶质细胞外泌体内microRNA含量
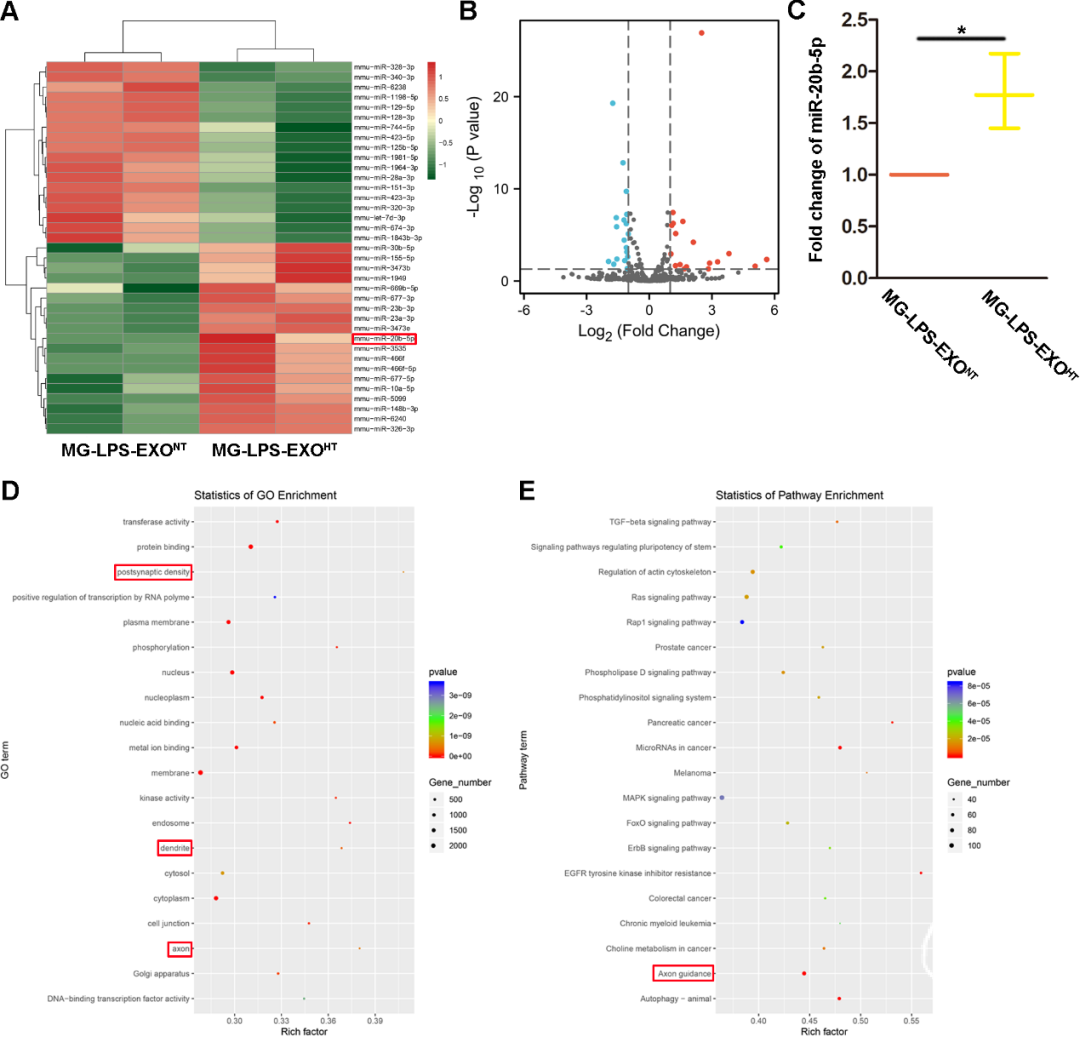

miR-20b-5p促进TBI后神经突起及突触再生并抑制炎性微环境产生
我们分别在体外实验及体内实验中证明miR-20b-5p促进TBI后神经突起及突触再生。
体外实验中,我们将NC mimic及miR-20b-5p mimic分别与牵张损伤的神经元共培养。72小时后通过MAP2免疫荧光染色检测神经元形态改变;免疫印迹实验检测神经元突触再生相关蛋白PSD-95及GluR1表达水平改变。结果显示:miR-20b-5p mimic可显著增加体外牵张损伤神经元神经突起数量及总长度(图5A,5B);miR-20b-5p mimic可显著促进体外牵张损伤神经元PSD-95及GluR1表达(图5C,5D)。


体内实验中,我们通过尾静脉分别将Agomir NC及Agomir-20b-5p注射入TBI小鼠(CCI模型)。72小时后灌注取脑,Golgi染色检测神经元形态及突触数量改变。结果显示:Agomir-20b-5p可显著增加损伤周围区神经元神经突起数量和总长度,以及突触数量(图6A-6D)。


后续机制研究我们发现,miR-20b-5p可直接结合PTEN基因mRNA,降低神经元损伤后PTEN蛋白表达,进而上调p-AKT水平(图7A-7D)。在体外牵张损伤神经元内加入AKT选择性抑制剂MK-2206可逆转miR-20b-5p对损伤神经元神经突起再生相关蛋白GAP43和突触再生相关蛋白PSD-95及GluR1表达的促进作用(图7E,7F)。


同时我们研究发现,miR-20b-5p可降低LPS激活小胶质细胞内IL-1β、IL-6及iNOS的mRNA水平,提示miR-20b-5p可能抑制TBI后炎性微环境的形成(图8A-8F)。


miR-20b-5p改善TBI后小鼠运动功能障碍


讨 论
最新研究表明,长时程亚低温可显著提高重型TBI患者的临床预后。其相关机制尚不完全明确。近年来,研究发现,亚低温可抑制小胶质细胞活化,并调控促炎M1型小胶质细胞向抑炎M2型小胶质细胞转化,从而改善中枢神经系统免疫微环境,产生脑保护作用并促进神经元再生。本研究着重于对亚低温处理的小胶质细胞源外泌体microRNA表达谱进行分析,定位miR-20b-5p,并阐明亚低温通过调控小胶质细胞源外泌体内miR-20b-5p含量促进TBI后神经再生的作用及其相关机制。
大量研究表明miR-20b-5p与炎症的发生发展密切相关。miR-20b-5p可阻碍外周巨噬细胞促炎细胞因子的释放,并促进巨噬细胞向M2型转化。中枢神经系统损伤后,小胶质细胞内miR-20b-5p显著下调,而过表达miR-20b-5p可抑制缺血再灌注大鼠神经元凋亡及梗塞灶的形成。但目前,对TBI后小胶质细胞源外泌体内miR-20b-5p在中枢神经系统中的作用及其机制尚未见报道。本研究着重阐明了小胶质细胞源外泌体内miR-20b-5p在TBI后可促进损伤神经元神经突起及突触再生,抑制炎性微环境形成,并改善小鼠运动功能,其相关机制可能涉及对PI3K/AKT/PTEN通路的激活。
本研究仍有一定的局限性。首先,根据microRNA靶基因数据库的预测结果及既往多篇基础研究的结论,miR-20b-5p的下游靶基因可能参与TGF-β/Smad通路及其他神经元再生相关通路的调控。故除PI3K/AKT/PTEN通路外,miR-20b-5p可能通过其他通路促进损伤神经元神经突起及突触再生。其次,MG-LPS-EXOHT内共有19个microRNA较MG-LPS-EXONT显著升高,18个microRNA较MG-LPS-EXONT显著降低,除miR-20b-5p外,亚低温可能通过调控小胶质细胞源外泌体内其他microRNA促进神经元再生,如miR-23b-3p。有研究指出,施旺细胞源细胞外囊泡内miR-23b-3p可显著促进外周神经轴突再生。相关问题仍需要进一步研究。
结论及后续工作展望
第一作者简介
王传方 主治医师
广州医科大学附属第二医院
神经外科,主治医师,上海交通大学博士,中山大学及广州医科大学博士后
主要从事颅脑创伤及脑血管疾病的外科诊疗工作
主持国家级课题一项,省部级课题三项,市级课题一项。以第一作者及通讯作者发表中科院一区,二区SCI论文多篇。现担任广州市医师协会神经外科分会委员
通讯作者简介
王业忠 教授
广州医科大学附属第二医院
神经外科科主任,学科带头人,广州医科大学神经科学研究所副所长
医学博士,二级教授,主任医师,博士生导师,博士后合作导师,国务院政府特殊津贴专家,广州市优秀专家,广州医科大学“南山学者”
社会任职:广州市医学会常务理事;广州市医学会神经外科学分会主任委员;世界华人神经外科联合会委员;中国神经科学学会理事;中国医师协会神经外科医师分会委员;中国研究型医院学会神经外科学专业委员会常务委员;中华医学会神经外科学分会第六、七届委员会委员;中华医学会神经外科学分会脑血管病学组委员;广东省健康管理学会神经外科专业委员会主任委员;广东省医学会神经外科学分会副主任委员、颅底鞍区组组长;广东省医师协会神经外科医师分会副主任委员;广东省医学教育协会神经外科专业委员会副主任委员;广东省医院协会临床科主任管理分会副主任委员;广东省精准医学应用学会神经肿瘤分会副主任委员等
专业特长:主要研究领域为脑血管病、颅脑创伤及颅底肿瘤
声明:脑医汇旗下神外资讯、神介资讯、神内资讯、脑医咨询、AiBrain 所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。







