
【大家说】栏目,关注脑疾病转化医学前沿,综合研究成果概述、研究作者自述和国内权威专家解读。本期栏目,我们特别邀请到来自复旦大学附属华山医院神经外科的吴劲松教授,为我们解读并分享最新发表在Nature Medicine上的一项有关术中快速诊断弥漫性胶质瘤分子分型的创新研究成果。
一、研究概述
弥漫性胶质瘤是最常见、最致命的原发性脑肿瘤,现今使用多种分子标志物来定义。分子分型对于脑胶质瘤诊疗的重要性与日俱增,因为脑肿瘤患者的基因组成会导致其手术获益和风险情况存在差异。事实上,相比于其他弥漫性胶质瘤亚型,星形细胞瘤(弥漫性胶质瘤的一种特定类型)患者在接受全切手术后,平均可获得5年的生存期。然而,确定弥漫性胶质瘤的分子分型需要借助实验室技术,如免疫组织化学(IHC)、细胞遗传学检测以及下一代测序技术,但各家脑肿瘤治疗中心的配备情况不尽相同。即使资源配置完善的中心有条件对脑肿瘤采用分子诊断和测序技术,其周转时间也很长(几天至几周)。分子诊断的阻碍可能导致脑肿瘤患者的护理不佳,让其预后预测、手术决策、切除目标范围、辅助放化疗方案选择、临床试验入组等变得复杂。
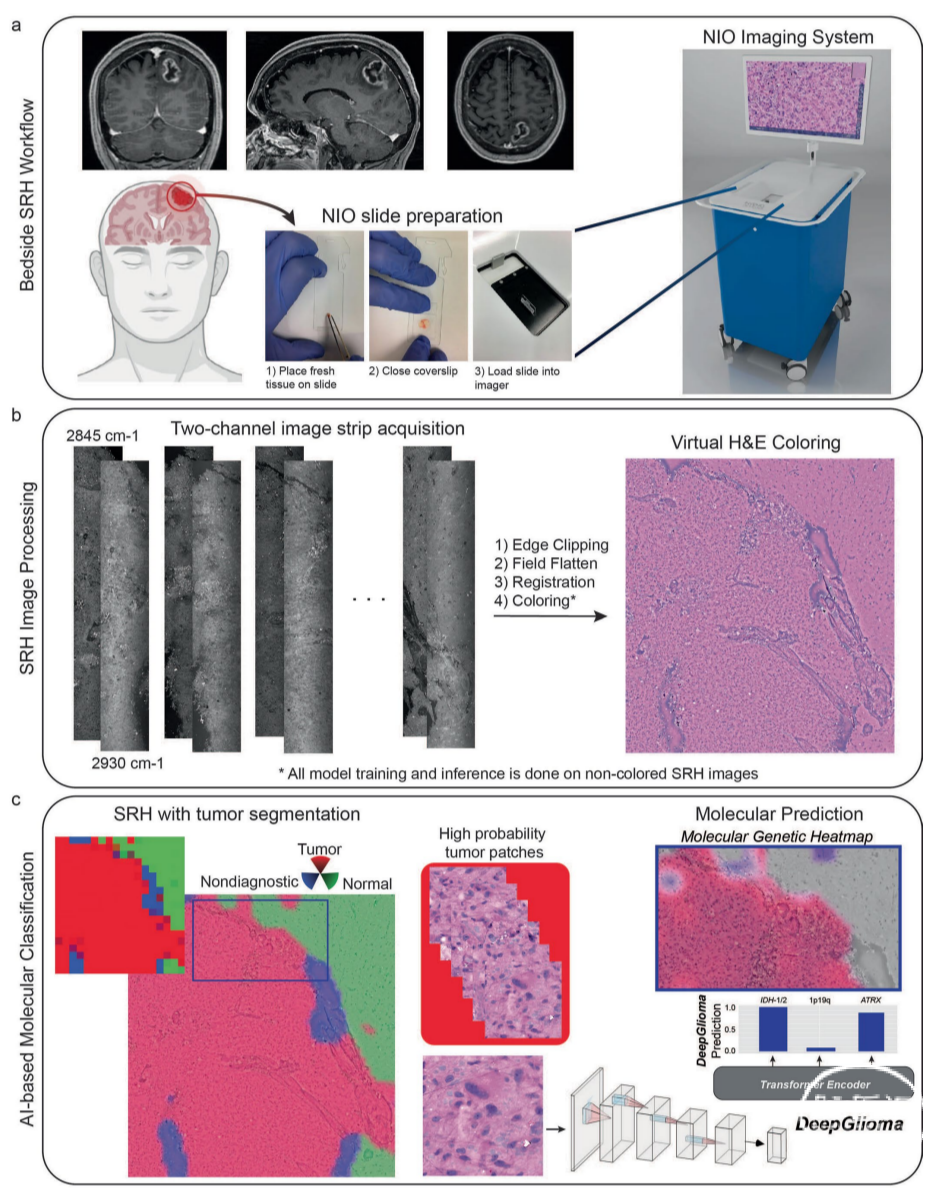
美国密歇根大学医学院的神经外科医生和工程师团队,连同纽约大学、加州大学旧金山分校及其他机构的研究者,开发了一种基于人工智能(AI)技术的诊断筛查系统——DeepGlioma。该系统结合深度神经网络和受激拉曼组织学(stimulated Raman histology,SRH),可实现对术中采集的新鲜胶质瘤标本的快速分子筛查。
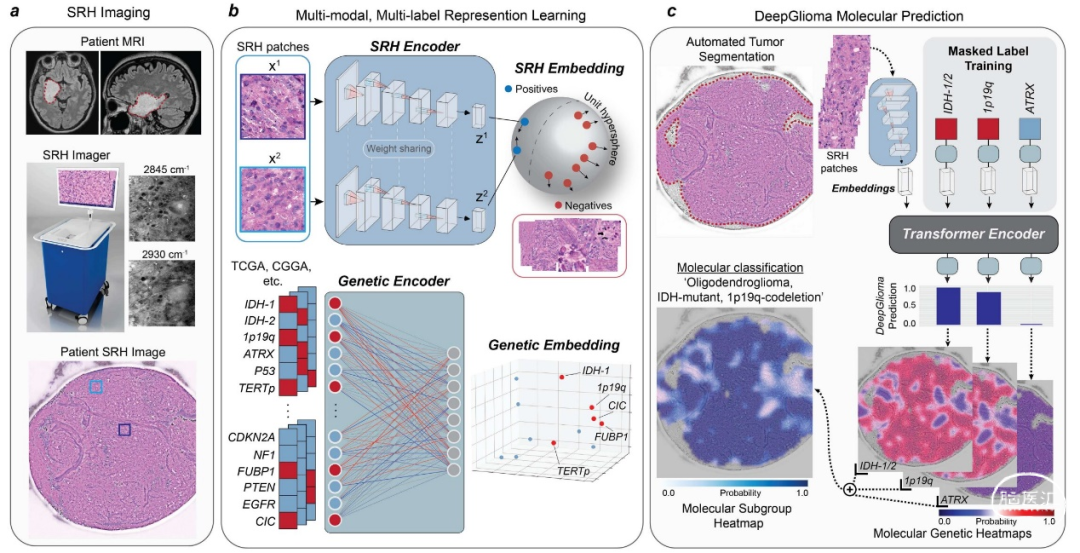
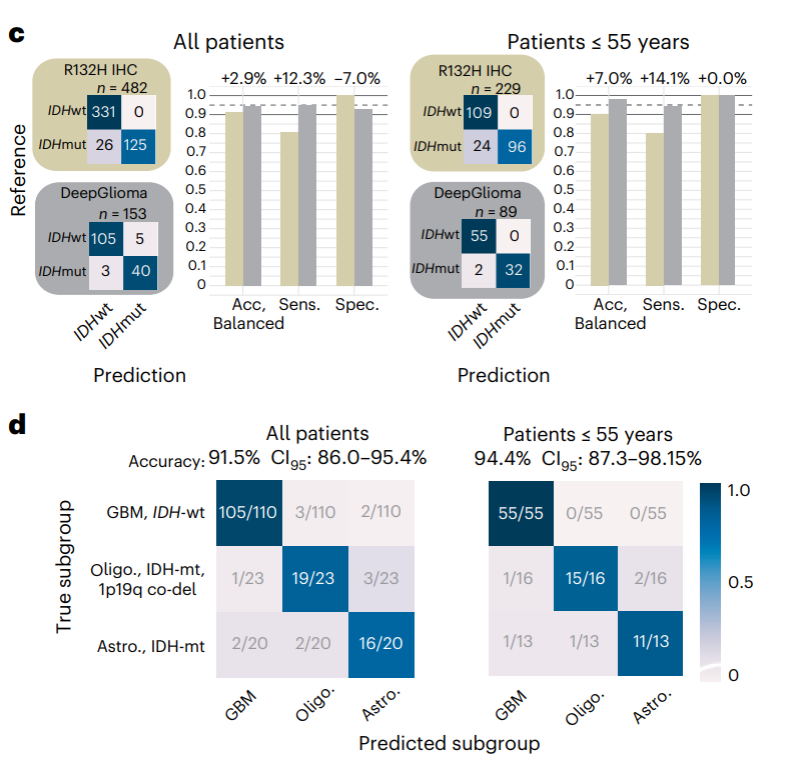
在一项纳入超过150名弥漫性胶质瘤患者的研究中,DeepGlioma对世界卫生组织(WHO)定义的突变进行了识别,以此确定弥漫性胶质瘤的分子分型,平均准确率(Accuracy)超90%,结果于2023年3月23日发表在《Nature Medicine》(IF:87.241/Q1 TOP)上。

+ + + + + + + + + + +
文章来源
Hollon, T., Jiang, C., Chowdury, A. et al. Artificial-intelligence-based molecular classification of diffuse gliomas using rapid, label-free optical imaging. Nat Med (2023). https://doi.org/10.1038/s41591-023-02252-4
二、作者自述
第一作者暨通讯作者、DeepGlioma开发者、美国密歇根大学神经外科医生及助理教授Todd Hollon博士介绍说:“分子诊断的阻碍可能导致脑肿瘤患者的护理不佳,让其手术决策和放化疗方案选择变得复杂。DeepGlioma这种基于AI技术的工具,有可能改善致命脑肿瘤患者的诊断护理途径和速度。”
Hollon博士解释说:“在DeepGlioma出现前,外科医生无法在术中区分弥漫性胶质瘤。2019年,我们有了研发这个系统的想法,该系统结合深度神经网络和密歇根大学开发的SRH光学成像技术,可对脑肿瘤组织进行实时成像。DeepGlioma为具有准确性和更强及时性的分子分型识别提供了一种新方法,让医生有更好的机会来确定治疗方法、预测患者预后。”
研究资深作者、纽约大学格罗斯曼医学院神经外科及病理学副教授、SRH开发者Daniel Orringer博士补充道:“在过去几十年间,弥漫性胶质瘤这种最致命脑肿瘤的治疗进展有限——其部分原因包括靶向治疗获益最大的患者群体识别存在困难。分子分型的快速诊断方法为临床试验设计的重新思考以及患者新疗法的研究开发带来了巨大的希望。”
三、吴劲松教授的权威解读
很高兴看到美国同行在这一领域的新近进展。据我们了解,早在三年前,该研究团队就已采用SRH技术联合无标签光学成像和深度卷积神经网络(deep convolutional neural networks,CNNs)进行了术中实时脑肿瘤的组织病理学诊断,相关结果发表在2020年1月的《Nature Medicine》上(推荐阅读:《人工智能拉曼技术术中实时诊断脑肿瘤》)。众所周知,2021年发布的第5版《WHO 中枢神经系统肿瘤分类》重点推进了分子诊断在中枢神经系统肿瘤分类中的应用,因此可以说,这项研究是与时俱进的。
另一方面,我们知道,对弥漫性胶质瘤患者而言,即使是接受了最佳护理标准的治疗,仍然面临着有限的治疗选择;事实上,恶性弥漫性胶质瘤患者的中位生存期仅为18个月。不过,已经有越来越多的临床证据显示,不同分子亚型的弥漫性胶质瘤应当采用不同的手术策略,例如:
1
少突胶质瘤,IDHmut,1p9qcodel,倾向于手术安全性;
2
星形细胞瘤,IDHmut,需要按照T2W FLAIR边界完全切除;
3
组织型胶质母细胞瘤,强调T1W增强边界外扩至水肿带的扩大切除;
4
分子型胶质母细胞瘤,IDHwild,TERTmut,要求切除范围不局限于增强边界,而应该是包含T2W异常高信号区。
此外,新型药物临床试验给患者带来了新的治疗机遇,但仅有不到10%的胶质瘤患者入组了相关临床试验。新的药物临床试验入排标准往往与弥漫性脑胶质瘤的分子亚型相关。常规术后分子分型与整合病理诊断往往需要两周以上的时间,有可能限制了特定分子亚型的胶质瘤患者术后早期参与一些新型药物治疗试验,例如局部化疗、细胞免疫治疗和肿瘤疫苗治疗等。DeepGlioma这种基于AI技术的工具有望成为早期试验入组的一种“催化剂”。具体来讲,DeepGlioma允许患者在护理的早期阶段即启动临床试验招募过程。在某些试验中,通过术中新型物理技术(例如,聚焦超声)将生物制剂以及化疗药物局部递送到患者病灶中,甚至可以绕过血脑屏障。毫无疑问,弥漫性脑胶质瘤的个体化手术策略以及精准医学新技术都依赖准确和实时的术中分子分型与整合病理诊断。
DeepGlioma技术为WHO CNS标准提供了一种补充解决方案。但我们还是应当看到,SRH依然是一种基于AI深度学习(deep-learning-based)图像识别的间接技术,不能完全代替分子检测“金标准”。未来的发展趋势可能还是采用术中实时PCR技术,覆盖更全面的分子分型标志物。
专家介绍
吴劲松 教授
复旦大学附属华山医院
医学博士,主任医师
复旦大学教授,复旦大学博士研究生导师,上海市卫生系统优秀学科带头人
复旦大学附属华山医院神经外科副主任(科研)
复旦大学神经外科研究所副所长
复旦大学附属华山医院生物样本库主任
国家神经疾病医学中心脑胶质瘤专业组长
复旦大学附属华山医院伦理委员会委员
上海市抗癌协会常务理事,兼神经肿瘤专业委员会主任委员
中国抗癌协会神经肿瘤专业委员会副主任委员,兼脑胶质瘤学组组长
中国神经科学学会脑机接口与交互分会副主任委员
中国研究型医院学会精准神经外科委员会副主任委员
中国抗癌协会肿瘤样本整合研究分会常务委员
上海市神经科学学会理事,上海脑科学与类脑研究中心专家组专家
ASNO科学委员会委员
WFNS教育委员会委员
上海市浦东新区政协委员
上海市侨界知识分子联谊会第九届理事会常务理事
声明:脑医汇旗下神外资讯、神介资讯、神内资讯、脑医咨询、AiBrain 所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。






