中国抗癫痫协会神经调控专业委员会,中国医师协会神经调控专业委员会,中华医学会神经外科分会神经生理学组
执笔(排名不分先后)
吴晔(北京大学第一医院),周健(首都医科大学三博脑科医院),关宇光(首都医科大学三博脑科医院),孟凡刚(北京市神经外科研究所、首都医科大学附属天坛医院),季涛云(北京大学第一医院)
通信作者:栾国明,Email:luangm3@163.com;姜玉武 Email:jiangyuwu@bjmu.edu.cn;张建国,Email:zjguo73@126.com
正 文
迷走神经刺激(Vagus nerve stimulation,VNS)是一种神经调控疗法,通过电刺激一侧迷走神经(通常为左侧),调控大脑电活动,因而也被称为“电子药物”[3,4]。VNS作为药物难治性癫痫的添加治疗,是一种有效的控制癫痫发作的手段。迷走神经作为人体分布范围最广、支配效应器官最多的一对颅神经,约80%为上行神经纤维,其上行传入神经环路以脑干孤束核为中继站,投射到去甲肾上腺素能核团-蓝斑系统,进而影响边缘系统、丘脑以及广泛的皮层网络[5,6]。癫痫为脑网络异常性疾病,从网络结构或网络活动的修饰角度改变网络的任何环节,都会影响癫痫的发作和发作形式[7]。VNS通过打破神经元异常同步化电活动网络,影响脑内神经递质系统,影响脑内微环境,诱导和增强大脑可塑性,抑制癫痫发作并改善情绪和认知,其确切机制仍有待进一步阐明[8-10]。
1 制定本共识的目的及共识形成的流程
VNS于1988年开始在临床应用,1997年作为治疗癫痫的辅助手段通过美国食品药品监督管理局(FDA)认证。我国于20世纪90年代开始将VNS应用于药物难治性癫痫患者。2014年完成国产VNS的注册临床试验[11],2016年国产VNS产品开始应用于临床。目前我国已有超过140家医院开展了VNS疗法,近5000例癫痫患者接受了该治疗。
2015年中国医师协会神经内科分会癫痫专委会发布了《迷走神经刺激术治疗癫痫的中国专家共识》[12],该共识对于我国迷走神经刺激术的规范化开展起到了推动作用。5年以来随着VNS治疗在国内更广泛的开展、技术的革新以及对于该治疗方法认识的进一步深入,亟待对共识进行更新,以进一步规范VNS的临床应用。本共识涵盖VNS治疗的整体过程,包括以下方面:①如何选择适合VNS的患者;②VNS植入技术;③VNS患者的长程管理(包括合理的程控,患者的定期随诊,与VNS相关的患者日常生活指导、其他联合治疗以及VNS设备再植入等问题)。
本共识由中国医师协会神经调控专业委员会和中国抗癫痫协会神经调控专业委员会在既往2015年共识的基础上,结合近年来国内外临床应用现况、临床实践及相关文献的更新进行起草,经过专委会成员审阅、讨论并修订而最终形成。
2 如何选择适合 VNS 的患者
2.1 适应证(需满足以下两项)
(1)符合国际抗癫痫联盟2010年发布的药物难治性癫痫的诊断标准[2]。
(2)未发现可治疗的癫痫病因,或针对病因治疗失败。可治疗的病因包括:
①经过合理术前评估适合进行外科手术治疗的结构性病因;
②药物或特殊饮食治疗可控制癫痫发作的代谢性病因,例如:维生素B6治疗吡哆醇依赖性癫痫,生酮饮食治疗I型葡萄糖转运体缺陷所致癫痫;
③通过免疫性治疗可控制癫痫发作的免疫性病因等。
2.2 禁忌证(以下任一项)
(1)双侧迷走神经损伤或切断史;
(2)植入部位存在局部感染;
(3)特异性排异体质,不能耐受异物植入;
(4)全身一般情况差不能耐受手术;
(5)植入部位需微波或短波热疗、严重心脏传导阻滞、严重消化系统疾病、快速进展的危及生命的遗传代谢性疾病以及阻塞性睡眠呼吸暂停等为相对禁忌。体内存在可调压分流管等磁控设备者需要注意其与VNS设备间可能的相互影响。
2.3 需要考虑的其他因素
(1)年龄相关的癫痫综合征:对于某些表现为药物难治性癫痫但具有自限性特点的婴幼儿期及儿童期癫痫综合征,例如儿童良性癫痫伴中央颞区棘波变异型、Doose 综合征等,如患儿年龄已经接近预期的自限年龄,一般不建议 VNS;
(2)家庭因素:需要考虑患者家庭对于癫痫预后及 VNS 疗法是否充分理解,以及患者家庭经济因素等;
(3)婴幼儿患者:虽然目前说明书推荐的年龄下限为 4 岁,但一些真实世界研究和临床实践证实了 VNS 在低龄儿童中应用的安全性[13,14]。目前尚无年龄下限推荐,但对于 1 岁以下的药物难治性癫痫婴儿患者,需要在充分评估病因学、癫痫预后以及其他可能的治疗方法基础上,谨慎权衡;
(4)精神疾病共病:VNS 对抑郁有一定疗效,药物难治性癫痫共患抑郁的患者可以考虑 VNS;
(5)预测疗效的标志物:目前尚缺乏能在 VNS植入前预测其疗效的公认指标。有研究表明患者的心率变异性指标以及基于多模态的脑网络连接度可能与疗效相关[15-18]。
2.4 VNS 手术的术前评估
应由神经内科和/或儿科医师、癫痫外科医师及电生理医师共同参与评估,全面评价患者的病因学等,以充分排除可能存在可针对性治疗的病因以及短期可能自限的年龄依赖性癫痫综合征等。
3 VNS 植入术
3.1 设备
VNS 设备分为体内植入部分和体外部分。体内植入部分包括脉冲发生器和植入式电极导线。一般脉冲发生器安装在左侧锁骨下区,植入电极末端分为 3 个螺旋形的线圈绕在颈动脉鞘内迷走神经上。体外部分包括医生用体外程控仪和患者用控制磁铁,具有远程程控的设备还包括患者用程控仪。
3.2 植入手术
一般选择左侧迷走神经手术,安装 VNS 设备的简要步骤:全麻,仰卧位,头转向右侧,左颈部中下段,左胸锁乳突肌前缘为中点,横切口 3~4 cm,牵开胸锁乳突肌,暴露颈动脉鞘,分离迷走神经长度约 3 cm,将植入电极的 3 个线圈固定于迷走神经干上,负极在头端。切口可选择左锁骨中线下横切口、腋前线或胸壁外侧切口,切开皮肤皮下组织,皮下扩囊袋植入脉冲发生器,将植入电极另一端从颈部切口沿皮下穿到胸部切口与脉冲发生器相连[12]。临床普遍采用上述双切口手术植入 VNS(手术更简便且容易更换电池),也有报道采用颈部单切口植入 VNS[19]。在将脉冲发生器置于皮下囊袋和闭合切口之前,必须进行设备和阻抗测试,以确保 VNS系统正常工作。
4 患者的长程管理
VNS 疗法是长期治疗过程,患者的长程管理尤为重要。早期主要关注癫痫控制、手术并发症、程控参数和不良反应。长期随访重点关注患者的程控方案、药物调整、癫痫长期疗效、情绪和认知功能以及生活质量变化。还包括与 VNS 相关的患者日常生活指导以及 VNS 再植入等问题。
4.1 程控方案
(1)参数设置及调节
可设置的参数包括输出电流、信号频率、脉冲宽度、刺激时间和间歇时间,通过刺激时间和间歇时间可计算出占空比(duty cycle)。参数设置包括脉冲发生器的常规刺激参数设置和磁铁模式的参数设置,通常磁铁的输出电流较脉冲发生器高0.2~0.3 mA,磁铁应用于发作先兆时或发作初期,给予一次额外即刻刺激,以缩短发作持续时间或减轻发作程度。对于具有闭环式心率反馈性 VNS 设备,还需要进行心率检测敏感度和自动刺激阈值等参数的设置。
为避免设备开机叠加手术时分离缠绕刺激迷走神经水肿所产生的不良反应,通常建议在植入VNS 治疗系统后 1 周~2 周开机开始刺激迷走神经。每次程控前,需测试电极阻抗处于正常范围。脉冲发生器的初始参数设置通常如下:输出电流0.2~0.5 mA,信号频率 30 Hz,脉冲宽度 250 μs 或500 μs,刺激时间 30 s,间歇时间 5.0 min。第一阶段程控:如患者可耐受,每 2 周可增加输出电流0.2~0.5 mA,余参数不变,观察癫痫控制效果及耐受性。术后 8~12 周,通常输出电流可调至 1.0~1.5 mA。此后进入第二阶段程控:根据患者发作情况及耐受情况,每 3 个月可调整参数 1 次。调整模式有两种:一种模式为固定占空比,每次上调输出电流 0.1~0.3 mA,直至出现理想的癫痫控制效果或达到患者可以耐受的最大输出电流(一般<3 mA),如果效果仍不佳,再上调占空比;另一种模式为固定输出电流,通过调整刺激及间歇时间而上调占空比(建议<50%),如果仍无效再上调输出电流(表 1)。
表1 VNS 参数设置的建议*
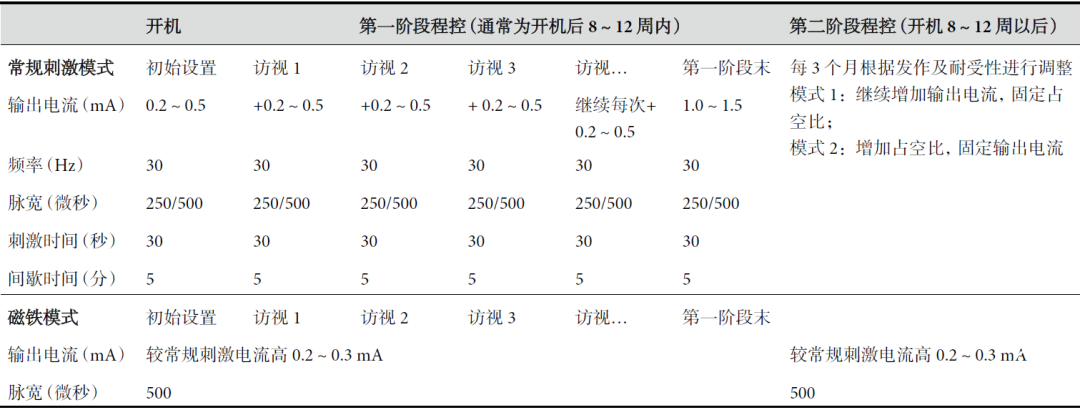
注:*:在实际工作中,可根据患者的疗效和耐受性个体化进行调整
远程程控:远程程控是医生通过互联网技术连接 VNS 设备的医生端和患者端进行音频、视频交流和远程参数调整。一般医生端为电脑及软件,患者端为患者用程控仪、智能手机及 APP。医生通过医生端进行参数设置,患者或其看护者通过患者用程控仪可查看脉冲发生器的开关状态、电池状态、并相应调整刺激参数。远程程控明显降低了患者远程就医的经济负担,也提高了规律程控的依从性[20]。
4.2 规律随访
4.3 VNS 相关日常生活指导
4.4 联合其他治疗
4.5 VNS 设备再植入
5 VNS 疗效
5.1 对癫痫发作的疗效
VNS 应用于临床 30 年来,大量文献和研究证明其抗癫痫疗效确切。对于药物难治性癫痫患者,约55%~65% 的患者癫痫发作可以减少约 50%,约6%~11% 的患者癫痫发作可以得到完全控制[23, 24]。2019 年基于 16 篇临床研究中 1061 例患者的 Meta分析提示,53% 患者发作减少 50% 以上,且随植入时间延长有效率提高,其他研究也支持这一观点[25-27]。一项 347 例儿童及青少年患者的回顾性队列研究表明,12 岁以下儿童 6、12、24 个月的有效率分别为36%、43% 和 50%,无发作率分别为 7.0%、7.8% 和11.3%[14]。除降低发作频率外,VNS 还可能减轻癫痫发作的严重程度和缩短发作持续时间[14, 23]。
目前关于某些特定癫痫综合征和特定病因所致癫痫的疗效多为小样本研究。Lennox Gastaut 综合征(LGS)的有效率为 25%~78%[28],但 VNS 对LGS 中失张力发作的有效率低于胼胝体切开术。一项汇总 68 例 Dravet 综合征患者的 Meta 分析显示 52.9% 的患者癫痫发作减少了 50%[29]。另一篇关于 VNS 治疗癫痫的 Meta 分析:VNS 用于全面性发作,癫痫频率减少 5 7 . 5 %;局灶性发作减少42.5%;其他类型发作减少 53.7%;VNS 用于外伤后癫痫患者,发作频率减少 78.6%;结节硬化癫痫患者癫痫发作频率减少 68.1%[30, 31]。对于遗传性癫痫如 Rett 综合征、Doose 综合征、特发性全面性癫痫的治疗也有小样本报道。对于超难治性癫痫持续状态的治疗,也有应用 VNS 治疗的报道[31-34]。
5.2 癫痫共患病的疗效及其他获益
癫痫的治疗以控制癫痫发作为基本目标,但是癫痫共患病的治疗同样重要。抑郁是癫痫患者常见的共患病,VNS 可能通过缓解患者的抑郁情绪而改善癫痫患者的共患抑郁症状,研究提示 VNS 可使抑郁评分改善 25%~35%,焦虑评分改善 35%,情绪评分改善 25%[35]。因此对于癫痫共患抑郁患者,可推荐使用 VNS 疗法[24,36,37]。在一项队列研究中发现,VNS 治疗可以降低癫痫猝死(Sudden unexpected death in epilepsy,SUDEP)发生率,接受VNS 治疗的患者,SUDEP 率由 5.5‰下降至 2 年后的 1.7‰[38]。另外,一项大样本研究通过医生调查问卷进行患者生活质量调研,结果提示 VNS 植入后 1 年以上的患者 58%~63% 警觉度改善,43%~49% 患者情绪改善,38%~45% 患者语言沟通改善,29%~39% 学校及职业成就提高,29%~39% 记忆改善[39],其他研究也得到类似结论[23, 40]。
6 VNS 的安全性
VNS 植入和治疗总体而言是安全的,临床可能遇到以下不良反应。
6.1 与 VNS 设备植入手术相关的不良反应
VNS 植入部位感染一般发生于术后 1 个月内,可发生于颈部或胸部切口。发生率约为2%,对于轻症的感染可应用抗生素及伤口换药控制,严重的感染可能需要摘除设备[41]。
6.2 与设备相关的不良反应
包括电极导线断裂、脉冲发生器故障、以及脉冲发生器与电极的连接不当等,发生率约为3%[42]。应根据不同原因采用相应的处理措施[43],如需更换,需到正规的癫痫中心进行评估和更换手术。
6.3 与刺激相关的不良反应
VNS 治疗时可因电流刺激引起一过性声音嘶哑、咳嗽等,通常程度轻微能耐受,通常 1~4 周后随着时间推移而减轻[43-45]。在 VNS 植入术中阻抗测试时以及高刺激电流下罕见(0.1%)出现心动过缓[43, 46, 47]。
7 展望
本共识从 VNS 治疗的患者选择、VNS 植入术、患者的长程管理以及 VNS 的疗效和安全性等多方面进行了分析并给出临床指导性建议,以期规范VNS 的临床应用。随着科学技术和临床研究的不断发展、以及临床实践经验的进一步积累,今后的方向包括:设备的进一步优化(包括无创性刺激设备)、程控的进一步便捷化、癫痫疗效的预测指标的探索、对参数设置的进一步优化、个体化治疗的探索、VNS 适应证的拓展和对 VNS 作用机制的基础研究等方面。
致谢 感谢中国抗癫痫协会李世绰创会会长、洪震会长、张慧秘书长、段立嵘主任、慕洁老师对于本共识制定的支持与帮助。
声明 随着科技的进步以及对癫痫认识的不断进步,本共识必然存在局限性,编写组将与时俱进、更新共识;本共识仅供临床医生和有关部门参考应用,但不作为法律依据,应结合临床和患者自身情况具体应用,若应用本共识所产生的不良后果,编写组不负任何法律责任。
全部专家名单(按姓氏拼音排序)
鲍 民 蔡立新 崔志强 方 铁 关宇光 胡 杰
季涛云 姜玉武 李路明 李世绰 李天富 梁树立
林志国 刘宏毅 栾国明 李少一 孟凡刚 欧少武
钱若兵 邱吉庆 单永治 王 军 王 群 王雄飞
王增光 吴 晔 徐纪文 徐淑军 杨卫东 张 凯
张建国 赵国光 周 东 周 健 朱 丹 朱君明
翟 瑄
参考文献
1中华医学会编著 临床诊疗指南·癫痫病分册(2015修订版).北京:人民卫生出版社, 2015.6
2 Kwan P, Arzimanoglou A, Berg AT, et al. Definition of drug resistant epilepsy: consensus proposal by the ad hoc Task Force of the ILAE Commission on Therapeutic Strategies. Epilepsia, 2010, 51(6): 1069-77.
3 Famm K, Litt B, Tracey KJ, et al. Drug discovery: a jump-start for electroceuticals. Nature, 2013, 496(7444): 159-161.
4 Smalley E. The business of brain-computer interfaces. Nat Biotechnol, 2019, 37(9): 978-982.
5 Hachem LD, Wong SM, Ibrahim GM. The vagus afferent network: emerging role in translational connectomics. Neurosurg Focus, 2018, 45(3): E2.
6 Johnson RL, Wilson CG. A review of vagus nerve stimulation as a therapeutic intervention. J Inflamm Res, 2018, 11: 203-213.
7 Spencer SS. Neural networks in human epilepsy: evidence of and implications for treatment. Epilepsia, 2002, 43(3): 219-227.
8 Engineer ND, Riley JR, Seale JD, et al. Reversing pathological neural activity using targeted plasticity. Nature, 2011, 470(7332): 101-104.
9 Cai PY, Bodhit A, Derequito, et al. Vagus nerve stimulation in ischemic stroke: old wine in a new bottle. Front Neurol, 2014, 5: 107.
10张建国, 张凯, 孟凡刚 主编. 迷走神经刺激术, 北京: 人民卫生出 版社, 2019, ISBN 978-7-117-28935-1.
11 孟凡刚, 张凯, 邵晓秋, 等. 国产迷走神经刺激器治疗药物难治性 癫痫的前瞻性多中心随机对照临床试验研究. 中华神经外科杂 志, 2016, 32(9): 913-917.
12 中国医师协会神经内科分会癫专委会. 迷走神经刺激术治疗癫 (癎)的中国专家共识. 中国医师杂志, 2015, 17(7): 967-968.
13 Muthiah N, Zhang J, Remick M, et al. Efficacy of vagus nerve stimulation for drug-resistant epilepsy in children age six and younger. Epilepsy Behav, 2020, 112: 107373.
14 Orosz I, McCormick D, Zamponi N, et al. Vagus nerve stimulation for drug-resistant epilepsy: A European long-term study up to 24 months in 347 children. Epilepsia, 2014, 55(10): 1576-1584.
15 Liu H, Yang Z, Huang L, et al. Heart-rate variability indices as predictors of the response to vagus nerve stimulation in patients with drug-resistant epilepsy. Epilepsia, 2017, 58(6): 1015-1022.
16 Liu HY, Yang Z, Meng FG, et al. Preoperative Heart Rate Variability as Predictors of Vagus Nerve Stimulation Outcome in Patients with Drug-resistant Epilepsy. Sci Rep, 2018, 8(1): 3856.
17 Mithani K, Mikhail M, Morgan BR, et al. Connectomic Profiling Identifies Responders to Vagus Nerve Stimulation. Ann Neurol, 2019, 86(5): 743-753.
18 Workewych AM, Arski ON, Mithani K, et al. Biomarkers of seizure response to vagus nerve stimulation: A scopingreview. Epilepsia, 2020, 61(10): 2069-2085.
19 李超, 马翔宇, 徐硕, 等. 颈部单切口在迷走神经刺激术中的应 用. 中华神经外科杂志, 2017, 33(6): 640-641.
20 Xie H, Ji T, Ma J, et al. Remote programming: A convenient and cost-effective measure of vagus nerve stimulation for children with epilepsy. Epilepsy Res, 2020, 159: 106246.
21 Eggleston KS, Olin BD, Fisher RS. Ictal tachycardia: the head-heart connection. Seizure, 2014, 23(7): 496-505.
22 姜玉武. 儿童癫痫治疗需重视顶层设计和适时合理使用多种治 疗方法. 中华儿科杂志, 2020, 58(11): 867-870.
23 González HFJ, Yengo-Kahn A, Englot DJ. Vagus Nerve Stimulation for the Treatment of Epilepsy. Neurosurg Clin N Am, 2019, 30(2): 219-230.
24 Morris GL 3rd, Gloss D, Buchhalter J, et al. Evidence-based guideline update: vagus nerve stimulation for the treatment of epilepsy: report of the Guideline Development Subcommittee of the American Academy of Neurology. Neurology, 2013, 81(16): 1453-1459.
25 Chrastina J, Novák Z, Zeman T, et al. Single-center long-term results of vagus nerve stimulation for epilepsy: A 10-17 year followup study. Seizure, 2018, 59: 41-47.
26 Kuba R, Brázdil M, Kalina M, et al. Vagus nerve stimulation: longitudinal follow-up of patients treated for 5 years. Seizure, 2009, 18(4): 269-274.
27 Wang HJ, Tan G, Zhu LN, et al. Predictors of seizure reduction outcome after vagus nerve stimulation in drug-resistant epilepsy. Seizure, 2019, 66: 53-60.
28 Kossoff EH, Shields WD. Nonpharmacologic care for patients with Lennox-Gastaut syndrome: ketogenic diets and vagus nerve stimulation. Epilepsia, 2014, 55(Suppl 4): 29-33.
29 Dibué-Adjei M, Fischer I, Steiger HJ, et al. Efficacy of adjunctive vagus nerve stimulation in patients with Dravet syndrome: A metaanalysis of 68 patients. Seizure, 2017, 50: 147-152.
30 Englot DJ, Chang EF, Auguste KI. Vagus nerve stimulation for epilepsy: a meta-analysis of efficacy and predictors of response. J Neurosurg, 2011, 115(6): 1248-1255.
31 Fan PC, Peng SSF, Yen RF, et al. Neuroimaging and electroencephalographic changes after vagus nerve stimulation in a boy with medically intractable myoclonic astatic epilepsy. J Formos Med Assoc, 2014, 113(4): 258-263.
32 Wilfong AA, Schultz RJ. Vagus nerve stimulation for treatment of epilepsy in Rett syndrome. Dev Med Child Neurol, 2006, 48(8): 683-686.
33 Welch WP, Sitwat B, Sogawa Y. Use of Vagus Nerve Stimulator on children with primary generalized epilepsy. J Child Neurol, 2018, 33(7): 449-452.
34 Dibué-Adjei M, Brigo F, Yamamoto T. Vagus nerve stimulation in refractory and super-refractory status epilepticus - A systematicreview. Brain Stimul, 2019, 12(5): 1101-1110.
35 Toffa DH, Touma L, El Meskine T, et al. Learnings from 30 years of reported efficacy and safety of vagus nerve stimulation (VNS) for epilepsy treatment: A critical review. Seizure, 2020, 83: 104-123.
36 Wheless JW, Gienapp AJ, Ryvlin P. Vagus nerve stimulation (VNS) therapy update. Epilepsy Behav, 2018, 88(Suppl): 2-10.
37 Spindler P, Bohlmann K, Straub HB, et al. Effects of vagus nerve stimulation on symptoms of depression in patients with difficultto-treat epilepsy. Seizure, 2019, 69: 77-79.
38 Annegers JF, Coan SP, Hauser WA, et al. Epilepsy, vagal nerve stimulation by the NCP system, all-cause mortality, and sudden, unexpected, unexplained death. Epilepsia, 2000, 41(5): 549-553.
39 Englot DJ, Hassnain KH, Rolston JD, et al. Quality-of-life metrics with vagus nerve stimulation for epilepsy from provider survey data. Epilepsy Behav, 2017, 66: 4-9.
40 Levy ML, Levy KM, Hoff D, et al. Vagus nerve stimulation therapy in patients with autism spectrum disorder and intractable epilepsy: results from the vagus nerve stimulation therapy patient outcome registry. J NeurosurgPediatr, 2010, 5(6): 595-602.
41 Elliott RE, Morsi A, Kalhorn SP, et al. Vagus nerve stimulation in 436 consecutive patients with treatment-resistant epilepsy: long
42 term outcomes and predictors of response. Epilepsy Behav, 2011, 20(1): 57-63. Révész D, Rydenhag B, Ben-Menachem E. Complications and safety of vagus nerve stimulation: 25 years of experience at a single center. J NeurosurgPediatr, 2016, 18(1): 97-104.
43 Ohemeng KK, Parham K. Vagal nerve stimulation: indications, implantation, and outcomes. Otolaryngol Clin North Am, 2020, 53(1): 127-143.
44 Handforth A, DeGiorgio CM, Schachter SC, et al. Vagus nerve stimulation therapy for partial-onset seizures: a randomized activecontrol trial. Neurology, 1998, 51(1): 48-55.
45 Liporace J, Hucko D, Morrow R, et al. Vagal nerve stimulation: adjustments to reduce painful side effects. Neurology, 2001, 57(5): 885-886.
46 Frei MG, Osorio I. Left vagus nerve stimulation with the neurocybernetic prosthesis has complex effects on heart rate and on its variability in humans. Epilepsia, 2001, 42(8): 1007-1116.
47 Binks AP, Paydarfar D, Schachter SC, et al. High strength stimulation of the vagus nerve in awake humans: a lack of cardiorespiratory effects. Respir Physiol, 2001, 127(2-3): 125-133.
癫痫杂志 2021年5月第7卷第3期
点击或扫描上方二维码,查看更多“功能”内容







