IDH突变是胶质瘤最重要的分子特征之一。近年来,围绕IDH突变胶质瘤开展的基础与临床研究发展迅速,WHO中枢神经系统肿瘤分类(第五版)已将IDH突变成人胶质瘤单独列为一种类型。2023年初,Patrick Y. Wen教授带领团队在Neuro-Oncology杂志发表了《IDH突变胶质瘤SNO专家共识:诊断、治疗和未来方向》,该共识被作为2023新年首刊的封面文章,预示IDH突变胶质瘤可能将迎来一场诊疗手段变革。
在众多新型药物治疗手段中,IDH抑制剂靶向治疗的研究进度尤其引人瞩目。近日,一项比较IDH抑制剂Vorasidenib与安慰剂治疗残留或复发性IDH突变2级胶质瘤患者的全球、随机、双盲、3期临床试验——INDIGO研究,宣布达到了主要终点(无进展生存期,PFS)及关键次要终点(至下次干预的时间,TTNI),与安慰剂组的患者相比,Vorasidenib单药治疗组患者的PFS和TTNI均有统计学显著差异且有临床意义的改善。此外,Vorasidenib单药治疗的安全性良好。

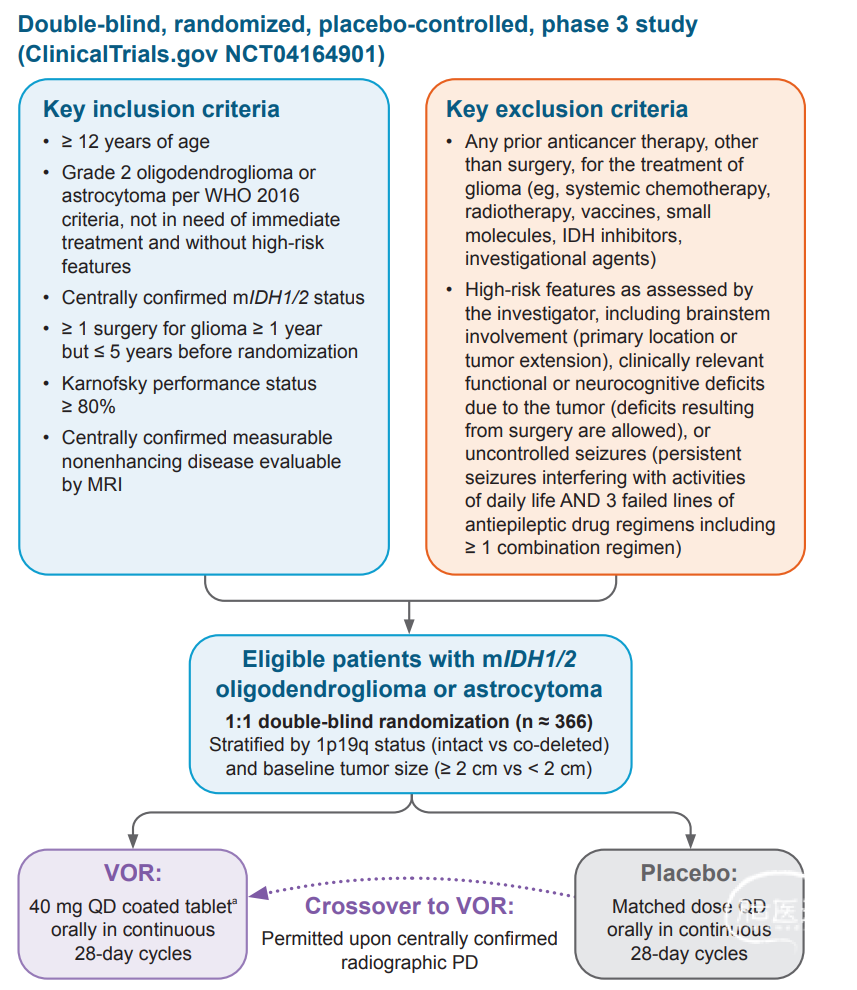
INDIGO研究是近20年来胶质瘤药物治疗领域、化疗药物之外少有的获得成功的大型3期临床研究,其中期分析的积极结果具有里程碑意义,为IDH突变胶质瘤精准治疗注入新动力。该研究中,约366例患者按1:1随机分配接受Vorasidenib(50 mg QD)或匹配的安慰剂治疗,并根据1p19q状态进行分层。主要纳入标准包括:年龄≥12岁;不需要立即治疗且无高危特征的2级少突胶质细胞瘤或星形细胞瘤(根据WHO 2016标准);集中确认mIDH1/2状态;既往≥1年且≤5年内接受过≥1次脑胶质瘤手术,但未接受过其他抗癌治疗;Karnofsky功能状态≥80%;可通过磁共振成像评估集中确认可测量的无强化疾病。根据RANO-LGG标准,经集中确认的影像学进展后,允许从安慰剂组交叉至Vorasidenib组。主要终点是通过独立审核评估的无进展生存期。次要终点包括安全性和耐受性、根据体积评估的肿瘤生长速度、至下一次干预的时间、ORR、总生存期、通过癌症治疗功能评估-脑功能问卷评估的生活质量以及血浆药代动力学。探索性终点包括癫痫发作频率和神经认知功能。
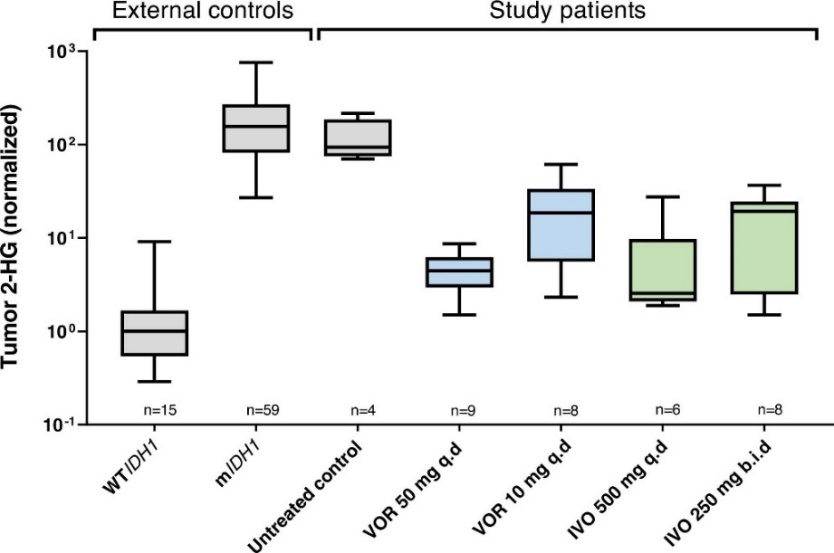
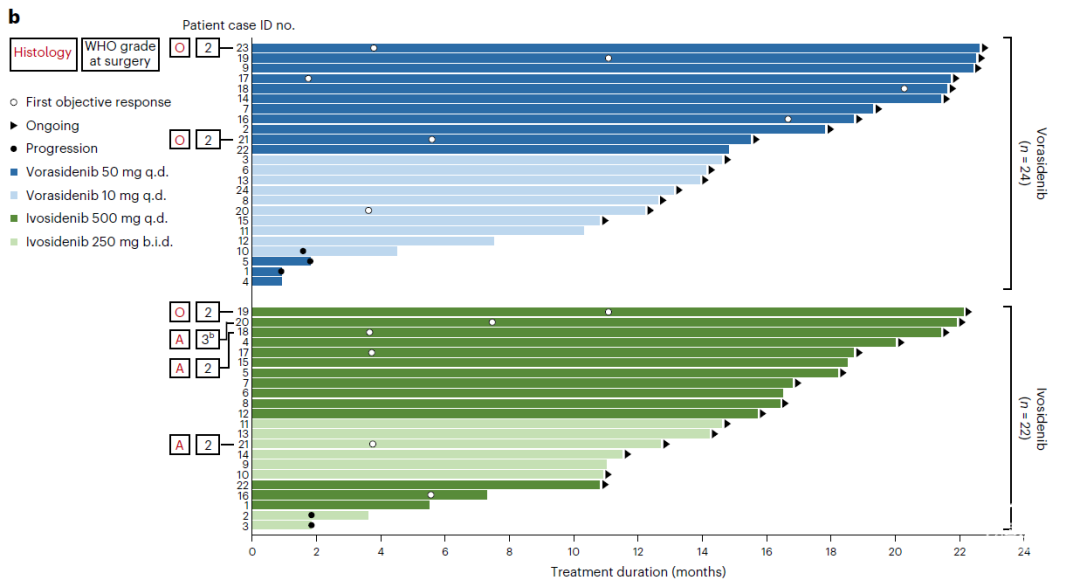
今年2月,Nature Medicine发表了一项Vorasidenib对比另一个IDH1抑制剂艾伏尼布(Ivosidenib)治疗IDH1突变低级别胶质瘤的1期研究。该研究比较了经治患者与未经治疗患者的肿瘤内2-羟戊二酸(2-HG)浓度,从而评估两种药物对2-HG的抑制作用。此外,本研究还比较了两种药物的安全性、耐受性、PK/PD和抗肿瘤活性等。
该研究结果显示,艾伏尼布500 mg qd与Vorasidenib 50 mg治疗IDH1突变低级别胶质瘤,两种药物的肿瘤药物浓度均远高于抑制突变的IDH1酶所需的IC50值,肿瘤2-HG浓度的降低幅度相当,分别降低91.1%与92.6%。
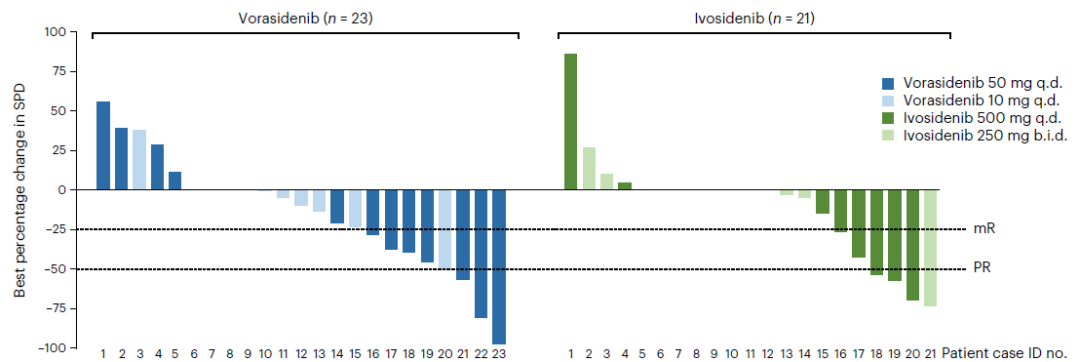
研究者认为,尽管艾伏尼布的血脑屏障渗透性低于Vorasidenib,但由于其血浆药物浓度更高,在肿瘤中同样达到了足够浓度以抑制mIDH酶。可能正因如此,两种药物达到了相似的疗效与安全性。在抗肿瘤活性方面,艾伏尼布与Vorasidenib的客观缓解率(ORR)相近,分别为35.7%与42.9%;治疗持续时间相近,分别为15.1个月与14.3个月;两种药物的中位无进展生存期(PFS)均未达到,数据继续趋于成熟。在安全性方面,两种药物耐受性均良好,未发生与治疗相关的治疗延迟。
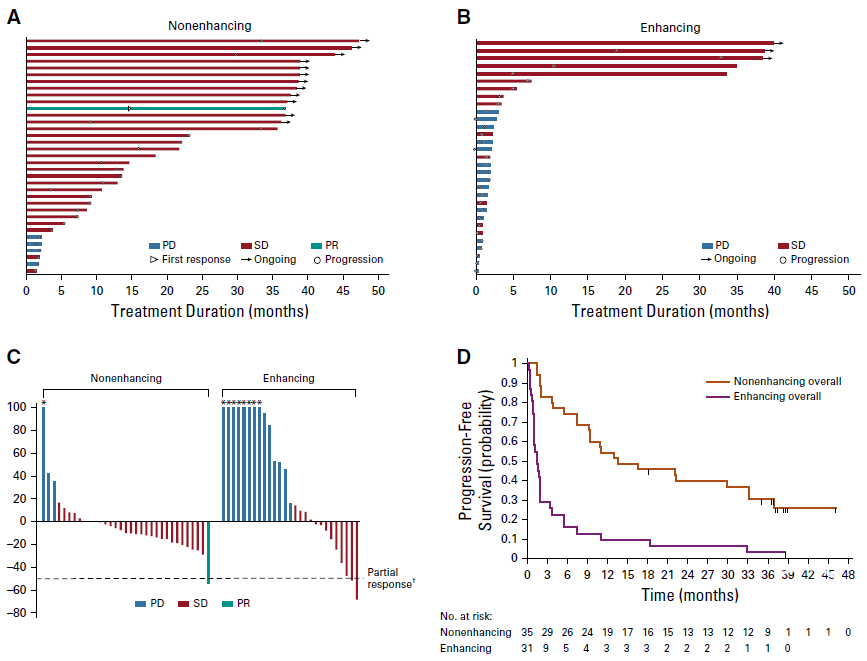
艾伏尼布作为全球首个IDH1抑制剂,早在2020年率先在JCO公布了其治疗IDH1突变晚期胶质瘤的研究数据,在66例mIDH1晚期胶质瘤患者中,艾伏尼布耐受性良好,未见剂量限制毒性报道,未达到最大耐受剂量。3级不良事件发生率为19.7%,其中3%(n=2)被认为与治疗相关。在非强化胶质瘤患者中(n=35),客观缓解率为2.9%,其中1例为部分缓解(PR)。35例非强化胶质瘤患者中30例(85.7%)疾病稳定(SD),31例强化胶质瘤患者中14例(45.2%)病情稳定。非强化和强化胶质瘤组的中位PFS分别为13.6个月(95% CI,9.2~33.2个月)和1.4个月(95% CI,1.0~1.9个月)。在探索性分析中,艾伏尼布降低了非强化肿瘤的体积和生长速率。
此外,今年1月和2月Neuro-Oncology先后发表了另外2个IDH1抑制剂Olutasidenib与DS-1001用于治疗IDH1突变胶质瘤的研究结果。Olutasidenib在复发性或难治性IDH1突变胶质瘤患者中,疾病控制率(客观缓解+疾病稳定)为48%。2例(8%)患者表现出最佳反应为部分缓解,8例(32%)患者的疾病稳定至少4个月。DS-1001用于复发性或进展性IDH1突变型胶质瘤患者,强化组和非强化组的客观缓解率分别为17.1%和33.3%。强化和非强化胶质瘤队列的中位无进展生存期分别为10.4个月(95% CI,6.1~17.7个月)和未达到(95% CI,24.1~未达到)。与研究前的存档样本相比,7个治疗中的脑肿瘤样本的D-2-HG含量显著降低。
随着IDH抑制剂涌现并取得了部分积极研究结果,IDH突变胶质瘤领域将会有越来越多值得探讨的方向,正如本文开篇提到的“IDH突变胶质瘤SNO专家共识”中提及,未来在IDH突变胶质瘤领域,靶向治疗药物的最佳使用时间、手术机会窗试验、基于药效学的治疗优化、新型药物与现有治疗手段的结合、治疗预后因素、进一步改善长生存患者的生活质量等诸多方面,有待临床、药学、护理、基础等多学科团队科研工作者共同携手探索,最终为IDH突变胶质瘤患者带来更长生存与更好生活。
IDH突变胶质瘤现阶段的标准治疗包括手术、化疗和放疗等,然而这些手段通常并非治愈性的,且伴有疾病或治疗相关的长期并发症。此外,疾病复发后的治疗选择仍然相当有限。因此,开发具有良好安全性与更长治疗持续时间的新型治疗手段显得尤为重要。
Servier日前官网宣布了INDIGO研究达到主要及关键次要研究终点的消息,具体研究数据将后续在医学大会上公布,其探索性终点癫痫控制及认知功能改善结果也有待公布。此外,INDIGO研究入排标准的细节还不明晰,这决定了今后药物潜在的适应症,更明晰的入排标准等设计细节的公布同样值得期待。随着研究数据日趋成熟及进一步公布,IDH抑制剂在IDH突变胶质瘤中临床应用的确定性将进一步提升。目前全球已有多个IDH抑制剂开展了治疗IDH突变胶质瘤的临床研究并初步显示出积极疗效与良好安全性,包括艾伏尼布、Vorasidienib、Olutasidenib及DS-1001等。
在未来,IDH抑制剂有望进入临床应用阶段,随之而来的更多科学问题有待进一步探索与回答,包括使用时机与方法、联合治疗、疗效评估等。相信随着探索研究的深入开展,IDH突变胶质瘤的治疗将迈上新台阶,最终为患者带来更长生存与更好生活。
点评专家
吴劲松
复旦大学附属华山医院
医学博士,主任医师
复旦大学教授,复旦大学博士研究生导师,上海市卫生系统优秀学科带头人
复旦大学附属华山医院神经外科副主任
复旦大学神经外科研究所副所长
复旦大学附属华山医院生物样本库主任
国家神经疾病医学中心脑胶质瘤专业组长
复旦大学附属华山医院伦理委员会委员
上海市抗癌协会理事,兼神经肿瘤专业委员会主任委员
中国抗癌协会神经肿瘤专业委员会副主任委员兼脑胶质瘤学组组长
中国神经科学学会脑机接口与交互分会副主任委员
中国抗癌协会肿瘤样本整合研究分会常务委员
上海市神经科学学会理事
上海脑科学与类脑研究中心专家组专家
ASNO科学委员会委员
WFNS教育委员会委员
上海市浦东新区政协委员
民盟复旦枫林分委华山支部主委
民盟复旦大学上海医学院分委会第五届分委会副主委
上海市侨界知识分子联谊会第九届理事会常务理事
参考文献
声明:脑医汇旗下神外资讯、神介资讯、神内资讯、脑医咨询、AiBrain 所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。





