


帕金森病(Parkinson’s disease,PD)是一种常见的神经系统变性疾病。截至目前,药物治疗仍是帕金森病最主要的治疗手段,左旋多巴制剂是治疗PD最有效的药物。然而,长期的左旋多巴治疗可能引起包括运动波动和异动症在内的运动并发症。
脑深部电刺激(deep brain stimulation, DBS)疗法已问世30余年。DBS疗法问世以来改变了数以万计药物治疗无效的PD患者的生活。目前已有大量的临床证据证实(表1),DBS与最佳药物疗法联用相比于最佳药物疗法具有优势。DBS疗法可以显著改善患者“关”期运动症状的严重程度(UPDRS-III量表),改善患者的异动症症状,改善患者的日常生活以及生活质量。
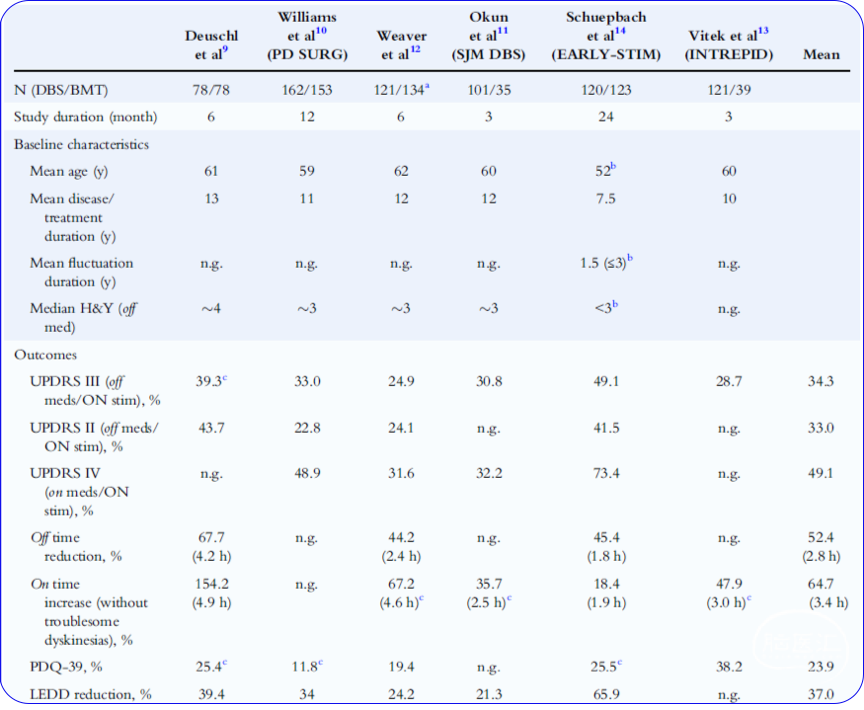
表1 DBS+最佳药物疗法与最佳药物疗法对比RCT研究总结
随着DBS疗法在临床中应用日益广泛,部分的基础研究结果提示[1-3],STN-DBS可能具有神经保护的效果,但目前仍无高等级的临床证据加以证实。
针对DBS疗法是否有助于改善PD患者的临床进程以及结局的问题,Brennan等对于现有的随访期五年以上的DBS治疗PD的研究报道进行了综述。

1、DBS疗法对于PD患者运动症状的长期影响
目前,已有数个观察性长期随访研究报道了STN-DBS治疗PD患者的5年及8-16年[4-8]随访结果。这些研究发现,STN-DBS能够长期有效改善患者的运动症状(图1)。在药物“关”期时,随访时与基线相比,患者平均有30%-50%的症状缓解。STN-DBS对于震颤的改善程度最佳,其次为肌强直,运动迟缓改善程度相对较差。此外,STN-DBS能有效改善患者因药物引起的运动并发症(与基线相比症状缓解60%-70%),同时降低左旋多巴药物日常用量(与基线相比减少40%-60%)。接受GPi-DBS疗法的帕金森病患者的长期随访研究较少。两项5年与8年随访研究的结果提示,GPi-DBS对于这部分患者的运动波动与运动迟缓同样具有长期缓解作用[9,10]。
这些研究均表明,DBS在术后十年仍能有效缓解帕金森病患者的运动症状,同时能够控制因左旋多巴引起的运动并发症。

图1 STN-DBS疗法对于运动症状的长期疗效
(5a:五年期随访,8-11a:8-11年随访)
(结果以随访时与基线相比症状缓解百分比记,
100%为术前基线状态水平,0%为无症状)
2、DBS疗法对于PD患者非运动症状的长期影响
一项五年期长期随访研究发现,STN-DBS可以有效改善包括冲动控制障碍以及情绪波动在内的长期左旋多巴治疗引起的非运动并发症[11]。但接受长期的STN-DBS治疗的患者可能由于多巴胺药物使用量降低而产生情感淡漠的问题。
3、DBS疗法对于PD患者疾病进展的长期影响
目前,已有较多的基础研究提出DBS疗法可能具有神经保护作用[2,3,12,13],具有延缓PD患者疾病进展的潜力。有学者在非人灵长类动物及啮齿动物的毒物诱导PD模型[12,13]中发现STN-DBS治疗数周后,动物的多巴胺能神经元数目显著增加。STN-DBS具有神经保护功能的机制假说包括:破坏病理性基底神经节振荡,降低来自STN的过度活跃的谷氨酸能投射引起的兴奋毒性以及升高大脑来源的神经营养因子。
4、DBS疗法对于PD患者生存时间的影响
研究对三项DBS治疗PD患者生存状态的研究[14-16]结果进行了荟萃分析(图2),结果发现采用STN-DBS治疗的PD患者的生存时间更长(HR,0.60;(95% CI, 0.39–0.92)。这提示,DBS可能对于PD患者具有潜在的延长生存时间的作用。纳入的研究中,DBS组相比于对照组最大的生存获益为7.6个月。DBS疗法带来的生存获益可能是由于DBS能够改善PD患者的运动症状,从而影响患者的整体健康状态(例如改善患者的运动能力,吞咽与呼吸功能);同时,接受DBS疗法的患者与医生的交流更多,更有可能接受理疗,言语治疗等疗法,从而更有助于患者的社会功能的恢复。
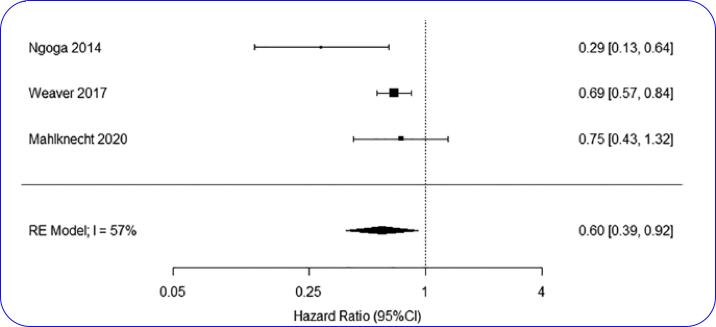
图2 DBS治疗组与对照组患者的生存时间荟萃分析

长期随访结果提示,DBS能够长期有效缓解帕金森病患者的运动症状,同时控制因左旋多巴引起的运动并发症。DBS可能为PD患者带来长期的生存获益。基础研究提示,DBS可能对PD患者具有神经保护作用,但仍需高等级的临床证据加以证实。

Mahlknecht P, Foltynie T, Limousin P, Poewe W. How Does Deep Brain Stimulation Change the Course of Parkinson's Disease? Mov Disord. 2022 Aug;37(8):1581-1592. doi: 10.1002/mds.29052. Epub 2022 May 12. PMID: 35560443; PMCID: PMC9545904.

▼上下滑动阅览▼
[1] Schuepbach WMM, Rau J, Knudsen K, et al. Neurostimulation for Parkinson’s disease with early motor complications[J]. N Engl J Med 2013;368:610–622.
[2] Jakobs M, Lee DJ, Lozano AM. Modifying the progression of Alzheimer’s and Parkinson’s disease with deep brain stimulation[J]. Neuropharmacology 2020;171:107860
[3] Knorr S, Musacchio T, Paulat R, et al. Experimental deep brain stimulation in rodent models of movement disorders[J]. Exp Neurol. 2022;348:113926
[4] Castrioto A, Lozano AM, Poon Y-Y, Lang AE, Fallis M, Moro E. Ten-year outcome of subthalamic stimulation in Parkinson disease: a blinded evaluation[J]. Arch Neurol 2011;68:1550–1556.
[5] Rizzone MG, Fasano A, Daniele A, et al. Long-term outcome of subthalamic nucleus DBS in Parkinson’s disease: from the advanced phase toward the late stage of the disease? [J]. Park Relat Disord 2014;20:376–381
[6] Fasano A, Romito LM, Daniele A, et al. Motor and cognitive outcome in patients with Parkinson’s disease 8 years after subthalamic implants[J]. Brain 2010;133:2664–2676.
[7] Lau B, Meier N, Serra G, et al. Axial symptoms predict mortality in patients with Parkinson disease and subthalamic stimulation[J]. Neurology 2019;92:e2559–e2570.
[8] Zibetti M, Merola A, Rizzi L, et al. Beyond 9 y of continuous subthalamic nucleus deep brain stimulation in Parkinson’s disease[J]. Mov Disord 2011;26:2327–2334.
[9] Lachenmayer ML, Bettschen C, Bernasconi C, et al. Stimulation of the globus pallidus internus in the treatment of Parkinson’s disease:long-term results of a monocentric cohort[J]. Parkinsonism Relat Disord2019;64:118–123.
[10] Tsuboi T, JLMLJ L, Moore K, et al. Long-term clinical outcomes of bilateral GPi deep brain stimulation in advanced Parkinson’s disease: 5 y and beyond[J]. J Neurosurg 2020;9:1–10.
[11] Abbes M, Lhommée E, Thobois S, et al. Subthalamic stimulation and neuropsychiatric symptoms in Parkinson’s disease: results from a long-term follow-up cohort study[J]. J Neurol Neurosurg Psych 2018;89:836–843.
[12] Wallace BA, Ashkan K, Heise CE, et al. Survival of midbrain dopaminergic cells after lesion or deep brain stimulation of the subthalamic nucleus in MPTP-treated monkeys[J]. Brain 2007;130:2129–2145.
[13] Spieles-Engemann AL, Behbehani MM, Collier TJ, et al. Stimulation of the rat subthalamic nucleus is neuroprotective following significant nigral dopamine neuron loss[J]. Neurobiol Dis 2010;39:105–115.
[14] Ngoga D, Mitchell R, Kausar J, Hodson J, Harries A, Pall H. Deep brain stimulation improves survival in severe Parkinson’s disease[J]. J Neurol Neurosurg Psychiatry 2014;85:17–22.
[15] Mahlknecht P, Peball M, Mair K, et al. Has deep brain stimulation changed the very long-term outcome of Parkinson’s disease? A controlled longitudinal study[J]. Mov Disord Clin Pract. 2020;7:782–787.
[16] Weaver FM, Stroupe KT, Smith B, et al. Survival in patients with Parkinson’s disease after deep brain stimulation or medical management[J]. Mov Disord 2017;32:1756–1763.
特约供稿:美敦力 CRMS (Clinical Research and Medical Science) 团队
特别说明:本页面所包含的文章和图片均仅代表作者本人或者该第三方的内容和观点,与美敦力公司的立场无关。本页面所载的内容、信息、评论仅供参考。如任何个人或其他媒体、网站欲转载使用本页面所载文章和图片,请与著作权人联系,并自负法律责任。
点击或扫描上方二维码,查看更多“功能”内容





