本文来源于公众号:宣武脑血运重建CRC
为什么要去评价卒中机制,其实更多的是为了追根溯源,了解致病机制,更好地指导临床诊疗,选择不同的治疗策略。
01
缺血性卒中的发病机制
分类

① A-A栓塞
② 原位血栓形成
③ 血流动力学受损
④ 穿支动脉闭塞
⑤ 混合机制
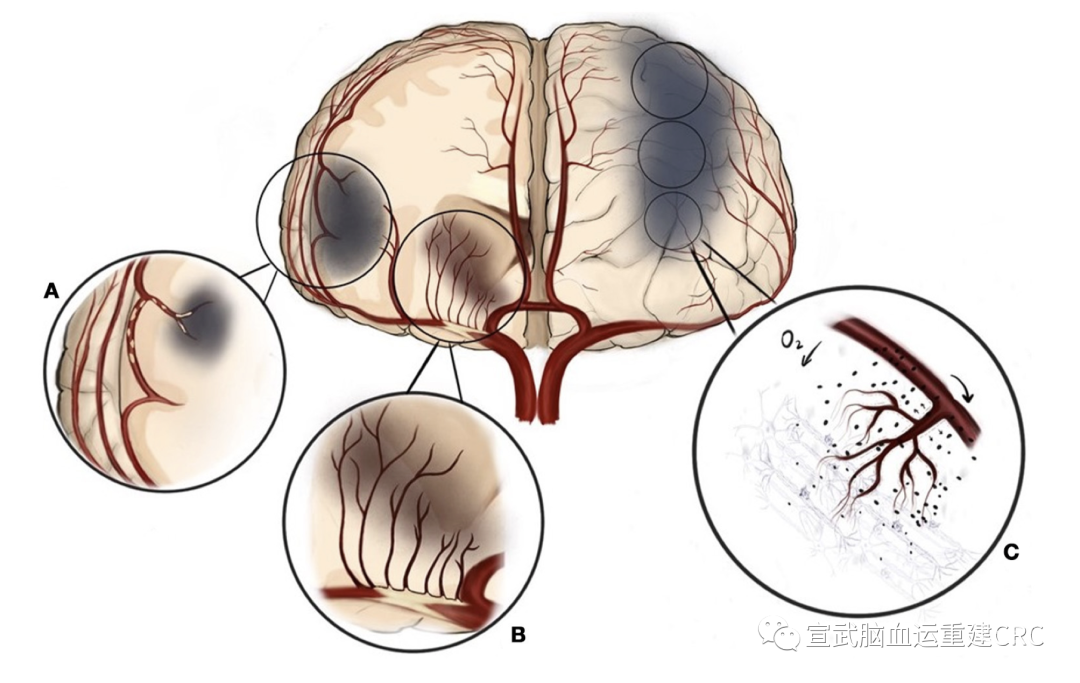
A.动脉-动脉(A-A)栓塞;
B.穿支梗塞;
C.血流动力学障碍。
Tips:
“原位血栓形成”导致梗死灶的产生是基于动脉-动脉栓塞及低灌注两种机制的协同作用。
不同发病机制发生率


通过大量研究报道,我们了解到不同卒中机制的发生率不一样。整体而言,A-A栓塞的发生率最高,约占整个机制的50%,其次是穿支梗塞,最后是血流动力学障碍。原位血栓形成目前提及的比较少,至少在近些年的研究中很少提及,因为它是一个混合机制,主要是由动脉到动脉以及低灌注两种机制协同作用导致。
不同血管的发病机制


不同的血管的发病机制也是不一样的。颈内动脉颅内段(ICA)、大脑中动脉(MCA)最常见的发病机制是A-A栓塞,而基底动脉(BA)最常见的是穿支梗塞。主要因为基底动脉有丰富的穿支血管以及各种吻合,这种区域非常显容易形成穿支梗塞。
卒中机制的影像评价方式

脑组织学评价
MRI(DWI )/CT:鉴别细小的症状性/非症状性梗死,以及新发/陈旧性梗死。
形态学评价
CTA/MRA/DSA——病灶血管位置
TCD——狭窄程度、侧支循环及微栓子信号
结构学评价
HR-MRI/OCT ——可视化管壁情况,识别微小斑块。
颈动脉血管超声
功能学评价
CTP/PWI
ASL
PET-OEF
FFR
脑组织评价是最基本也是最常规的卒中机制评价方式,可以推测不同病变的卒中发病机制。临床中核磁DWI序列检查是最常用的检查手段,如果无法获取DWI,CT也是一个可靠的备选检查方法。
除了脑组织的评价,其他检查对于脑卒中机制的评价也是一个补充诊断方式。形态学评价方法,如CTA、MRA、DSA以及TCD可以检查病灶部位,狭窄程度以及侧支循环情况,增加卒中机制类型的诊断证据,从而提高准确性。然而,目前的临床实践发现单纯的管腔评价会漏诊和误诊许多病变,因此需要结构学和功能学评价补充。
颅内动脉病变结构学评价更多地是用HR-MRI和OCT评价。颅外病变,如颈动脉病变,用血管超声评价。在我们中心,颈动脉颅外病变也较为依赖血管超声评价,无论是在术前评估、术中监测以及术后复查都会运用。
功能学评价的是评价是否血流动力学障碍,目前对于临床的诊疗主要是针对慢闭的明显闭塞的血管以及急性闭塞的血管。在急诊卒中也会看到,CTP和PWI就是比较常规的灌注检查方式。此外,ASL就是无造影剂的一种新型的无创核磁检查方式。PET-OEF 目前是没有在临床应用,但是在科研领域比较火。它主要是分析的氧摄取率,通过氧摄取率去反映组织灌注的情况。我们中心十三五的重要课题——FFR(血流储备分数)评价,通过测量狭窄远近两端的压力比值,反应血流储备的情况,然后反应远端脑组织是否有低灌注状态。
02
卒中机制的评价要点
我们知道了分类,知道了影像检查方式,那么我们如何通过这些影像检查去诊断这些这些机制?
A-A栓塞


A-A栓塞在临床中是最常见的。
影像评价:
DWI:小而分散皮层或皮层下梗死,可伴随分水岭梗死
CTA/MRA/DSA:识别栓子堵塞的血管
PWI/CTP:合并狭窄血管下游低灌注。
Tips:
A-A栓塞需要鉴别心源性和斑块源性导致的梗塞。心源性导致的栓塞,往往梗塞面积会比较大,从侧支的角度来说,心源性因为一般是急性脱落导致的急性闭塞,基本没有侧支循环,从这一点也可以作为一个区分;同时,辅助诊断像心电图、心动超声可以排除是否有心脏方面的疾病。
其次,我们要鉴别医源性栓塞,如血管内治疗,很多患者都有一定的新发梗死,而且绝大多数新发梗死是A-A栓塞。目前认为80%以上的都是A-A栓塞。
穿支梗死


影像评价:
DWI:深部皮质下梗死(腔梗):皮质下15-20mm,不规则
CTA/MRA:斑块部位
HR-MRI:发现轻度狭窄程度的腔梗患者病因(轴位相观察斑块与穿支的关系)
鉴别要点:
小血管玻璃样变性(脑小血管病):皮质下梗死:更小的、岛状缺血灶
Tips:
从CTA或MRA有可能不能发现斑块,但是在高分上可以明显的观察到斑块组织。
脑小血管病形成的梗塞与穿支梗死非常相似,脑小血管病主要的穿支是更偏向于接近皮层下,形态更小,形成岛状血管。
腔梗争议


真正的腔梗诊断面积是小于0.5-1cm,大于1cm的梗死评价为小动脉所致腔梗具有争议。
既往文献中认为的腔梗是穿支血管闭塞形成的腔梗,可能是更细的分支,而脑小血管病所致的梗塞被称为微梗塞。
原位血栓栓塞


形成机制:
斑块不稳定导致急性血栓形成,形成局部栓塞或A-A栓塞。
影像评价:
DWI:流域性梗死(急性+缺乏侧支代偿)
CTA/MRA/DSA:识别闭塞部位
HR-MRI:识别血栓及斑块
鉴别要点:
病史:炎症,自身免疫性疾病及遗传易感性所致的斑块不稳定。
Tips:
斑块破裂或者血栓脱落所致堵塞血管,限制局部的血流,形成非常有特征的流域性梗死。 形态学的血管检查可以明显的看到大动脉的闭塞,在HRMRI检查有可能能识别血栓还是斑块,是否斑块和血栓混合。
原位栓塞还需要区分是否心源性栓子,因为心源性大栓塞也可能是会形成流域性的梗死;同时也要区分炎性疾病,如自身免疫性疾病,也有可能会导致急性的血管闭塞,导致流域性梗死。
血流动力学受损


目前血管内介入治疗中,非常关注的就是血流动力学障碍患者。目前的临床证据支持血流动力学障患者接受血管内治疗能获得最大获益,所以在临床血管内干预中,我们也尽可能筛选血流动力学障碍的患者。
影像评价:
DWI:分水岭梗死
PET:OEF(氧摄取率)/CTP/PWI/ASL:CBF异常反应低灌注区域
FFR:脑血流储备分数:<0.81反应血流动力学受损
Tips:
血流动力学评价从组织学检查就是分析梗塞灶是否位于分水岭区域,从而推测是否有血流动力学障碍。其次是通过一些灌注的检查,可反应脑组织局部是否有低灌注,即血流动力学障碍。我们中心正在探索FFR技术应用于脑血管,通过狭窄远近两端的压力比,反应血流动力学情况。目前我们推算出来一个临界值是0.81,小于0.81反应远端血管存在血流动力学障碍,提示需积极地进行血管内干预。
血流动力学的障碍是它的形成需要一定的过程,大部分病变在形成过程中,并不一定导致血流动力学障碍,这也是为什么我们在评价管腔形态的时候,需要测量它的狭窄程度。现在临床诊疗推荐狭窄程度70%以上的症状性患者需要血管内治疗,其实是推测发生临床症状的重度狭窄患者的病变可能限制血流,导致病变下游的血流动力学障碍,所以这些患者才需要血管内治疗。
形成过程:
代偿期:管壁正性重塑,维持管腔正常直径。
失代偿期:斑块增大向管腔发展,致使管腔狭窄,限制血流通过;
管腔狭窄变细,血流在狭窄处流速增快,壁剪切力增高,使斑块纤维帽破裂风险增高,且血流易形成湍流,导致血栓形成/加速斑块增大。
分水岭梗死模式


大脑分水岭梗死模式
大脑半球的分水岭可分为内分水岭和外分水岭。

小脑分水岭梗死模式
小脑也有分水岭的梗死。目前学者将其分为5种类型。
总结

组织学检查:DWI序列/CT 诊断梗死
定位(形态学评价):DSA/CTA/MRA/TCD检查病变血管
定性(结构学评价):HRMRI/OCT斑块性质、血栓
功能学评价:CTP/PWI/ASL/FFR明确血流动力学情况
03
案例分享
为了更好地将多种影像融合,用于评估卒中机制,举几个案例来进行运用。
案例1:A-A栓塞

上图是一例A-A栓塞患者的脑影像检查。从DWI脑组织影像能够明显发现散在的皮层梗塞。同时从MRA上发现右侧大脑中动脉中度狭窄病变。中度狭窄为什么会导致A-A栓塞呢?通过高分核磁能发现病变有局部的强化斑块,斑块强化反应斑块属于活动期,可能近期发生破溃,炎性浸润严重,所以造影剂能在区域富集,这种热斑块是不稳定的斑块,容易脱落。多种影像检查提供多重证据支持A-A栓塞机制。
案例2: 穿支梗死-MCA

上图的患者是非常典型的穿支梗死。形态学的检查发现左侧大脑中动脉的重度狭窄。从强化的HR-RMI可以看到,其实病变管腔并非很窄,斑块强化明显,且豆纹动脉发出的位置,因此穿支梗死的风险增高。
案例3:穿支梗死-BA

基底动脉(BA)也是穿支梗死的高发部位,BA穿支常见于背侧以及侧面发出,斑块的附着在此区域容易会导致形成导致穿支梗塞。如上图所示,BA右侧和背侧斑块累及所致脑桥右侧梗死。
案例4:内侧分水岭梗死(血流动力学障碍)

上图是典型的内侧分水岭,右侧大脑中动脉是闭塞的。通过形态学检查,定位右侧大脑中动脉。CTP灌注检查能够明显直接证明低灌注情况。
04
总结
在从临床的诊疗中,鉴别不同的卒中机制才能更好地为治疗决策。这一过程需要依赖多种模式的检查方式,定位以及定性明确病变特征和卒中机制,为临床提供强有力的证据和指导。
05
作者简介
罗继昌
首都医科大学宣武医院神经外科,博士研究生在读
学习经历:首都医科大学博士在读,导师焦力群教授
研究方向:脑血管狭窄的基础和临床研究;组建神经血管影像核心实验室,参与AI影像判读的智能研发
科研经历:参与“十三五”国家重点研发计划,北京市及院级课题4项。以一作或共一于Stroke,Cochrane,Frontiers,BMJ open等杂志发表SCI文章10余篇,作为多个杂志审稿编辑,参与3部专著编撰。

更多精彩内容 请关注作者
点击或扫描上方二维码
查看更多“脑血管”内容






