一、 病人基本资料
病史:
患者女性,66岁,以“四肢不自主抖动13年”为主诉入院。于2009年无明显诱因出现:自右上肢向左下肢发展的不自主抖动,运动迟缓,行走拖拽,自行给予美多芭,息宁,恩他卡朋等药物治疗,上述症状改善,2017患者症状逐渐加重,口服药物效果明显减退,逐渐出现剂峰异动,剂末现象,冻结步态。自行调整为美多巴 50mg 一日7-8次,异动仍未改善,2022年就诊于我院行DBS手术评估。
入院后专科查体开期:颈部肌张力高、右侧上下肢肌张力稍高,轮替动作及精细动作能力稍下降,未见明显震颤。关期:患者四肢及颈部肌张力均高,双上肢及下肢可见间歇性有震颤、轮替动作及精细活动能力明显降,右侧为重。患者主要以关期的僵硬和冻结步态为主。在开启的时候患者的僵硬明显改善,冻结步态并在开期有明显的改善。但是在患者的开期,伴有严重的异动症。
左旋多巴冲击实验:
患者主要以关期的僵硬和冻结步态为主。在开期的时候患者的僵硬和冻结步态有明显的改善。但是在患者的开期,伴有严重的异动症。
01
术前视频资料



诊断:
根据中国帕金森病的诊断标准(2016版),患者具有运动迟缓、肌强直、静止性震颤三项核心症状;符合三条支持标准:(1)治疗后在UPDRS-Ⅲ评分改善超过30%,存在明确且显著的开/关期症状波动;(2)出现左旋多巴诱导的异动症。
(3) 具有临床观察到的肢体静止性震颤。不含有小脑性共济失调,额颞叶痴呆或原发性进行性失语,可导致帕金森综合征或疑似与患者症状相关的其他疾病或综合征等绝对排除标准后诊断为帕金森病。
患者特征总结:
患者是以强直为特征发病的PD,在左旋多巴的服用和调整中出现了剂峰型异动和冻结步态,患者在服用小剂量左旋多巴后便会引起异动,严重影响患者的日常行为生活,并且在药物的关期存在多巴胺反应型冻结步态,患者需要服用药物对其进行改善。评估后拟行手术治疗。
01
总体量表


二、手术方案及随访
01
2.1 术前影像与手术计划
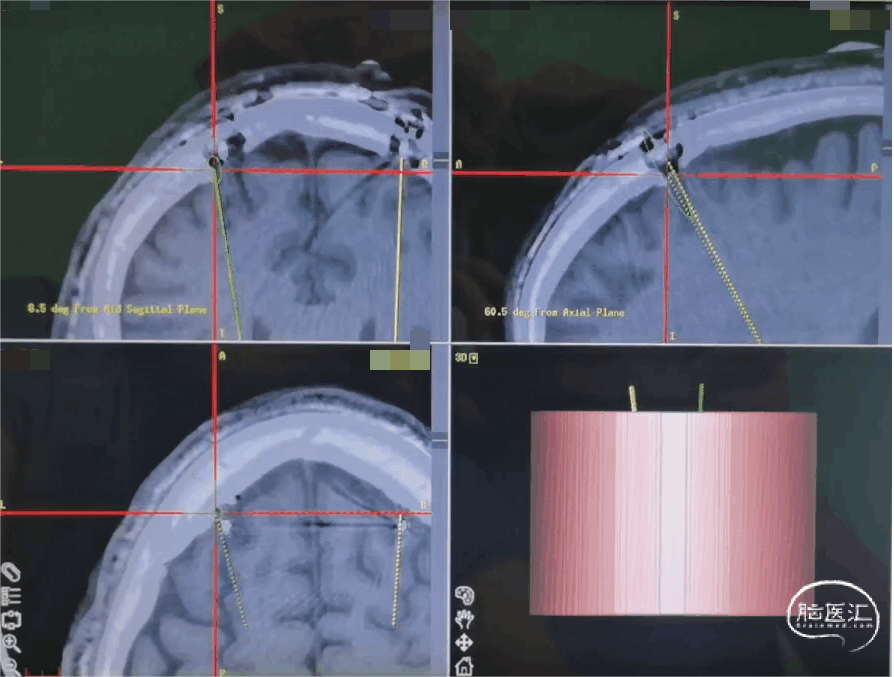
01
2.2 术中电生理检测辅助定位靶点术后靶点验证


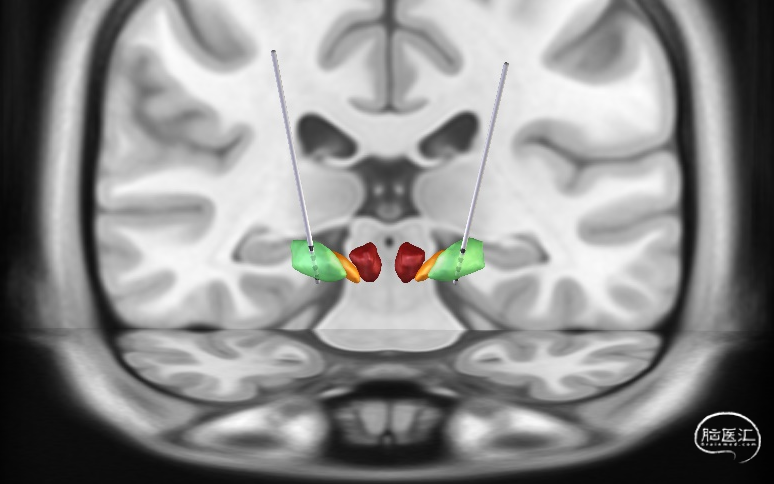
标准化手术流程:完善导航核磁及术前当日导航CT等影像学检查,手术预计划规划手术GPi靶点。计算靶点坐标。双侧选择3387的电极,RC的神经刺激器,术中电生理检测,确定植入核团靶点的精准性。术后对患者进行电极与和核团的重建。位置符合预期。
01
2.3术后开机

在术后一个月对患者进行了开机。通过逐一筛选触点,选取最佳刺激模式,在GPi中可能存在两个不同的位点,在这些位点上,刺激对运动障碍和左旋多巴反应有相反的影响。选择GPi的中间部分,这可能会在改善PD主要症状的同时兼顾改善LID。
01
2.4术后程控随访



术后程控随访:患者未诉特殊不适,患者开机后的药物开期的异动症统一评定量表(UDysRS)改善了69%,冻结步态明显改善,表现为步幅改善,减少了起步冻结的时间与频率,患者生活质量明显改善。
三、讨论
3.1帕金森病相关运动并发症
帕金森病(Parkinsons disease,PD)是一种中老年好发,以静止性震颤、肌强直、运动迟缓、姿势步态障碍为临床特点的神经系统退行性疾病。
目前的药物治疗以“美多芭”为主。但随着服药蜜月期的度过,帕金森病人会出现运动并发症:主要包括症状波动和异动症2种类型。左旋多巴治疗4年以上出现症状波动的概率为 12%~60%,出现异动症(levodopa-induced dyskinesias,LID)的概率为8%~64%。在一项纳入901例中国 PD患者的研究中发现,病程 4~6 年的 PD 患者 LID 患病率为 6.2%,病程大于 11 年的 PD 患者,LID 患病率仅为18.1%。在另一项中国的前瞻性调查研究(n=1558)显示,病程 25~50 年的 PD 患者LID患病率为 13.1%。
随着疾病的进展,患者出现药物疗效明显减退,或并发严重的症状波动或异动症,这时可以考虑手术治疗。手术方法主要有神经核毁损术和DBS,DBS因其相对无创、安全和可调控性而成为目前的主要手术选择。
3.2异动症合并冻结步态
PD患者发生运动并发症与多种因素相关,主要有病程长,大剂量服用左旋多巴,左旋多巴日剂量≥400 mg 或累积剂量>609.75g时,运动并发症发生率明显升高,更易出现异动症。40 岁前发病,几乎100% 的患者会发生运动并发症,而发病年龄在 40~59岁、60~69岁和70岁以后,运动并发症发生率分别为 50%、25% 和 16%,提示发病年龄越早,运动并发症发生率越高,可能年轻患者多巴胺释放类型及多巴胺能去神经支配等变化更易诱发运动并发症。
LID的产生机制与乙酰胆碱能系统和多巴胺能系统的失衡相关。
由于PD患者DA神经元的丢失导致胆碱能中间神经元的活性异常升高,这一结果导致纹状体信号传导的增强而减弱正常运动。此外由于PD病情进展,中脑黑质多巴胺能神经元变性以及进行性丢失,脑内多巴胺含量以及储存能力的降低,对外源性非生理性给药的左旋多巴缓冲能力的下降,外源性左旋多巴对左旋多巴受体的“脉冲式”刺激逐渐增强,导致纹状体内直接通路及间接通路的功能失衡,同时多种非多巴胺能通路的异常活动,共同引发皮质-基底节环路神经元放电模式、代谢物质等变化,从而诱发运动并发症。异动症作为帕金森患者非常高发的运动并发症,又常常合并其他类型的运动障碍。
其中冻结合并异动的病人可占异动病人的9%左右。冻结步态(gait of freezing,FOG)的发生机制比较复杂,目尚未完全阐明,冻结步态可能与桥状网状结构、中脑运动区、基底神经节和额叶皮质区。认知和边缘皮质区域有关。临床分析FOG时需首先考虑FOG与多巴胺能药物的疗效是否相关以及有无其他因素影响步态障碍。
治疗策略则是针对运动波动,减少关期。
3.3手术靶点选择
在帕金森病治疗中,异动症探究、的治疗和控制经历了非常多的阶段,开始的研究聚焦于黑质致密部(SNPC)多巴胺能神经元的改变影响了直接和间接通路的输出,由于GPi核团放电率的增加减低影响到了丘脑皮质的运动投射。最终导致了异常或过度的运动。
但GPi神经元放电频率会导致运动障碍和减少苍白球输出会恶化LID,这明显是与GPi-DBS和苍白球切开术的临床结果相悖。目前更多的研究聚焦于左旋多巴会导致异常的活动模式等假说。但从长期的临床结果随访来看,DBS针对LID可以达到较为理想的效果,STN作为经典核团,在左旋多巴剂量减少幅度更大,GPi-DBS 可能发挥直接和独立的抗运动障碍作用。
异动症与巴胺能神经元变性,病情进展,左旋多巴的剂量和使用时间等多种因素相关,异动症的高发,并容易合并冻结等其他运动并发症,如果仅仅靶向异动症的控制,那么类似于冻结步态等其他运动并发症的治疗可能会被忽略。
因此针对本例患者,选择GPi-DBS可能通过DBS改善左旋多巴敏感的冻结步态症状,又可以在缓解LID同时也能扩大多巴胺能药物的治疗窗口,对于其异动症和冻结步态的控制都有较大的益处。
3.4 小结
大部分PD患者随病情的进展均会经历各种不同的运动障碍,多类型的运动障碍严重影响患者的生活质量。
尽管DBS对异动症的控制机理经过不同假说甚至有相悖的理论,但临床结果的随访证明了其的有意作用,其中机理仍有待研究。
不同分类LID与FOG的产生机制不同,处理也不尽相同,因对其进行分类研究。对于药物反应型的关期冻结步态的患者,若合并LID时,GPi-DBS可能是较好的选择。
参考文献
[1] 陈生弟, 蒋天放. 应重视帕金森病早期诊断和运动并发症的防治[J]. 中国现代神经疾病杂志, 2013(7):4.
[2] Zhang Z X , Chen H , Chen S D , et al. Chinese culture permeation in the treatment of Parkinson disease: a cross-sectional study in four regions of China[J]. Bmc Res Notes, 2014, 7(1):65-65.
[3] Prevalence of wearing-off and dyskinesia among the patients with Parkinson's disease on levodopa therapy: a multi-center registry survey in mainland China.[J]. Translational Neurodegeneration,3,1(2014-12-05), 2014, 3(1):26.
[4]中华医学会神经病学分会帕金森病及运动障碍学组, 中国医师协会神经内科医师分会帕金森病及运动障碍学组. 中国帕金森病治疗指南(第四版)[J]. 中华神经科杂志, 2020, 53(12):14.
[5] Ku S , Glass G A . Age of Parkinson's disease onset as a predictor for the development of dyskinesia[J]. Movement Disorders, 2010, 25(9).
专家介绍

姜磊
新疆医科大学第一附属医院神经外四科主任
主任医师,副教授,硕士研究生导师
中国人体健康科技促进会神经调控与功能修复专业委员会副主委
中国人体健康科技促进会神经脊柱和疼痛专业委员会常委
中国医师协会周围神经专业委员会委员
中国研究型医院学会神经再生与修复专业委员会脑认知与神经调控学组委员
中国神经修复专业委员会青年委员
中国医师协会神经调控专业委员会西北区域工作委员会委员
主要研究方向:1难治性癫痫、继发性癫痫等;2疼痛:三叉神经痛、舌咽神经痛、癌痛、残肢痛等;3面肌痉挛、帕金森病、肌张力障碍(特发性震颤,书写痉挛,痉挛性斜颈,梅杰综合征)、冻结步态等; 4精神类疾病的外科治疗(强迫症、抑郁症,药物成瘾等);5干细胞应用研究(脑卒中后遗症、脑退行性疾病等)。
以第一作者通讯作者发表学术论文20余篇,主持课题项目4项,省部级项目2项,参与课题10项,国自然1项,区自然6项

冯兆海
新疆医科大学第一附属医院神经外科功能神经外科
副主任医师,硕士研究生导师
中国人体健康科技促进会神经调控与功能修复专委会
会员
中华医学会神经外科分会会员
中国抗癫痫协会会员
新疆医学会神经外科外科分会会员
从事功能性神经系统疾病的诊治工作,尤其擅长运动
障碍性疾病的神经调控疗法。
1
点击或扫描上方二维码,查看更多“功能”内容






