
撰稿 | AiBrain 内容团队 严贵忠
排版 | AiBrain 编辑团队

动物可以很容易地发起各种行为,包括喂养、求爱和照顾后代;然而,进入睡眠并不是自主性活动。动物不断地经历延长清醒时间的驱动力和恢复睡眠的需要之间的博弈。这种相互作用过程,以及睡眠发生的丰富的心理过程,引发了人们对睡眠研究的兴趣。在过去的十年中,关键的技术进步使特定神经元群体的监测(钙成像)和调节(光遗传学和化学遗传学)促进了对清醒、NREMS和REMS启动和维持的神经基础及其功能的理解。这篇综述详细描述了当前对睡眠-觉醒回路的理解,提出了睡眠启动的去唤醒模型,并强调了争议和未回答的问题。


觉醒包括一系列生理和认知过程,是动物与环境互动并对其环境做出反应的基础。最初假设觉醒是由位于脑干内的上升“网状激活系统”驱动的,现在认识的觉醒是由分布在整个大脑的不同神经元群驱动的,它们参与调节各种行为(以下称为“觉醒系统”)。这些觉醒系统通常广泛地投射,并通过快速作用的神经递质和缓慢作用的神经调质起作用。觉醒系统通过几个并发过程生成觉醒状态。它们刺激皮层和丘脑皮层回路,在没有信号输入的情况下,这些回路默认为NREM的特征缓慢(<1hz)或δ(1-4Hz)振荡。觉醒系统还作用于神经元、环路和神经网络,以调节兴奋性、计算和信息流,以支持觉醒状态过程和行为。此外,觉醒系统抑制促进睡眠的神经元,阻止睡眠开始。下面将回顾产生和维持觉醒的主要系统,并讨论这些系统如何调节觉醒和优化觉醒行为。

外侧下丘脑(LH)是一个与觉醒产生和维持有关的关键大脑结构。下丘脑泌素/食欲素(Hcrt)神经元是第一个与睡眠-觉醒调节有关的LH亚群,它们的缺失与发作性睡病有关,发作性睡病是一种以慢性白天嗜睡和REM失调为特征的疾病。在群体水平上,LHHcrt神经元在清醒状态下活跃,在NREM期间活动减弱,在REM期间几乎失活。光遗传和化学遗传学激活LHHcrt神经元可诱导并维持清醒,而抑制则促进NREM。LH性神经元是异质的,除了Hcrt神经元外,其他谷氨酸(Glu)和γ-氨基丁酸(GABA)细胞群对清醒产生和维持同样至关重要,抑制它们促进睡眠。
LH的大部分兴奋性和抑制性输入促进觉醒,包括来自内侧隔核(MS)、伏隔核(NAc)、下丘脑室旁核(PVN)、腹侧被盖区(VTA)和中缝背核(DR),突出了LH微环路的复杂性以及兴奋性和去抑制机制的参与。此外,一些输入激活LH的wake-on/REM-on神经元,而另一些则激活wake-on/REM-off神经元。LHHcrt神经元可以通过投射到蓝斑(LC)和丘脑室旁核(PVT)来控制清醒。LHGABA神经元可以通过投射到脑干、丘脑和视前区(POA)来促进清醒。非Hcrt谷氨酸能神经元的投射靶点以及觉醒调节中不同促醒LH亚群之间的关系仍未解决。
位于结节乳头核(TMN)内的组胺能(HA)神经元长期以来一直被认为在清醒维持中起着核心作用,因为抗组胺药物会促进嗜睡。此外,TMNHA神经元只在清醒时激活,并与几个睡眠-觉醒调节核团相互连接。然而,光遗传学和化学遗传学的操作未能一致地证明组胺对诱导清醒是必要和充分的。TMNHA神经元可能由于其自身调节机制而成为一个具有挑战性的化学和光遗传靶点。另外,TMNHA神经元在促进觉醒方面可能有更微妙的作用,即抑制类似NREM的皮层振荡和微调皮层网络活动以支持清醒状态。有趣的是,在发作性睡病患者和Hcrt敲除小鼠中,组胺神经元的数量增加了;这种增加是否补偿了由Hcrt神经元损失引起的觉醒信号的减少,仍有待研究。

大多数基底前脑(BF)神经元是GABA能的,而一小部分神经元表达乙酰胆碱(ACh)或谷氨酸。BF由几个在功能、输入和输出上不同的脑核组成。大部分BF神经元在清醒期和REM期都是最活跃的,而一小部分在REM期或NREM期是最活跃的。总的来说,BF在皮层激活中起主要作用,损伤它会导致以慢脑电图振荡为主的昏迷状态。BFACh神经元在清醒状态下抑制皮层同步和Delta活动,而皮层投射的表达parvalbumin(PV+)BFGABA神经元促进皮层觉醒。此外,BF被假设为介导臂旁核(PBN)和蓝斑前区神经元的皮质唤醒效应。最近,腹侧苍白球的GABA能神经元已被证明可以通过解除VTADA神经元的抑制来有效地促进觉醒。未来的研究将使用精确的区域、环路和细胞类型特定的研究,这将极大地有助于理解睡眠-觉醒调节中的精确BF功能。

VTA包含大量多巴胺(DA)神经元群,以及谷氨酸能和GABA能神经元。VTADA神经元支配纹状体、BF、杏仁核、LH和皮层,并参与各种认知过程。DA信号改变神经元的兴奋性,并影响目标神经元对输入作出反应的可能性。作用于DA能系统的兴奋剂能有效地促进清醒,而DA消耗可能会导致神经元兴奋性的广泛改变,从而抑制清醒。在人群水平上,VTADA、VTAglut和VTAGABA神经元主要在清醒和REM期间活跃,而在NREM期间活动减弱。对VTADA和VTAglut神经元的光遗传和化学遗传刺激诱导并保持清醒,而它们的化学遗传抑制促进NREM,即使是在显著的刺激下,如潜在的配偶、美味的食物和捕食者。VTADA神经元也会在行为觉醒中产生超节律,而消融VTADA神经元会损害动物调节其活动期时间以适应环境变化的能力。VTAGABA介导的VTADA神经元抑制被认为可以防止由于过度DA释放而导致的活跃期过度觉醒。的确,损伤VTAGABA神经元会产生类似躁狂的状态,并长期抑制睡眠,特别是在活动期。VTADA神经元的活动受吻内侧被盖核和VPGABA神经元的调节,通过VPGABA神经元解除VTADA神经元的抑制促进觉醒。VTA神经元可以通过投射到LH和NAc来控制觉醒状态的转变。DA激活表达D1、促进觉醒的NAc神经元,抑制促NREM、促进表达D2的NAc神经元。反过来,NAcD1神经元通过对VTA和LH的投射来控制觉醒,突出了清醒维持中反馈循环的参与。

长期以来,LC一直被认为是主要的觉醒促进系统,通过广泛的投射使大脑和自主神经系统快速激活。LC主要由去甲肾上腺素能(NA)的wake-on/REM-off神经元组成。LCNA神经元的活动与觉醒水平密切相关(尽管它不是清醒状态所必需的),并能诱导睡眠到清醒的转变,维持清醒状态并促进皮层激活。LCNA神经元投射到脊髓运动神经元和其他运动中心,以促进清醒时的运动活动。LCNA神经元介导LHHcrt神经元对觉醒的影响,也涉及从睡眠中感官唤起的觉醒。有趣的是,最近的研究结果表明,即使在NREM期间,LC轴突末梢释放的NA也可以通过调节体感丘脑和mPFC神经元来控制纺锤波并促进感觉警觉和微觉醒。此外,LCNA神经元可通过同时激活促醒和抑制促眠腹外侧视前核(VLPO)神经元来促进觉醒。

DR是大脑中神经调节的另一个主要来源,包含谷氨酸能、GABA能、5-HT能和DA能多种神经元类型。尽管DR参与觉醒调节已被认识很久,但其细胞和功能的多样性阻碍了揭示其精确的功能。DRDA神经元被认为具有觉醒促进作用,其消融或化学抑制可以抑制清醒并促进NREM。DR 5-HT神经元在清醒期活跃;然而,刺激它们可以诱导清醒或NREM,可能是通过激活不同的下游靶点或信号通路。DRGABA神经元最近已被证明通过与LHGABA神经元的去抑制相互作用来促进觉醒。进一步对功能不同的DR亚群进行环路特异性解剖,将揭示它们在睡眠-觉醒调节中的精确功能。

丘脑由不同的亚核组成,在清醒和睡眠时对皮层振荡施加强大的控制。在清醒状态下,丘脑皮层神经元接收来自觉醒神经元的兴奋性输入,包括LCNA和LHHcrt神经元。清醒时丘脑皮层神经元的去极化诱导了快速的皮层振荡,这有利于清醒相关的处理。几个中线丘脑亚群对于觉醒的产生既必要又充分,包括背侧、中央和腹内侧丘脑内的亚群(DMT、CMT和VMT)。大多数DMT calretinin阳性(CR+),VMT calbatin -1阳性(Calb1+)和CMT神经元在觉醒开始前都会增加放电速率,这表明它们在觉醒诱导中起作用。光遗传激活DMTCR+、PVTglut、VMTCalb1+和CMT神经元启动清醒,而光遗传抑制DMT和VMT神经元促进NREM。化学遗传学证据表明,PVTglut神经元的活动对于活跃期的持续清醒和抑制清醒期NREM样皮层活动至关重要。丘脑中线投射到皮质、NAc和终纹床核(BNST)的环路对促进觉醒的起始和维持也有作用。

PBN是感觉内脏信息的中继节点:它整合了关于呼吸、疼痛、温度、触觉和味觉的输入,被认为能够自适应地调节觉醒和皮层唤醒,以适应生理需求。PBN与觉醒的产生密切相关,因为它的损伤产生了类似昏迷的状态。类似地,PBN或邻近的脑桥臂被盖核(PPT)神经元的化学抑制可抑制清醒。相反,PBN神经元不同亚群的光遗传和化学遗传激活促进觉醒,并且PBN神经元在面对高碳酸血症时介导觉醒。PBN神经元通过向BF、外侧视前区(LPO)和LH区域的轴突投射来控制觉醒。然而,PBN在睡眠-觉醒状态和生理需求方面的活动模式有待定性。
总之,清醒可以被定义为一组过程和行为,支持一个有机体与环境相互作用的能力,并根据他们的动机采取行动。这组过程在一定程度上不同于定义睡眠的过程。分布式觉醒系统可以协同工作,也可以独立工作,它可以对抗皮层的默认同步状态,抑制促进睡眠的神经元的活动,并使与清醒状态相关的处理所需的大脑动力学成为可能。

△上下滑动查看△

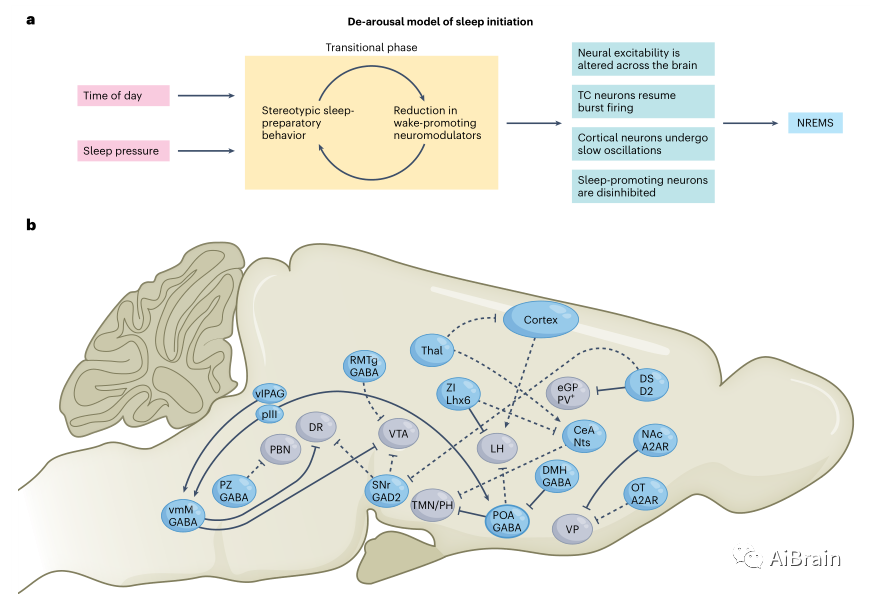
虽然觉醒系统可以暂时抑制睡眠,但睡眠驱动力不可避免地会战胜保持清醒的驱动力。生物体是如何从清醒状态过渡到睡眠状态的?各种概念模型,包括睡眠-觉醒调节的双过程模型和触发器开关模型描述了这一过程。然而,解释在一分钟到一秒的时间尺度上发生的无数变化的精确机制仍然是一个未知领域。在睡眠开始之前,动物会进行一系列刻板的行为,包括准备睡觉的空间和与卫生相关的行为(如梳洗)。现在,越来越多的证据支持这一假设,即睡前是促进生理和行为平静的过渡阶段,促进从清醒到睡眠的过渡。因此提出,重复的睡前行为会逐渐降低对外部环境的警惕性,并降低觉醒神经调节剂的强度。这种神经调节张力的降低导致皮层和丘脑皮层回路从兴奋中释放,睡眠促进神经元从抑制中释放,并过渡到睡眠。

成年哺乳动物从清醒状态过渡到NREM状态。NREM是由清醒系统的抑制、促进睡眠的神经元的激活和皮层慢波的传播引起的。NREM具有多种特征,并需要在转录、细胞、激素、振荡和神经元网络水平上发生恢复现象。1930年,von Economo发现下丘脑前区对睡眠至关重要,20世纪90年代末,第一个睡眠活动神经元种群在下丘脑前视前区(VLPO)的腹外侧区域被发现。十多年来,POA一直被认为是主要的睡眠促进中心。近年来,已经识别出大脑中促进NREM和皮层振荡的多个亚群。下面详细介绍了最近对NREM调节环路的研究,并强调了一些悬而未决的问题。

在初步识别睡眠促进神经元后,随后的病变、药理学操作和电生理记录表明POA在NREM启动和维持中起着核心作用。NREM是由不同POAGABA能亚群的光遗传或化学遗传激活促进的,包括TMN投射的POAGABA神经元,VLPO和LPO galanin(gal)神经元,POACRF神经元和LPO/中央视前区(MnPO)GABA神经元。NREM也可以通过抑制或消融这些亚群来抑制。明显地,大多数POA亚群的激活或抑制也能改变体温;由于体温调节与睡眠调节交叉,通过实验操作解析它们之间的关系还存在一定的挑战性。
POA亚核与许多睡眠-觉醒调节核双向连接。VLPO中LHGABA和LCNA终端的激活分别通过抑制促眠神经元和激活促醒神经元来促进NREM的快速觉醒。相反,从背内侧下丘脑(DMH)神经元输入到POA的GABA/甘氨酸能(gly)促进了NREM。POA含有反应睡眠需要的神经元,最近光遗传调节表达谷氨酸脱羧酶2 (GAD2)的LPO神经元(GABA能亚群)表明这些神经元在睡眠压力积累中起作用。谷氨酸输入已被发现可调节LPOGABA神经元的活动,稳定其促眠作用,但这些输入的来源仍未确定。有趣的是,最近的一项研究发现,中脑动眼神经周(pIII)/导水管周围灰质前(PAG)中的谷氨酸能亚群可以通过投射到POA和腹侧延髓促进NREM。这些NREM促进神经元表达降钙素基因相关肽α,对NREM既必要又充分。这些神经元是否确实稳定了LPOGABA神经元仍未确定。VLPOGABA神经元向TMN和其他几个觉醒系统发送抑制投射,并可能通过它们的同时抑制来控制睡眠启动。总之,POA是NREM调节的核心。然而,由于它是高度异质的,并且包含许多调节不同行为的神经元,包括温度调节,需要精细的工具来解析功能重要的POA亚群。
表达LIM同源结构域因子6(Lhx6)的未定带(ZI) GABA能神经元亚群也参与了NREM的调控。这些神经元被睡眠压力激活,它们的化学遗传激活促进了NREM和REM,而它们的消融或化学遗传抑制抑制了睡眠。ZIGABA/Lhx6神经元双向连接到多个睡眠-觉醒系统,包括LH、VTA、腹侧导水管周围灰质区(vlPAG)和杏仁核中央核(CeA)。

皮层神经元的不同亚群涉及NREMS慢振荡和δ波,以及NREM的维持。
皮层表达一氧化氮合酶神经元、第5层皮层神经元和海马齿状回的颗粒细胞似乎调节慢波活动(SWA, 0.5-4 Hz)、NREM持续时间和睡眠剥夺的稳态反应。皮层表达生长抑素神经元的化学活化增加了NREM SWA和NREM持续时间,而它们的抑制抑制了NREM SWA而不改变NREM持续时间。相反,皮质GABA/PV神经元的化学活化减少了SWA,但增加了NREM持续时间。皮层神经元不同亚群的活动也与慢振荡和纺锤波相关。研究表明,第5层皮层神经元通过投射到LH和丘脑来调节睡眠缺失的稳态反应;然而,这一假设仍有待验证。综上所述,皮层神经元不仅控制NREM期间的局部振荡,而且参与了NREM维持的过程。

在NREM期间,丘脑在驱动皮层振荡中起着重要作用,包括δ波和纺锤波。这些主要由丘脑网状核(TRN)输入到丘脑皮层神经元,丘脑皮层和皮质丘脑神经元之间的双向通信以及皮层对TRN输入进行调节。最近的证据也表明TRNGABA和丘脑后谷氨酸和神经紧张素表达(Thalglut/Nts)神经元在维持NREM中起作用。光遗传激活TRNGABA神经元,以及TRN中的胆碱能末端,促进NREM。虽然PPT中的胆碱能神经元,可能还有BF,投射到TRN,但它们对维持NREM的必要性尚不清楚。一些后侧Thalglut/Nts神经元是睡眠活化的,并投射到促进NREM的CeANts神经元。Thalglut/Nts神经元的光遗传激活和抑制分别促进和抑制NREM。

基底神经节核与许多觉醒系统双向连接,并对丘脑、脑干和下丘脑活动施加强有力的控制。越来越多的证据表明,在背侧纹状体(DS)、NAc核心和嗅结节(OT)中表达腺苷A2A受体(A2AR)-/DA型D2受体(D2)的神经元参与了NREM的发生。光遗传和化学遗传激活DSD2, NAcA2AR和OTA2AR神经元促进NREM,而抑制DSD2和NAcA2AR神经元抑制了NREM。腺苷是A2A受体的激动剂,长期以来一直被认为是一种稳态效应因子,可能作用于NAcA2AR神经元以促进睡眠。NAcA2AR神经元通过抑制投射到VP来促进NREM,而DSD2神经元通过抑制投射到苍白球外侧的PV+神经元来促进NREM。然而,纹状体A2AR/D2神经元在睡眠-觉醒状态下的生理活动模式尚不清楚。表达生长抑素的BFGABA神经元亚群向觉醒促进BF亚群提供了强有力的抑制输入,是促进NREM的。
另一个涉及NREM调节的基底神经节核是黑质网部(SNr)。内侧SNrGAD2(可能还有VTAGAD2)神经元是促进NREM的,它们的光遗传激活和抑制分别促进和抑制NREM。SNrGAD2神经元受下丘脑、DS和中脑的支配,并将侧支轴突投射到几个觉醒系统,包括VTA、LC、DR和运动丘脑。最近的另一项研究表明,外侧而非内侧SNr促进NREM。由于基底神经节回路对控制运动活动至关重要,上述发现强调了睡眠前运动活动抑制与睡眠开始之间的潜在机制联系。

延髓面旁区(PZ)含有促进NREM的GABA能亚群,损伤或抑制GABA能神经传递抑制NREM。PZGABA神经元支配PBN,可能通过抑制PBN促进SWA;然而,PZGABA神经元活动如何与其他NREM调控区协调仍未解决。延髓、vlPAG和背侧被盖核(SLD)中其他几个神经元亚群的活动可促进NREM。促进NREM的vlPAGglut/Nts神经元以及SLD区Nts神经元的光遗传学和化学遗传学激活促进了NREM,而vlPAGglut/Nts神经元的化学遗传学抑制抑制了NREM。vlPAGglut/Nts神经元对NREM的调控是通过投射到腹内侧延髓(vmM)GABA能神经元来实现促进NREM的,光遗传学抑制时NREM也被抑制。vmMGABA神经元可能通过抑制单胺能群体来促进NREM,因为光遗传刺激LC、VTA和DR中的vmMGABA抑制轴突末端可以促进NREM。同样,耗竭vmMGABA/gly神经元释放的神经递质可以减少和片段化NREMS和REMS,这可能是通过解除觉醒系统的抑制来实现的。然而,这一发现与另一项研究相矛盾。未来的研究将使用精确的区域、环路和细胞类型特异性手段来揭示这些脑干群体在NREM调节中如何与前脑区域交互。
综上所述,散在分布的神经元网络通过抑制觉醒神经元和促进行为静止、NREM脑电图振荡和其他NREM相关特征来形成NREM状态。如何在这个分布式网络上协调NREM启动和维持仍然是一个悬而未决的问题。
△上下滑动查看△

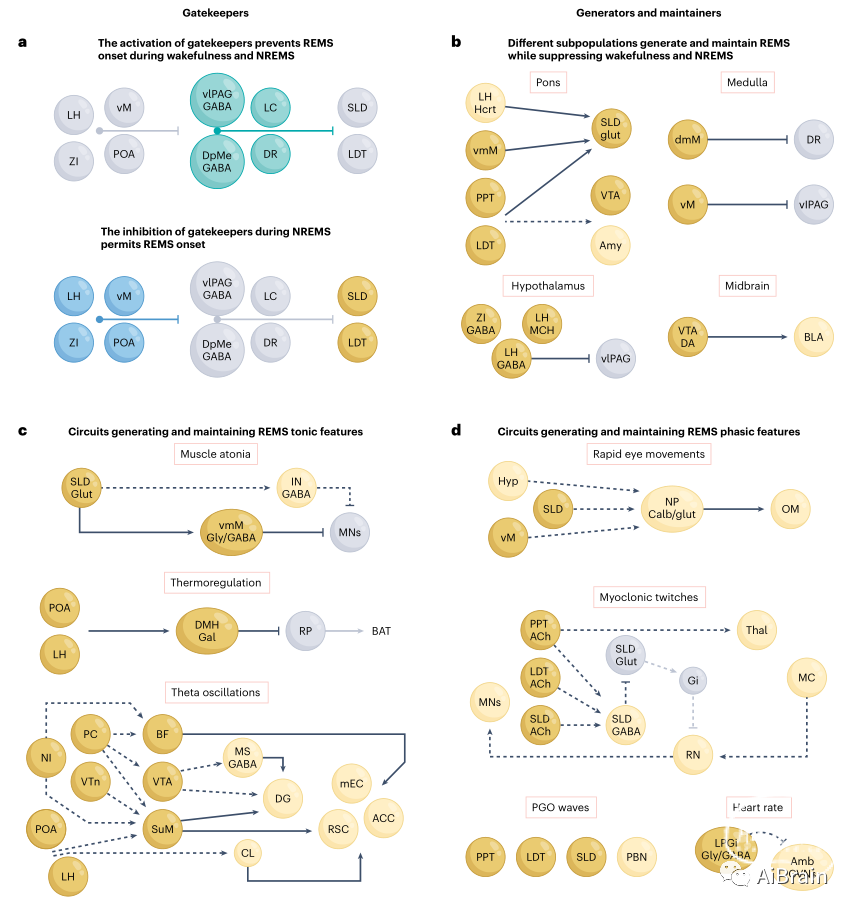
REM睡眠最初是在一个明显处于睡眠状态的个体中,伴随快速眼动而皮层激活的基础上确定的。目前已知,REM睡眠是一种复杂的神经生理状态,由张力性和相位性特征组成,由分布式神经元群体之间的相互作用控制。一般的概念认为,REM依赖于“守门人”——在清醒和NREM期间防止REM发生的回路——以及“产生者和维持者”——在抑制清醒和NREM控制REM特征的启动和维持的回路。下面详细介绍目前对REMS调节环路的理解。值得注意的是,桥脑背侧(或桥脑被盖)包含几个相邻的、形状不规则的核,涉及睡眠-觉醒调节,包括SLD、背侧被盖核(LDT)、背内侧被盖核、PPT、蓝斑前区和PBN。

vlPAG和背侧深中脑核(dDpMe)的GABA能神经元是REM的关键守门人。它们投射到涉及REM生成和清醒维持的大脑区域,包括SLD、LDT、LC和DR,并受延髓、SLD、LH、ZI和POA轴突的支配。大多数vlPAG/dDpMeGABA神经元在清醒时活跃度最高,在NREM期间活跃度下降,在REM期间几乎处于静止状态,而一小部分神经元在REM期间活跃度最高。vlPAG/dDpMeGABA细胞体或其桥脑背侧末端的光遗传或化学活化可抑制REM。类似地,通过光遗传抑制vlPAG中的LHMCH末端来减少对vlPAG的抑制输入,可以减少NREM向REM的转换和REM的持续时间。相反,通过药理学、损毁或化学遗传学方法使vlPAG/DpMeGABA神经元失活显著增加REM持续时间。因此,当vlPAG/dDpMeGABA神经元被激活时,REM被抑制。事实上,vlPAG/dDpMeGABA神经元在REM结束时比在清醒期结束时表现出更低的活动。
哪些神经元抑制vlPAG/dDpMeGABA神经元后允许REM启动?腹侧延髓GABA能REM-on神经元在REM开始前30秒活动增加,当其在vlPAG中的末端被光遗传激活时,可促进REM。POA包含促进REM神经元,并投射到vlPAG、LC和DR,它们也是REM的守门人。类似地,LH含有GABA能神经元,在REM启动之前活跃,并投射到vlPAG。在未来的研究中,进一步探究这些回路在REM启动中的作用将是有意义的。

涉及REM产生的中央大脑区域是SLD(在不同物种中称为蓝斑下核或蓝斑周围)。它包含谷氨酸能、GABA能和可能的ACh神经元的混合,在REM和清醒期间被强烈激活。背侧脑桥的钙成像显示SLD/LDTglut神经元不仅在REM期间持续活跃,而且在REM开始前10秒,其中一个亚群的活动也增加了。此外,REM持续时间可以通过药物激活或去抑制SLD区域来增加,并通过抑制vmM投射的SLDglut神经元的神经传递来减少。SLD的一个令人惊讶的投射来源是促进REM的LHHcrt神经元的一个亚群,它支配SLD,而不是LC,并可能起稳定REM的作用。SLD中的LHHcrt末梢可以兴奋SLD神经元并同步其峰值活动。这些末梢的光遗传激活会增加REM发作时间和θ功率,而光遗传和化学遗传抑制则会降低这些。
REM调控的另一个中枢是延髓。延髓含有多个甘氨酸能/GABA能亚核,具有不同的投射模式。尽管靶向特定亚核一直具有挑战性,但有证据表明,外侧和背侧延髓可能产生并维持REM,而vmMgly/GABA神经元亚群产生肌张力丧失。腹侧延髓和背内侧延髓(dmM)神经元在REM启动前活动增加,在REM结束前减少或停止放电。光遗传和化学激活腹侧延髓区(可能是侧副巨细胞核,LPGi)GAD2神经元、dmMGAD2神经元和dmMGAD2对DR的投射促进并维持REM,而它们的抑制则会阻断REM。有趣的是,最近的研究结果表明,在NREM期间,dmMGAD2神经元表现出与脑电图次慢振荡同步的次慢振荡(在sigma范围,10-15Hz),靶向光遗传刺激进一步表明这些脑电图振荡与进入REM倾向之间的协调。NREM期间的纺锤波密度预测了REM,但纺锤波、dmM神经元活性与REM启动之间的方向性和因果关系有待进一步研究。其他腹内侧延髓亚核不太可能参与REM调控,因为vmMgly/GABA神经元中GABA泡状转运体(Vgat)的下调不会改变REM持续时间。
除了脑干,下丘脑——特别是LH和ZI——包含许多REM-on/wake-on神经元,特别是REM-on神经元。此外,许多LHGABA和ZIGABA神经元在REM启动前活动增加。LH的药理失活完全抑制了REM,提示其在REM现象学中的必要性。LHMCH神经元可以双向控制REM:它们的化学遗传和光遗传激活增加了NREM-REM转换的概率和REM发作时间,而它们的化学遗传抑制则减少了REM持续时间。REM在LHGABA/MCH阴性神经元上的确切作用有待进一步研究。LHMCH神经元可以通过投射到vlPAG区域和抑制LH、TMN、LC和DR中的觉醒促进神经元来控制REM的启动。另一个下丘脑亚群,DMHgal神经元,最近被认为通过投射到苍白球(RP)/大细胞网状区,在REM的启动和维持中发挥作用。
最近研究表明,基底外侧杏仁核(BLA)内VTADA轴突末梢的DA释放在REM启动中起主要作用。在REM启动前,VTADA神经元活性增加和BLA内的DA释放增加。在NREM期间,光遗传刺激BLA上的VTADA末梢可减少REM潜伏期并延长REM持续时间,而光遗传抑制可减少REM。DA介导的脑干投射BLA神经元去抑制是否会引发生理性REM仍有待确定。此外,VTADA神经元受多个REM调节的细胞亚群支配,包括LH和PPT/LDT中的亚群;然而,VTADA-BLA投射神经元上游调控因子的身份尚不确定。
最后,我们认为PPT/LDT神经元参与了REM的维持。PPT/LDTD的ACh、谷氨酸能和GABA能的神经元亚群是wake-on/REM-on神经元。PPT/LDT ACh神经元的药理学和光遗传学激活增加了REM发作的次数,SLD区ACh受体的药理学阻断降低了REM的θ功率。此外,对PPT的电刺激会增加REM的持续时间,这一效果会被杏仁核中Ach受体的抑制所阻断。DA和乙酰胆碱在杏仁核中如何相互作用促进REM仍有待研究。

REM的特征是强直性肌肉张力消失、体温调节暂停、皮质和海马θ波振荡。在REM期,SLD参与肌肉张力不足的控制。SLD损毁、药理学和化学遗传学抑制和失活来自SLD神经元的谷氨酸神经传递可增加REM期间的运动行为。SLDglut神经元在REM期间通过轴突投射到抑制性脊髓中间神经元和投射到脊髓运动神经元vmMgly/GABA神经元抑制肌肉活动。值得注意的是,投射到脊髓的vmMgly/GABA神经元与投射到可能参与REM维持的吻侧脑区(包括vlPAG、LC和DR)的腹侧延髓神经元不同。
REM期间的体温调节暂停可能是由POA和LH中的热敏神经元引起的,它们在REM启动之前感知下丘脑大脑温度的升高并投射到DMHgal神经元。这些DMHgal神经元在REM期间持续活跃,并可能支配RP中的神经元,通过投射到棕色脂肪组织来控制产热。通过DMHgal RP投射神经元对RP强直性抑制可能抑制体温调节过程。
在REM期间,大脑的几个区域与皮层和海马θ波振荡的产生有关。MSGABA神经元支配海马体,与觉醒θ波产生有关,光遗传抑制可显著降低REM θ波功率。BFACh和BFglut神经元的化学激活增加了REM θ波功率,而抑制BF/LPO中的谷氨酸信号可能会降低REM θ波功率。MS/BF神经元在REM期间的活动可能通过来自多个脑干区域的输入进行协调,包括无名核和Gudden腹侧被盖核,以及蓝斑前区,这些区域的损伤会消除REM θ节律。此外,在REM期间,乳头体上核和屏状核与几个边缘和皮层区域的激活有关,包括齿状回和前扣带回、内侧内嗅皮层和压后皮层。乳头体上核和屏状核由LDT和LPO神经元支配,间接由LHGABA神经元支配。这些可能在REM期间协调乳头体上和核屏状核的活动。最后,VTADA神经元还可能调节海马和隔区神经元的活动,以调节清醒和REM期间的θ波振荡。
这些从脑桥到皮层的分布亚群神经元如何在REM θ节律的生成中发生因果交叉,有待进一步研究。

REM的特征是在短时间内同时出现几个一致的特征。脑干,特别是与动眼肌控制有关的前庭核,含有在REM期相关的快速眼动中增加放电并控制这些运动的神经元。最近,背侧延髓papilio核(NP)被认为与产生这些快速眼球运动有关。NPCalb/glut神经元在REM期间和眼动开始前活跃。在REM期间,动眼肌核中NPCalb/glut轴突末端的光遗传激活可诱导眼球运动,而抑制其可减少眼球运动。几个REM调节区域,包括腹侧延髓、SLD和下丘脑,支配NP神经元,并可能在相位性REM期间协调它们的活动。
PPT/LDT/SLD的胆碱能投射可允许或引发REM肌阵挛性抽搐。在小鼠PPT/LDT/SLDACh神经元的爆发性活动的过程中观察到胡须抽搐,以及在PPT/LDTACh神经元支配的SLDGABA神经元的爆发活动过程中观察到胡须抽搐。此外,一些LDT神经元在肢体抽搐之前就被激活了,这表明在它们的启动过程中起了作用。中脑红核参与控制啮齿动物幼仔清醒时的运动流出和REM时的抽搐,受到SLDglut神经元的间接抑制。在REM期间,SLDglut神经元的短暂抑制可能导致红核神经元的去抑制和短暂的张力消失。事实上,REM期间的肌肉抽搐是由谷氨酸释放到运动神经元(可能来自红核末端)介导的。对成年啮齿动物的这些环路进行进一步的功能研究,可能会为这一环路提供急需的线索。PPT/LDTACh神经元也支配丘脑,丘脑与运动皮层相互作用,并参与抽搐相关的大脑激活。
先前的研究发现,PPT/LDT/SLD和PBN区域的神经元在PGO波期间爆发活动,损伤后减少了猫的PGO波。胆碱能信号特别涉及PGO波的产生,大鼠的PGO(称为p波)可以通过给SLD使用ACh激动剂诱导。
最后,促进REM的LPGiGly/GABA神经元可能通过抑制疑核中的心脏迷走神经神经元来促进心率的阶段性增加,从而促进副交感神经反应。腹侧延髓的面旁呼吸区受胆碱能轴突支配,麻醉大鼠局部应用ACh激动剂可促进REM期间的主动呼气。
总之,REM的相位特征是同时发生的,并受不同脑干亚群的控制。虽然胆碱能神经传递已涉及他们的协调,REM期间这些事件发生的启动和协调机制仍有待阐明。
△上下滑动查看△

最近,在理解睡眠和清醒状态的性质和组织原则方面取得了进展,使用了能够针对不同大脑区域的特定细胞类型和环路的工具。尽管人们最初认为睡眠是由解剖学上局限的神经元群控制的,但现在人们认为睡眠是由从脑干到前脑的弥散神经元网络控制的。在脑核中发现了许多抑制促进NREM的神经元群,这些神经元群在与清醒相关的行为中起着关键作用,包括恐惧和运动调节,突出了清醒行为的抑制和睡眠开始之间的联系。在脑桥(REM调节的经典中枢)之外,如下丘脑和杏仁核区也发现了促进REM的神经元。最新技术的应用,使神经递质、神经调质和多肽的生物传感,将进一步促进对不同化合物如何作用于其神经元靶点以控制睡眠和觉醒方面的机制理解。由于睡眠-觉醒环路中的单个节点已被认为在觉醒调节中发挥着取决于环境条件的不同作用,因此将研究扩展到更复杂的生态条件,使动物能够参与自然行为,可能有助于我们理解这些节点的功能以及节点之间的相互作用。
尽管近年来取得了进展,但仍存在几个关键问题。首先,目前还不清楚不同神经元群的活动是如何在时间上被控制和协调以产生睡眠-觉醒状态的。同时使用多个神经元群体和/或大脑生物传感器的记录(例如,多位点光纤测光记录)与目标因果操作(例如,光遗传学)相结合,可以揭示睡眠-觉醒节点之间信息流的时间动态和方向性,并能够进一步探索基本的机制问题。例如,入睡、在两种睡眠状态之间转换和觉醒究竟需要哪些步骤?是否存在一个关键的神经元群来协调环路中其余部分的活动以触发状态,或者,更确切地说,几个节点中出现的动态控制状态的持久性和转换?是什么使REM的张力性发作和阶段性发作之间发生转变?除了完善我们对睡眠状态转换的机制理解之外,通过对不同物种的研究来探索双态睡眠的起源和好处也是非常有趣的。在确定动物的内部状态(例如疲劳、饥饿和安全)如何改变不同节点之间的动态,并与其他环路交叉以调节行为方面,我们也有望取得很大进展。由于非神经元细胞类型正在成为重要的睡眠调节器,将它们的成像与多位点神经元记录相结合,可能极大地有助于对睡眠驱动和控制的全面理解。最后,与其研究由分子标记定义的神经元种群(可能与它们的功能无关),不如改进我们研究功能集成的能力,这将大大提高将神经活动模式与功能联系起来的能力。
最后,还希望未来的研究能进一步揭示睡眠的不同特征是如何从细胞到机体层面进行协调的。是什么媒介向细胞、环路和器官传达睡觉的时间?目前尚不清楚NREM特征是由主动机制(例如,缓慢振荡或睡眠效应因子的活动)启动、维持和协调,还是由清醒操纵子(例如,去甲肾上腺素或清醒相关转录因子)的缺失引起的。通常认为这种协调是由慢波在NREM过程中的传播实现的。然而,SWA主要是在皮层和海马环路中进行研究,NREM特异性振荡是否以及如何作用于皮层下神经元和其他器官尚不清楚。由于大多数努力都是针对确定神经元群体的因果操纵如何改变皮层振荡活动和肌肉张力,我们对这些群体如何控制状态的其他特征(包括细胞和免疫特征)知之甚少。对睡眠个体特征的机制的更全面的理解可能会导致针对特定特征的靶向疗法的发展,并为大脑和身体提供恢复机会,而不一定会诱发睡眠。总而言之,目前是研究睡眠神经回路和揭示清醒时认知有限的一个令人兴奋的时刻。



声明:脑医汇旗下神外资讯、神介资讯、脑医咨询、AiBrain所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享。





