
撰稿 | AiBrain 内容团队 Yao
排版 | AiBrain 编辑团队

帕金森病(PD)是好发于中老年人的神经退行性疾病,其特征是黑质致密部(SNpc)中多巴胺能神经元的丢失,伴随着α-突触核蛋白(α-Syn)积聚的Lewy体。此外,肠道菌群失调也是PD的发病重要机制,PD患者的胃肠功能紊乱,肠道炎症,早在运动障碍发生之前就已经发生。然而,肠道微生物群中的哪些细菌种类在驱动PD发病仍然未知。
2022年12月21日,中国科学院深圳理工大学(筹)生命健康学院叶克强教授团队在Molecular Psychiatry上发表了题为“Helicobacter hepaticus augmentation triggers Dopaminergic degeneration and motor disorders in mice with Parkinson’s disease”的文章,阐述了在PD病理过程中,肝螺杆菌的累积可能通过激活AEP促进α-Syn病理和运动障碍。


为了消除饮食、药物、性别、年龄和地理位置对人类粪便样本中微生物差异的潜在影响,作者采用了PD小鼠模型,该模型用鱼藤酮处理以重建PD病理和运动缺陷。
鱼藤酮(常用来做杀虫剂或农药)作为一种经典的PD小鼠模型制备药物,前期口服鱼藤酮(5 mg/kg)的研究表明,它不会进入体循环或抑制肌肉或大脑中的线粒体复合物 I,仅作用于ENS并触发肠道神经丛中的α-Syn包涵体,逐渐通过迷走神经扩散到黑质(SN),导致多巴胺能神经元丢失和运动障碍。
为了确保鱼藤酮只影响胃肠道,作者通过口服更低剂量的鱼藤酮(2.5 mg/kg),并发现长期鱼藤酮处理会选择性地在肠道粘膜下神经丛特别是肠道TH阳性多巴胺能神经元中产生p-S129 α-Syn,同时还会引起严重的便秘。
之后作者收集了这些动物的粪便,使用 Illumina MiSeq 高通量测序平台对SNCA Tg和 SNCA/AEP KO小鼠粪便微生物组进行测序分析后发现,与对照组相比,在鱼藤酮处理的SNCA Tg小鼠粪便中拟杆菌属(Bacterodia),普氏菌和紫单胞菌(Provotella and Odoribactor families)以及罗伊氏乳杆菌(Lactobacillus reuteri)显著减少,但在SNCA/AEP KO小鼠中改变并不明显;此外作者发现颤螺菌属(Oscillospira)、毛螺菌科(Lachnospiraceae)、瘤胃球菌和肝螺杆菌(Ruminococcus gnavus和 Helicobacter hepaticus)数量在鱼藤酮刺激的两种小鼠品系中均有所增加。其中,肝螺杆菌多定植于小鼠小肠、盲肠和结肠,它会在IBD小鼠模型中诱发肠道炎症和结肠炎。
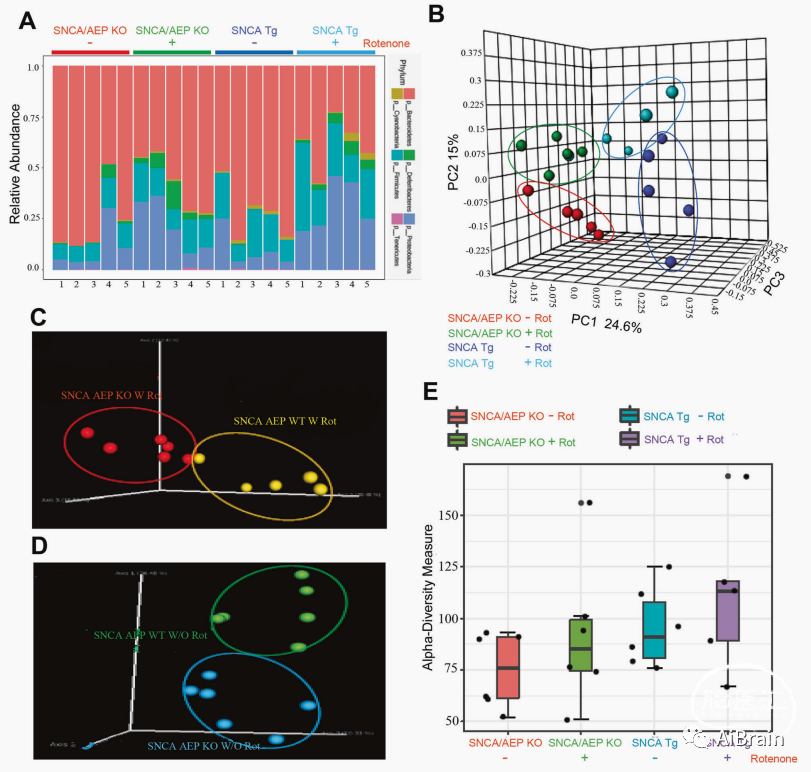
图1 SNCA和SNCA/AEP KO小鼠粪便中的微生物组分析揭示了微生物群落的改变

DSS是肠道中的炎症诱导剂,DSS诱导的慢性轻度肠道炎症加速了α-Syn突变体(A53T)PD小鼠的脑神经病理学和运动功能障碍。DSS启动α-Syn病理和神经炎症从肠道到大脑的逆行跨突触传播。
为了探索慢性DSS是否会诱发α-Syn病变和运动障碍,作者连续给予3个月龄的SNCA和SNCA/AEP KO小鼠0.5% DSS或水3个月,结果发现DSS可显著减少SNCA小鼠肠道中的TH阳性细胞,p-S129 α-Syn活性在肠道粘膜下层增加,结肠长度和排便频率显著下降和粪便的肠道通过时间显着增加,而这些影响在SNCA/AEP KO小鼠中未明显改变。
为了评估DSS处理是否改变肝螺杆菌丰度,作者对0.5% DSS处理的小鼠粪便样本进行了PCR分析,发现与对照与相比,SNCA小鼠的肝螺杆菌水平明显升高;相比之下,SNCA/AEP KO小鼠的细菌数量几乎没有增加。
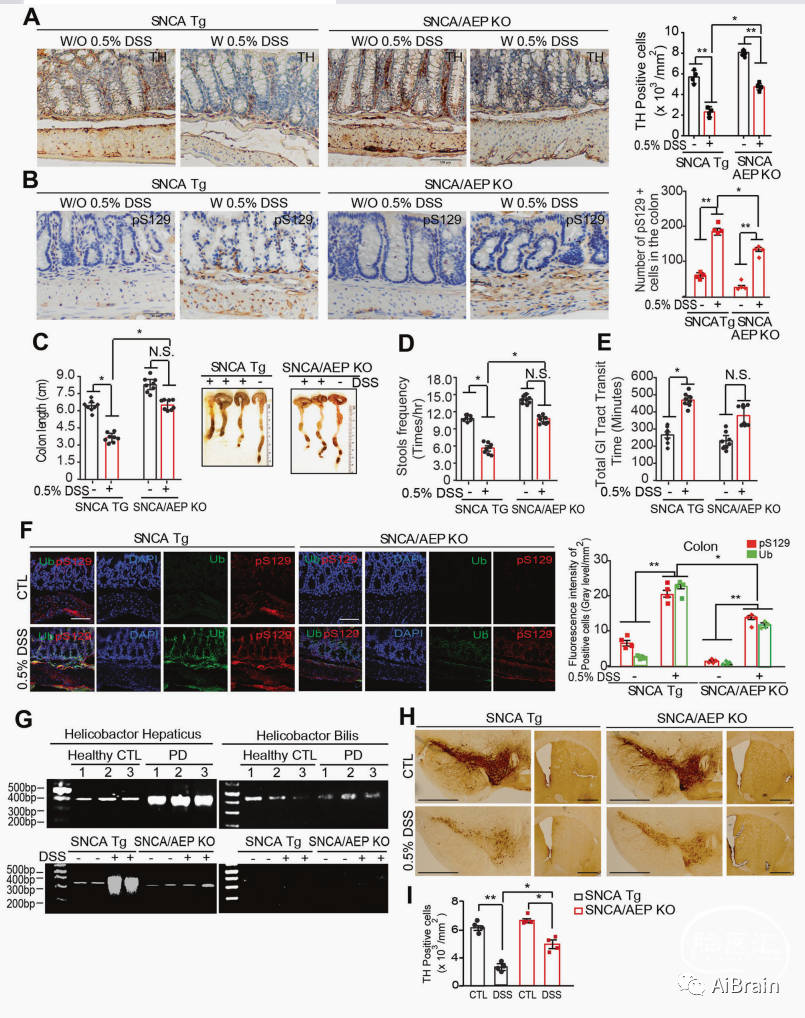
图2 DSS诱导SNCA小鼠肠道便秘和PD样发病机制

与在肠道中观察到的相似,0.5%DSS处理SNCA Tg小鼠大脑SN中p-S129 α-Syn、α-Syn N103片段、caspase-3、AEP表达水平显著升高,TH表达水平显著下降,多巴胺能神经元丢失,行为学实验的旋转棒和筑巢测试发现DSS减少了SNCA小鼠的运动活动;通过Elisa定量分析显示,在两种品系小鼠的结肠和脑组织中,DSS明显增强了炎性细胞因子(包括 TNFα、IL6和IL-1β)的浓度;但是这些影响在SNCA/AEP KO小鼠中未有明显改变。
以上结果提示DSS诱导肠道菌群失调和肠道炎症以AEP依赖性方式导致PD病理学和运动障碍。
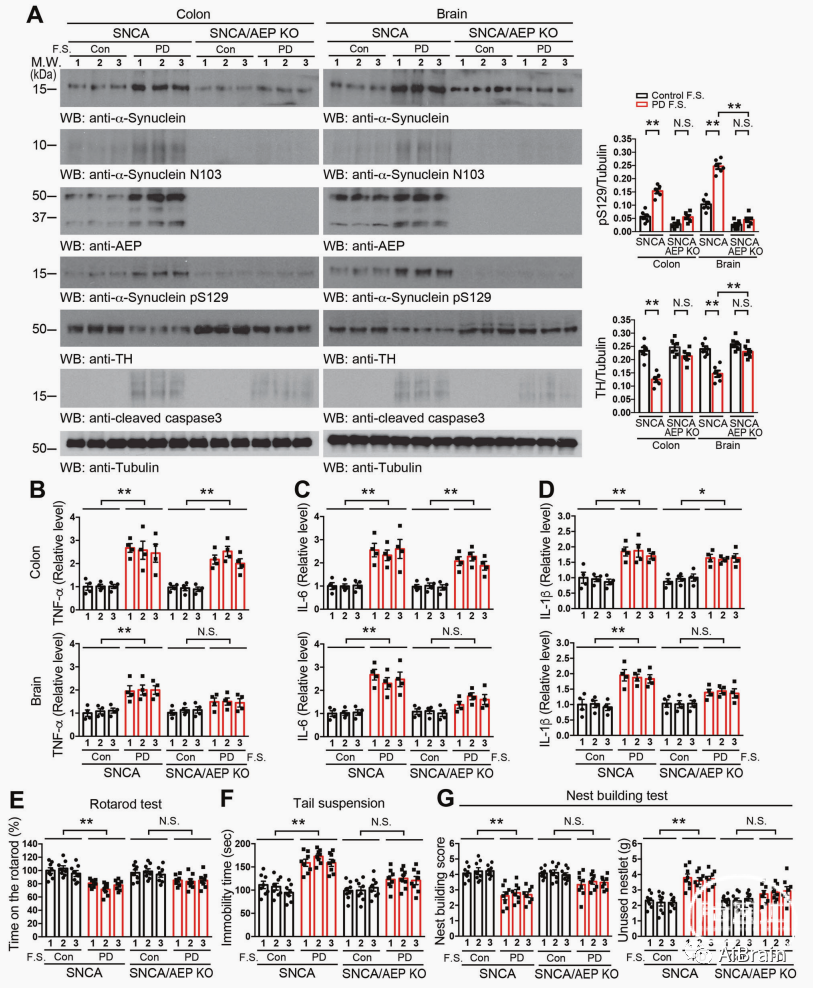
图3 PD患者FMT引起Abx预处理SNCA小鼠多巴胺能丢失、炎症和运动障碍

为了阐明肠道微生物群在PD和PD相关运动障碍发展中的因果作用,作者用抗生素混合物(Abx)预处理SNCA Tg和SNCA/AEP KO小鼠。1个月后,将来自3名PD患者和3名健康对照组的粪便样本通过口服每周两次施用到这些动物中,持续2个月。与健康对照相比,PD患者的FMT明显上调了SNCA Tg小鼠结肠和脑组织中的α-Syn、p-S129 α-Syn、AEP、α-Syn N103片段和caspase-3显著升高,TH蛋白表达水平显著减少,SNCA Tg小鼠出现明显便秘和抑郁的行为学样改变;这些影响在SNCA/AEP KO小鼠未有明显改变。
上述结果表明PD患者FMT通过AEP触发SNCA Tg小鼠的神经炎症,多巴胺能神经元变性,运动障碍和抑郁。
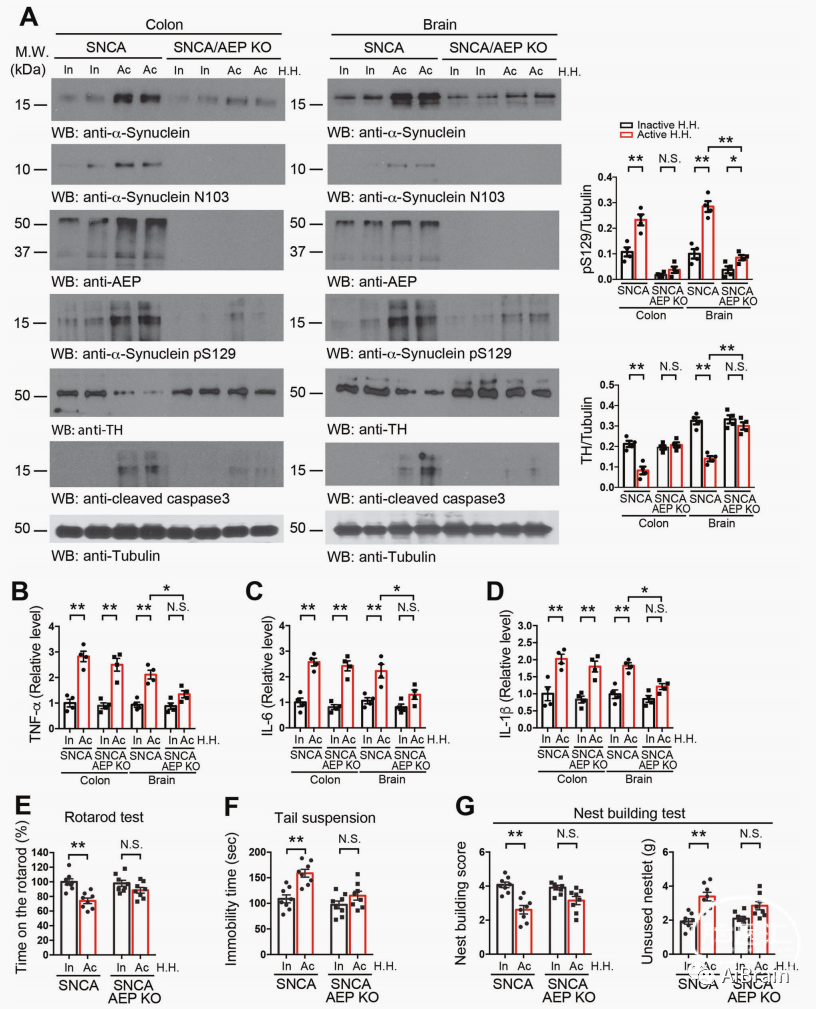
图4 活性肝螺杆菌引发Abx预处理SNCA小鼠多巴胺能神经元丢失、炎症和运动障碍

通过对鱼藤酮处理的SNCA Tg小鼠粪便的微生物组分析鉴定出肝螺杆菌,结合DSS处理SNCA小鼠后肝螺杆菌的富集以及PD患者肠道微生物群中肝螺杆菌的高丰度分布,表明肝螺杆菌可能在介导SNCA Tg小鼠大脑中的炎症和α-Syn病理学中起重要作用。
为了评估肝螺杆菌是否直接发挥致病作用,作者通过口服将无活性和有活性的肝螺杆菌接种到Abx预处理的SNCA Tg小鼠中。在两个月内分别在小鼠肠道和脑组织中检测到α-Syn、p-S129 α-Syn、AEP、α-Syn N103片段和caspase-3表达水平显著升高,TH表达水平明显下降,炎性细胞因子表达升高,运动能力下降以及便秘症状出现;但这些影响在 SNCA/AEP KO小鼠未有明显改变。
以上结果提示活性肝螺杆菌通过AEP诱发SNCA Tg小鼠神经炎症、多巴胺能神经元变性,运动障碍和便秘。
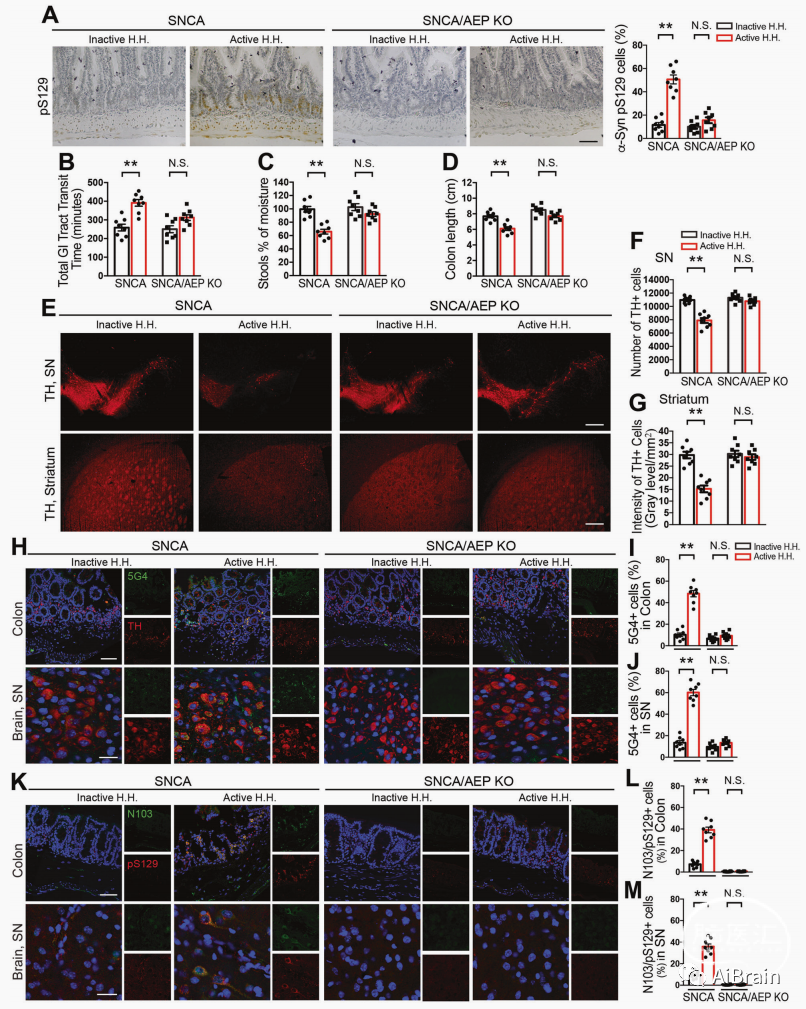
图5 活性肝螺杆菌引发SNCA小鼠PD病理和运动障碍
综上所述,作者通过对长期低剂量鱼藤酮口服建立的PD小鼠模型的肠道微生物群差异发现肝螺杆菌是导致PD发病的关键菌种。
之后作者采用SNCA转基因小鼠模型验证肝螺杆菌通过激活AEP引起PD小鼠便秘,肠道α-Syn病理改变和炎症,最终导致中脑多巴胺能神经元变性和运动障碍。
但是,目前尚不清楚肝螺杆菌的微生物代谢物是什么,以及代谢物是如何诱发肠道炎症、便秘、PD 样病变和运动障碍。未来的研究应侧重于鉴定肝螺杆菌的有害代谢物并阐明它们如何触发C/EBPβ/AEP途径导致PD的发生。
参考文献(上下滑动查看):

AiBrain内容团队为大家整理了文章的pdf,如有需要,请公众号后台留言“pdf”或扫码添加AiBrain助手微信获取。


声明:脑医汇旗下神外资讯、神介资讯、脑医咨询、AiBrain所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享。