加拿大多伦多大学的Scott Ryall等就pLGG的分子特征、靶向治疗途径、相应的检测平台、诊断治疗流程等进行综述,为pLGG的精准诊疗提供决策依据。文章发表在2020年3月的《Acta Neuropathologica Communications》在线。
——摘自文章章节
【Ref: Ryall S, et al. Acta Neuropathol Commun. 2020 Mar 12;8(1):30. doi: 10.1186/s40478-020-00902-z.】
研究背景
中枢神经系统(CNS)肿瘤是儿童期常见的实体肿瘤;在每10万儿童中占5.4-5.6例。而且在每10万儿童中,有0.7人死于中枢神经系统肿瘤,因此是儿童肿瘤死亡的主要原因。儿童低级别胶质瘤(pLGG)是儿童中枢神经系统肿瘤中常见一类,约占所有儿童脑瘤的30%左右。pLGG属WHO I级和II级,包含整个神经系统肿瘤的各种病理类型(图1)。其临床行为的异质性,特别是无法完全切除又易复发的肿瘤,其治疗是一个巨大挑战。加拿大多伦多大学的Scott Ryall等就pLGG的分子特征、靶向治疗途径、相应的检测平台、诊断治疗流程等进行综述,为pLGG的精准诊疗提供决策依据。文章发表在2020年3月的《Acta Neuropathologica Communications》在线。
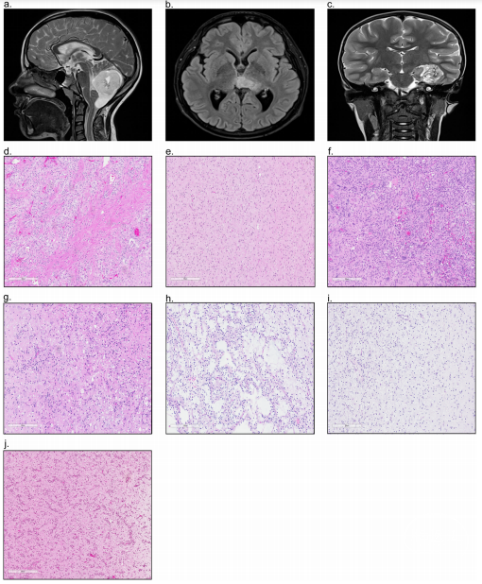
图1. 磁共振成像显示儿童低级别胶质瘤发生在a.小脑、b.丘脑和c.枕叶。HE染色突出肿瘤标志性组织学特征:d.毛细胞性星形细胞瘤,e.弥漫性星形细胞瘤,f.多形性黄色星形细胞瘤,g.神经节胶质瘤,h.胚胎发育不良神经上皮肿瘤,i.少突胶质瘤,j.血管中心性胶质瘤。
研究结果
该综述分以下几部分:
一、分子突变谱
儿童低级别胶质瘤的分子突变与成年患者有本质的不同。在过去的十年中,大量的分子数据表明pLGG中RAS/MAPK通路上调,其中BRAF融合或者点突变是pLGG中最常见的分子特征,与其它pLGG相比,BRAF V600E突变的总生存期(OS)和无进展生存期(PFS)更差。
FGFR1是pLGG中第二个常见的分子突变,包括FGFR1突变、FGFR1-TACC1融合和FGFR1 TKD-重复。FGFR1突变和FGFR1 TKD-重复常见于胚胎发育不良神经上皮肿瘤和其它神经胶质瘤,而FGFR1-TACC1在毛细胞星形细胞瘤中更常见。
在pLGG中很少发现CRAF(RAF1)的融合,而常见在毛细胞星形细胞瘤中。其中包括QKI-RAF1、FYCO-RAF1、TRIM33-RAF1、SRGAP3-RAF1和ATG7-RAF1。由于CRAF融合的罕见性,其临床意义尚不清楚。
神经营养性酪氨酸受体激酶(NTRK)基因家族在中枢神经系统发育中起着关键作用。在pLGG的不同组织学亚型中已发现NTRK融合,包括SLMAP-NTRK2、TPM3-NTRK1、ETV6-NTRK3和RBPMS-NTRK3。发生频率低,但有可能为靶向治疗提供机会。
pLGG中有一种与神经纤维瘤病I型(NF1)相关的、由NF1的胚系突变引起的胶质瘤;其中10-15%的NF1患儿会在视路内发展成低级别胶质瘤,另外3-5%出现在视路外。NF1-pLGG的病程属良性,但在较年幼的儿童(2岁)或在视神经通路外发生的NF1-pLGG具有较高的进展或死亡的风险。最近的一项研究发现,NF1-pLGG也存在其它的基因突变,常影响RAS/MAPK途径或涉及转录调控因子的变异(图2)。
除此之外,ALK融合、ROS1融合、KRAS突变、PTPN11突变、MAP2K1突变、MYB融合、MYBL1突变和H3F3A突变等也都在一些pLGG的组织学亚型中发现。

图2. a.儿童低级别胶质瘤中的RAS/MAPK信号通路示意图;b.儿童低级别胶质瘤中RAS/MAPK突变的平均水平;c.儿童低级别胶质瘤的突变类型。
二、靶向治疗
目前,pLGG的靶向治疗主要有BRAF、MEK、FGFR1和ALK/ ROS1/NTRK抑制剂。
达拉非尼(Dabrafenib)和维莫非尼(Vemurafenib)等BRAF抑制剂,单药治疗的病例报告显示效果良好。一项多中心的Ⅰ期临床试验发现,使用Dabrafenib的总体有效率高达41%。目前,正在进行优化给药安全性和耐受性的后续试验(NCT01677741)。
对于不适合BRAF抑制剂(NF1-pLGG、KIAA1549-BRAF融合等)治疗的pLGG,MEK抑制剂是有前途的治疗手段。现在,有4种MEK抑制剂:司美替尼(selumetinib)、曲美替尼(trametinib)(NCT03363217)、考比替尼(cobimetinib)(NCT02639546)和比美替尼(binimetinib)(NCT02285439)正处于临床试验的不同阶段。
FGFR小分子抑制剂AZD4547用于治疗伴有FGFR-TACC融合的恶性胶质瘤的试验正在进行。NTRK融合在pLGG中相对少见,恩曲替尼(entrectinib)和拉罗替尼(larotrectinib)都显示强大的抗肿瘤作用(NCT02637687,NCT02576431)。
三、检测方法及平台
对于pLGG分子特征检测方法和平台还没有“金标准”。目前,根据样本的质量或数量、检测目标和经济预算等选择不同检测方法。作者总结用于表征pLGG分子特性的常用检测技术的成本、投入要求、限制和时间要求。其中,免疫组织化学(IHC)和荧光原位杂交(FISH)是常用的方式,IHC可以用于大多数实验室,以及时、经济有效地检测肿瘤潜在突变的蛋白表达,广泛地用于BRAF V600E、H3.3 K27M和IDH1 R132H的检测。然而,这种方法受检测抗体的影响,仅限于可用抗体变异。荧光原位杂交(FISH)应用于检测基因融合和拷贝数变异较多,其一次检测只能针对一个反应目标。
近年来,利用二代测序(NGS)平台对实体肿瘤进行分子鉴定已获得广泛的应用。这些平台中,panel的设计通常包括pLGG中大多数的突变信息。基于NGS方法有利于在一个单次检测中同时获得多种变异形式,从中可以辅助做出诊断、预后和治疗的决定。与其它技术相比的局限性是技术操作时间和下游分析更为复杂和耗时,但这并非主要问题。另外,其它检测方法无法识别pLGG分子诊断时,NGS方法非常有利。
四、pLGG分子诊疗流程
考虑到不同肿瘤组织中的分子突变及其重叠,目前建议pLGG的检测流程,包括对特定的组织类型中特定突变进行检测以及使用含有pLGG中突变信息的NGS panel进行检测(图3)。

图3. 儿童低级别胶质瘤的分子检测决策树。*肿瘤携带FGFR1突变和其它突变的频率表明,无论状态如何,都有理由继续进行检测。AG:血管中心性胶质瘤;dNet:胚胎发育不良神经上皮肿瘤;GNT:胶质神经元瘤;ODG:少突胶质瘤;PA:毛细胞型星形细胞瘤;GG:神经节胶质瘤;PXA:多形性黄色星形细胞瘤;DA:弥漫性星形细胞瘤。
研究结论
最后作者总结,靶向治疗与长期后遗症相关是值得重视的问题,特别是对于放射治疗,可能会增加死亡率。因此,需要更有力的风险分层来帮助指导所需治疗的类型和执行程度。过去,根据手术切除、组织学诊断和年龄来判断预后。最近pLGG的分子基础已经成为补充肿瘤分层的有力工具。随着靶向治疗时代的到来,需要一种能够识别pLGG分子特征的简明分类方案。回顾pLGG的组织学谱发现,分子突变以及有效检测,以评估最新的治疗药物及其在治疗这种疾病中的作用。最后,文章提出采用多方面的手段来进行pLGG分层,包括临床、组织学和分子参数(图4),目的是帮助临床医生做出治疗决策。
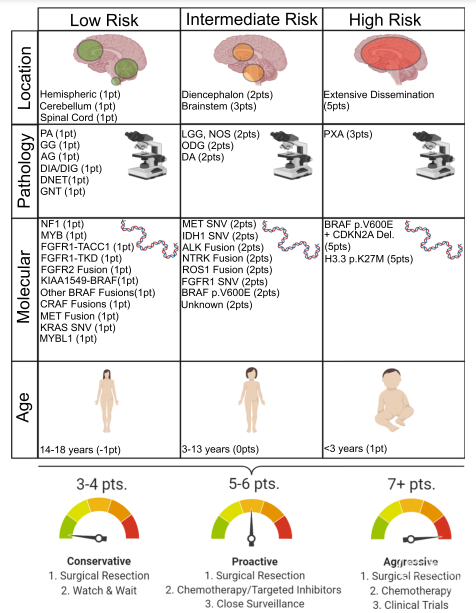
图4. 儿童低级别胶质瘤临床和分子特征的风险关系。展示肿瘤的位置、组织学、诊断年龄和分子驱动因素得相关积分。积分总和表示风险关系,并伴有适当的肿瘤治疗的临床建议。AG:血管中心性胶质瘤;dNet:胚胎发育不良神经上皮肿瘤;GNT:胶质神经元肿瘤;ODG:少突胶质细胞瘤;PA:毛细胞性星形细胞瘤;GG:神经节胶质瘤;PXA:多形性黄色星形细胞瘤;DA:弥漫性星形细胞瘤;DIA/DIG:促结缔组织增生性婴儿星形细胞瘤/神经节胶质细胞瘤;LGG:低级别胶质瘤;NOS:未另行规定。

声明:脑医汇旗下神外资讯、神介资讯、神内资讯、脑医咨询、Ai Brain 所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。






