供稿 | Abby
排版 | AiBrain 编辑团队
阿尔茨海默病(AD)是一种最常见的神经退行性疾病,发病较隐匿,最终会导致患者出现认知障碍、记忆失衡以及行为异常等,给全球公共卫生系统带来沉重的社会和经济负担。
截至目前,阿尔茨海默病的发病机制仍然没有形成定论。已有研究表明,阿尔茨海默病的一个重要标志是患者的大脑中存在神经原纤维缠结,大量由tau蛋白错误折叠而形成的神经原纤维缠结会损伤神经细胞的正常功能,甚至导致神经细胞死亡。
在阿尔茨海默病患者的大脑中,tau蛋白的错误折叠是备受关注的重要标志。神经原纤维缠结(NFT)中的Tau聚集与阿尔茨海默病(AD)的神经退行性变和认知功能下降密切相关。然而,区分NFT中易聚集和抗聚集细胞状态的分子特征尚不清楚。
北京时间2022年6月25日,斯坦福大学Inma Cobos团队在Neuron期刊在线发表题为“Molecular signatures underlying neurofibrillary tangle susceptibility in Alzheimer’s disease”的研究论文,揭示了阿尔茨海默病神经原纤维缠结易感性的分子机制。

尽管有证据表明tau异常折叠聚集与AD神经退行性变的组织学和神经影像学特征有关,区分易聚集和抗聚集细胞状态的分子特征仍不确定。
为了进行研究,作者开发了一种从新鲜冰冻的人脑中高通量地分析携带NFT的神经元的方法。作者证明了20种新皮质神经元亚型中NFT形成的特异性,以及形态学和分子特征可能是皮层神经元亚型对tau病理敏感性的基础。
结果发现,NFT的形成与较大的细胞、低表达的Ca2+结合蛋白、稀疏的髓鞘形成以及自噬和微管动力学的失调有关。
为了确定NFT易感性共享的和特异细胞类型的分子特征,作者进行了两步差异基因表达(DGE)分析。研究发现虽然导致AD中突触功能衰竭的致病性级联尚不完全清楚,但APP切割产物、Ab寡聚体和tau寡聚物似乎起着关键作用。
作者的研究结果支持一种模型,即NFT-Bearing神经元的APP上调和/或突触失调可能导致神经变性。
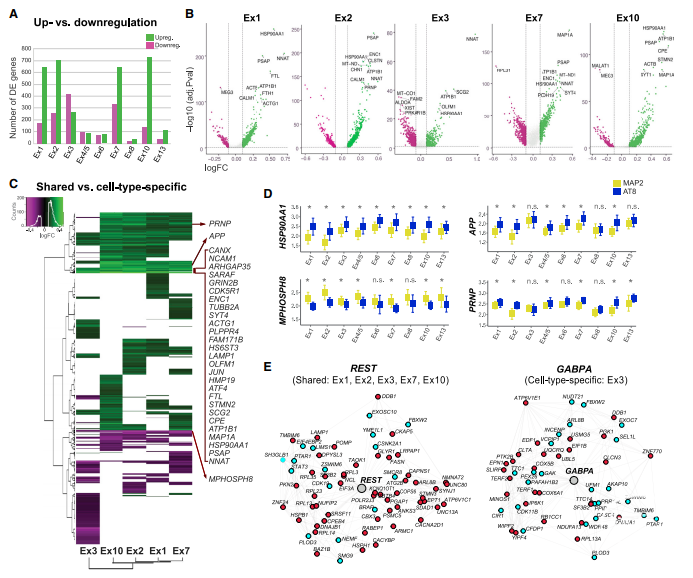
图1 亚型内和跨亚型的tau病理的转录组学特征
作者还发现NFT的神经元中与突触和应激反应基因的共同失调相反,葡萄糖代谢和线粒体功能基因的变化高度依赖于细胞类型,在Ex3中尤其丰富。该基因簇在变化方向(在携带NFT时大多下调),途径(即ATP代谢过程、氧化磷酸化和呼吸电子传递链)及其TF调节网络(即GABPA)均不同。
作者在BA9(无AD)中确定了NFT易感性与神经元死亡之间的关系。尽管影像学和组织病理学研究已经证明了NFT与神经退行性变的区域共同发生,NFT是否发挥毒性和/或神经保护作用仍存在争议。
虽然作者发现BA9的20个神经元亚型之间NFT易感性存在显著差异,但它们对死亡的易感性差异很小。NFT可能代表了AD患者对细胞和微环境应激源的细胞特异性反应,这些反应对携带它们的细胞既不完全保护也不致命。
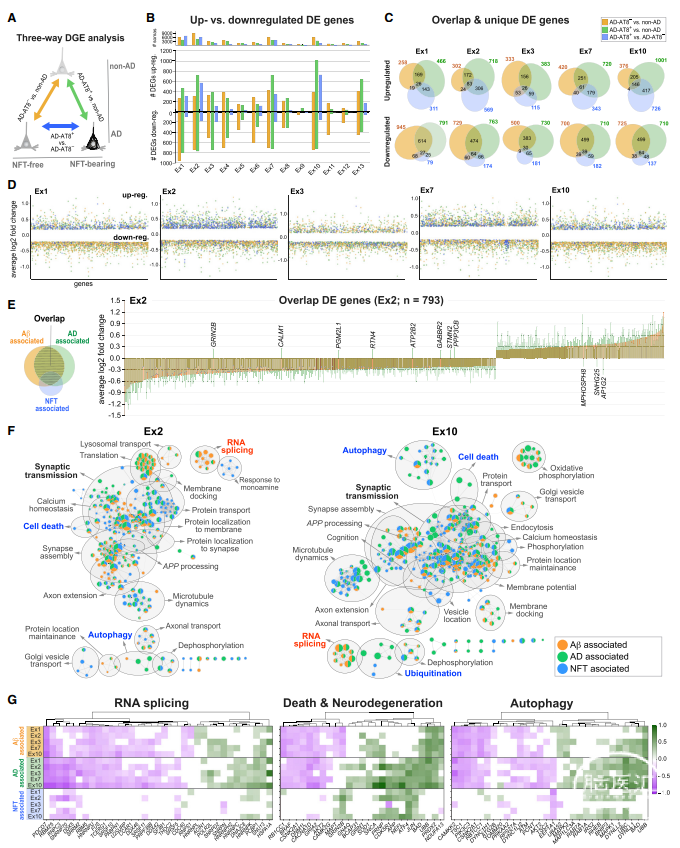
图2 NFT相关与AD相关的转录组学变化对比
研究人员还发现尽管ATF4和其他参与细胞应激反应的基因的上调对存活率的最终影响尚不确定,但对细胞损伤均呈稳态反应。这种反应似乎不足以保护AD微环境中的神经元免受死亡,而其他因素,如神经炎症、高兴奋性回路和血管病理学可能严重影响神经元功能和存活。
总之,这项研究证实了阿尔茨海默氏病中NFT中应激和突触功能障碍的细胞类型特异性反应。未来针对为生物标志物的发现和神经退行性变的tau依赖和tau非依赖机制的研究可能会产生令人鼓舞的结果,并有望带来新的临床疗法。
![]()
斯坦福大学Marcos Otero-Garcia为第一作者,Inma Cobos为通讯作者。加州大学洛杉矶分校伊斯顿中心、NIH神经生物银行和斯坦福阿尔茨海默病研究中心提供了人体组织。FACS是在加州大学洛杉矶分校琼森综合癌症中心流式细胞仪核心设施进行的。基因组学和测序在加州大学洛杉矶分校基因组学和生物信息学技术中心进行。这项工作得到了NIH/NIA、BrightFocus等项目的资助。

✦往期精彩回顾✦


声明:脑医汇旗下神外资讯、神介资讯、脑医咨询、AiBrain所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享。