供稿 | Mancy 复旦大学博士生
排版 | AiBrain 编辑团队
小胶质细胞是中枢神经系统的常驻巨噬细胞,它们在胚胎的皮层增殖区中特异表达,并通过改变其分子和形态从而调控神经发生过程。
尽管小胶质细胞在炎症吞噬和神经退行性疾病中发挥着重要作用,但在早期大脑发育过程中小胶质细胞如何进行稳态调控还尚不清楚。
来自中国科学院干细胞与再生医学研究所焦建伟教授课题组发现,在胎儿大脑早期发育过程中,ARID1A作为 SWI/SNF 染色质重塑复合物的表观遗传亚基,可破坏小胶质细胞中全基因组水平上H3K9me3修饰的覆盖度,使得小胶质细胞朝着更具有稳态能力的表型发展。
然而,如果缺失ARID1A,小胶质细胞稳态就会发生改变,进而损害PRG3的释放,再通过与神经前体细胞受体 LRP6 的相互作用进一步改变Wnt/β-catenin 信号通路的下游级联反应,从而扰乱神经前体细胞的自我更新和分化过程,并最终导致后期出现自闭症样行为。
该研究成果于2022年07月20日发表在《Molecular Psychiatry》杂志上,题为“Microglia homeostasis mediated by epigenetic ARID1A regulates neural progenitor cells response and leads to autism-like behaviors”。

焦建伟教授实验室主要从事脑发育及疾病机理研究,神经干细胞增殖与分化调控研究,遗传和表观遗传对神经发育调控机制研究,以及神经细胞转分化研究。近年来相关研究工作发表于Cell Research(2022)、Cell Stem Cell(2022)、Advanced Science(2022)、Molecular Psychiatry(2022)等杂志上。
在大脑早期发育过程中,小胶质细胞围绕着神经前体细胞(Neural progenitor cells, NPCs)的脑室区和亚脑室区表达,且在胚胎期E13.5-E16.5(神经生成阶段)小胶质细胞的表达量逐渐升高。
在脑发育早期过程中,小胶质细胞的发育与染色质的表观调控密切相关。ARID1A是 SWI/SNF 染色质重塑复合物的表观遗传亚基,在小胶质细胞中高度特异性表达。
当小鼠的小胶质细胞中特异性敲除Arid1a基因(Arid1afl/fl;Cx3cr1-cre)后,小胶质细胞出现数量减少,进一步通过免疫荧光染色小胶质细胞稳态标记物P2RY12和F4/80发现,敲除Arid1a后P2RY12和F4/80表达均减少,小胶质细胞的稳态明显受损。Arid1a缺失的小胶质细胞表现出更加活跃的形态,包括表现出高度极化状态以及分枝减少。
小胶质细胞除了通过其吞噬作用调控大脑皮层的发育外,自身状态(稳态-激活态)的转变也对神经前体细胞的发育产生影响。因此,作者进一步探讨Arid1a后敲除后对神经前体细胞自我更新和分化的影响。
在小鼠胚胎期E14,通过免疫荧光染色的方法检测细胞增殖标记物pH3、早期神经元标记物Tuj1、大脑皮层VI-V标记物Ctip2和大脑皮层II-V标记物Satb2,发现小胶质细胞中敲除Arid1a后,神经前体细胞的增殖和分化较对照组明显减少。
此外,在胚胎期E13电转GFP质粒,在出生后P15时观察神经元的形态,也发现小胶质细胞中敲除Arid1a后的神经元树突数量减少,树突长度变短。
在观察到上述小胶质细胞稳态异常导致神经发生障碍后,作者进一步探讨异常的神经发育是否会触发异常的行为学表现。
既往的研究表明,神经发育的失调与自闭症等疾病密切相关。作者评估了小胶质细胞中特异性敲除Arid1a后小鼠的运动和平衡能力,探索性能力,记忆能力,社交性行为等等。研究结果表明,Arid1a敲除的小鼠明显表现出探索性行为减少,焦虑,重复刻板行为和社交缺陷,这与自闭症行为非常相似。
小胶质细胞稳态的染色质分布变化可以提示基因表达变化的调控机制。ARID1A与核小体形成、组蛋白修饰和转录组调控有关。
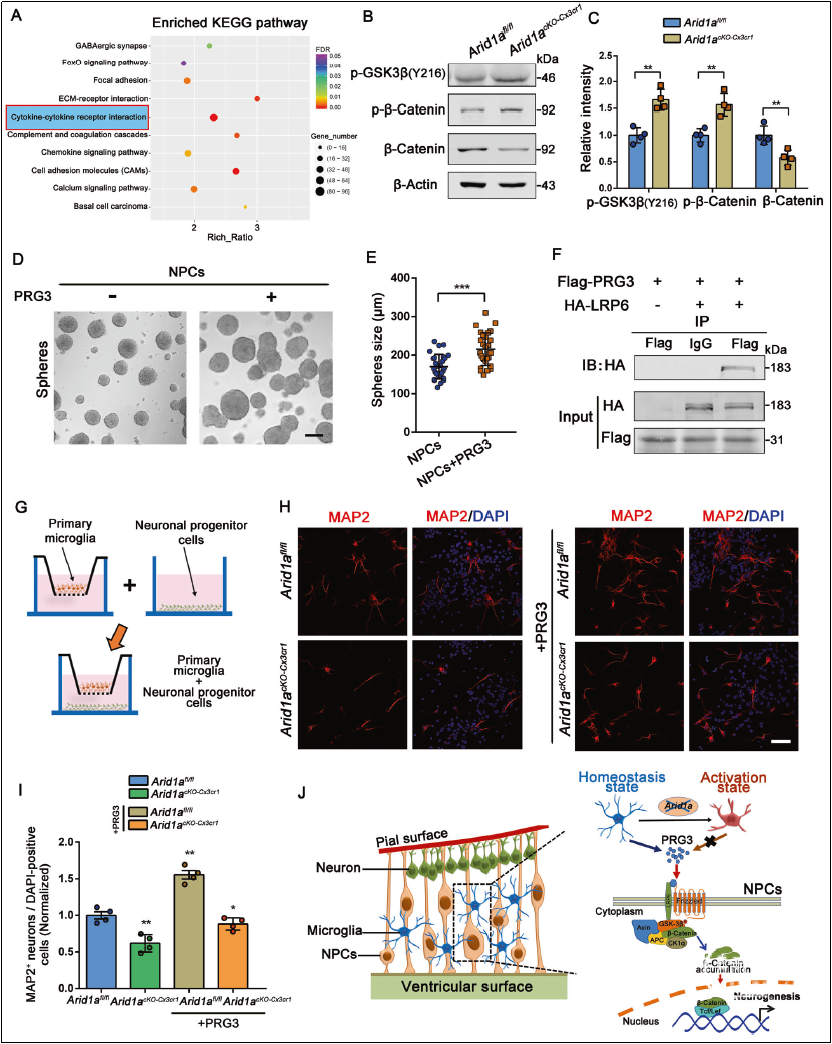
研究发现,在Arid1a缺失的小胶质细胞中,H3K9me3修饰明显升高,且H3K9me3修饰位点主要富集在基因远端内含子区域和启动子区域。对Arid1a缺失的小胶质细胞进行的RNA-seq和CHIP-seq分析发现,与神经前体细胞自我更新和分化密切相关的Prg3基因表达显著减少。
由于PRG3是一种分泌蛋白,作者提取Arid1a敲除和野生型小鼠大脑皮层的小胶质细胞进行体外培养,检测上清液中PRG3蛋白的含量,也发现Arid1a敲除的小胶质细胞中PRG3蛋白分泌减少。综上,小胶质细胞中Arid1a缺失导致全基因组水平上H3K9me3修饰的覆盖度增加,从而抑制Prg3基因转录活性。
为了进一步验证小胶质细胞调控神经前体细胞反应的分子信号机制,对RNA-seq数据集进行KEGG通路分析发现,与神经前体细胞增殖和分化相关的Wnt/β-catenin信号通路发生改变。
Arid1a缺失的大脑皮层中磷酸化GSK3β水平升高,导致下游β-catenin磷酸化水平增加,使得其进入细胞核中的β-catenin减少,导致神经前体细胞中Wnt/β-catenin信号通路激活障碍。
作者进一步通过co-IP技术验证PRG3是通过与神经前体细胞中LRP6受体结合从而触发下游Wnt/β-catenin信号通路。
作者将Arid1a敲除和对照的E13小鼠的小胶质细胞在体外和神经元进行共培养,并将PRG3添加到培养基中,结果发现,补充PRG3后受损的神经球大小,和神经发生过程均得到恢复(图1)。

综上,本研究阐明了小胶质细胞稳态与神经前体细胞反应之间的相互作用。
ARID1A敲除可以通过改变染色质的富集状态从而破坏胚胎期小胶质细胞的稳态,导致PRG3减少,进而减少了其与神经前体细胞中LRP6受体的结合使得下游Wnt/β-catenin信号通路激活障碍,最终导致自闭症样行为的发生。
此外,焦建伟团队近期在胶质细胞领域有一项重要发现,相关结果发表于4月的Cell Stem Cell,AiBrain神经科学新媒体也对其进行了报道,欢迎大家阅读!
▽点击图片或标题即可跳转查看▽

PMID: 35858990
DOI: 10.1038/s41380-022-01703-7
全文链接:
https://pubmed.ncbi.nlm.nih.gov/35858990/

✦往期精彩回顾✦


声明:脑医汇旗下神外资讯、神介资讯、脑医咨询、AiBrain所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享。