撰稿 | AiBrain 内容团队
排版 | AiBrain 编辑团队

神经退行性疾病会引起记忆丧失、痴呆和震颤。深部脑刺激(DBS)是缓解症状的有效治疗方法之一。然而,这种治疗可能会引起许多副作用。因此,非常需要一种按需、无创、无线的神经刺激策略。超声具有易于控制、穿透深层组织、成像和精确聚焦的特点,可以作为压电纳米材料的有效外部刺激1-2。然而,血脑屏障(BBB)限制了包括压电纳米材料在内的治疗药物在体内的全身输送。一氧化氮(NO)分子对血脑屏障有破坏潜力3。
在这篇文章中,验证了NO介导的血脑屏障暂时性开放的关键作用和机制,并表明压电纳米颗粒可以缓解动物帕金森病的症状。
2022年12月1日,韩国浦项理工大学和科技大学Chulhong Kim和Won Jong Kim团队在《Nature Biomedical Engineering》杂志上发表了题为“Deep brain stimulation by blood–brain-barrier-crossing piezoelectric nanoparticles generating current and nitric oxide under focused ultrasound”的研究文章,成功验证在帕金森小鼠模型中,超声响应纳米颗粒减轻了疾病症状,该策略将推动针对神经退行性疾病的微创疗法的发展。

作者先进行了纳米颗粒的制备,采用合成BNN6工艺制备了NO释放型压电纳米颗粒(BTNP-pDA-BNN6)(图1b)。纳米颗粒激活了多巴胺能神经元,在高强度聚焦超声(HIFU)下释放神经递质,减轻了动物模型中帕金森病的症状(图1a)。
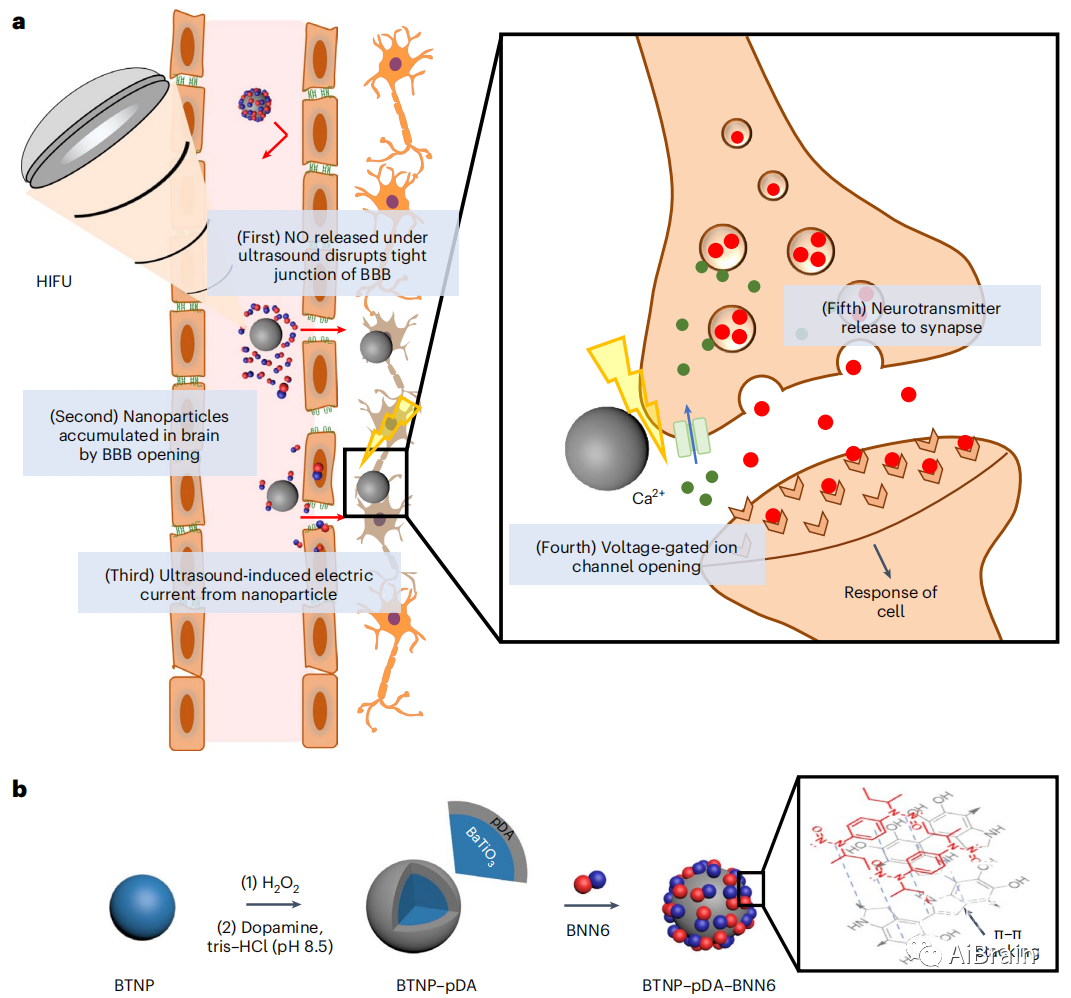
图1 用于神经刺激的超声响应压电纳米颗粒
作者通过x射线光电子能谱(XPS)和透射电镜(TEM)证实了pDA包被BTNP(BTNP-pDA)的成功制备(图2a),通过傅里叶变换红外光谱(FTIR)验证了BNN6在BTNP-pDA表面的成功加载(图2b)。
在XPS中,BNN6的N-亚硝基(-N-NO,402eV)出现了一个新的N1s峰(图2c),C-N/C-OH键的C1s峰值增加,表明BNN6的存在。此外,pDA的-C-N(401eV)和芳香烃N(403eV)峰均有所降低,表明pDA表面已被BNN6覆盖(图2c)。
热重分析(TGA)表明,pDA和BNN6的质量含量分别为7.64wt%和4.61wt%(图2d),这与BNN6在371nm处吸光度测定的负载含量一致。合成的纳米颗粒在水中下分布均匀,即使有血清存在,其大小分布也没有变化,这可能是脱质子羟基的作用在pDA上(图2e-g)。
在表面修饰后,x射线衍射仪(XRD)中保留了2θ≈45°的两个明显而紧密的峰,证实了四方性守恒产生压电(图2h)。研究了纳米颗粒在生理条件下的超声响应NO释放谱。与没有超声的情况相比,超声作用下NO释放量更大(图2i)。
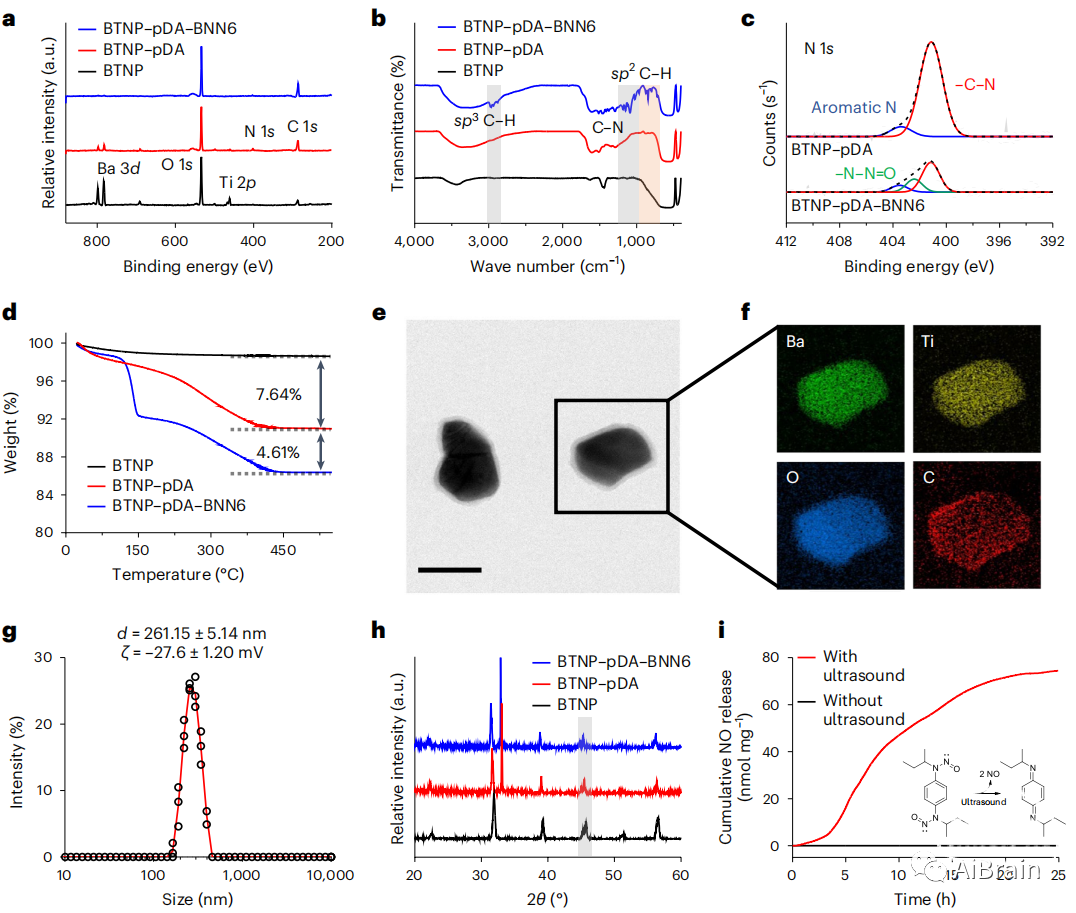
图2 纳米颗粒的表征
利用无互连膜片钳装置来监测生理条件下BTNP-pDA的超声响应压电行为(图3a)。在存在BTNP-pDA时,电流尖峰的强度与超声强度成正比(图3b)。并且,只有在超声作用下用纳米颗粒处理神经元样细胞时,细胞内Ca2+浓度才显著增加,而超声或纳米颗粒均未改变细胞内Ca2+浓度(图3c,d)。超声刺激纳米颗粒处理时,培养基中多巴胺的浓度显著增加(图3e),但单独使用超声或纳米颗粒观察多巴胺浓度的差异不显著。总之,通过打开电压门控Ca2+通道促进神经刺激,超声驱动的电流从纳米颗粒输出随后释放神经递质(图3f)。
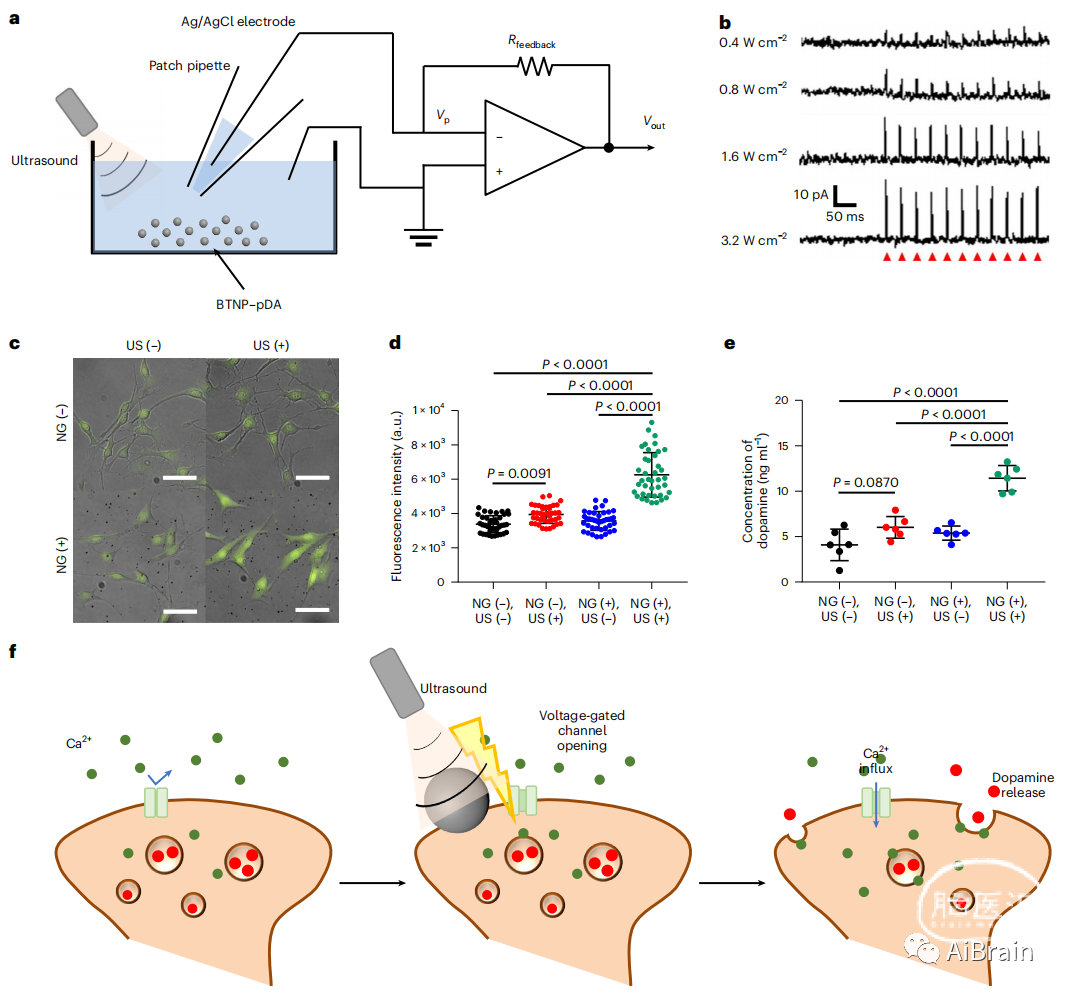
图3 体外压电神经刺激
为了研究释放的NO是否增强了纳米颗粒通过血脑屏障开口的转运,将纳米颗粒给药给小鼠,然后应用HIFU(图4a)。通过监测实时超声引导(图4b),应用HIFU 2h后,纳米颗粒在脑内保持形态分布(图4c)。与对照组相比,接受纳米颗粒和HIFU处理的小鼠大脑内累积的纳米颗粒数量显著增加,这表明NO对纳米颗粒进入大脑的运输具有关键作用(图4d)。甘露醇(对照)处理小鼠脑组织内Ba含量未见明显增加。
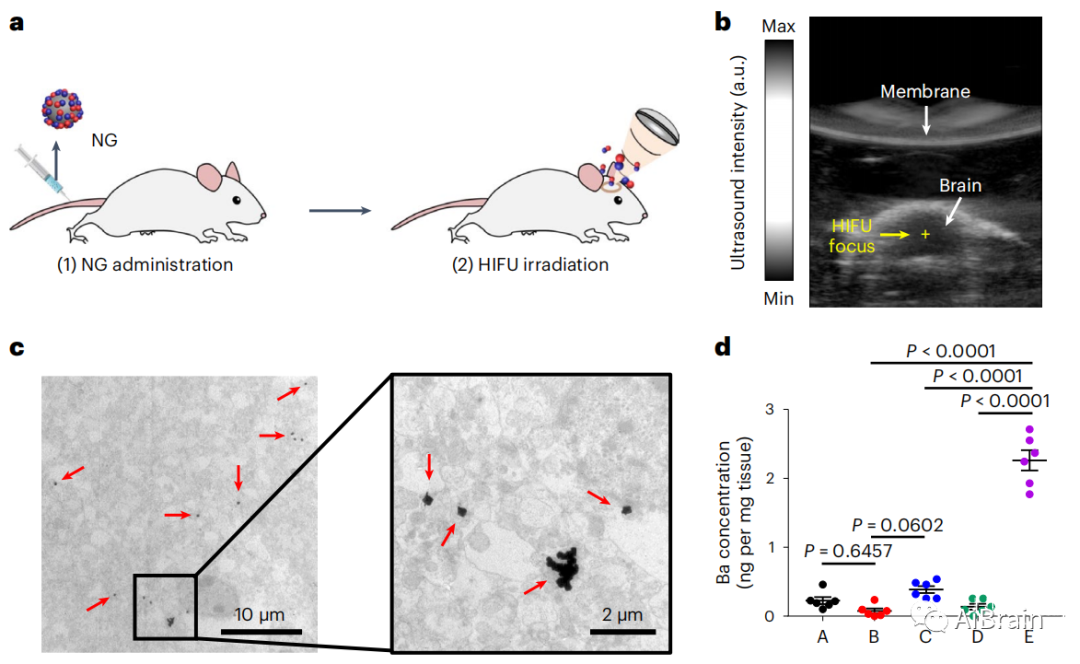
图4 纳米颗粒积聚在脑组织中
作者假设NO通过调节MMP-9的表达来损害紧密连接蛋白(ZO-1),从而促进压电材料进入脑组织的运输,从而导致暂时性血脑屏障中断。的确,在纳米颗粒和HIFU处理小鼠后,ZO-1的表达水平显著降低,而MMP-9的表达水平在样品处理后2h后显著升高(图5a,b)。此外,MMP-9的活性在前30分钟显著升高,然后在60分钟下降,说明NO暂时激活了MMP-9(图5c)。此外,在纳米颗粒和HIFU处理的小鼠中脑中,ZO-1与内皮细胞标记物CD31共定位的免疫荧光信号减少,揭示了ZO-1的损伤(图5d,e)。为了验证血脑屏障紧密连接的损伤是否是暂时性的,仅在血脑屏障具有通透性时才使用EB染料检测(图5f)。只有纳米颗粒和HIFU同时作用时,EB才会在脑内显著积累,而在HIFU作用后2h注射时,未观察到EB在脑内的积累(图5g,h)。这些结果表明,NO介导的血脑屏障破坏是暂时的,而不是永久性的,其趋势与时间依赖的MMP-9活性特征一致。

图5
STN对多巴胺能神经元所在的SNc有主要的传出投射(图6b)。经颅压电刺激诱导了标记有神经元活动标记物c-Fos的激活细胞的显著增强。进行旋转试验以评估样品处理小鼠的运动协调性,并记录它们的跌倒潜伏期以评估运动功能(图6a)。只有使用多种HIFU刺激纳米颗粒的小鼠在每天连续刺激10天后运动功能逐渐改善(图6c,d)。此外,多HIFU刺激的纳米颗粒组小鼠的运动活动第16天几乎恢复(图6e,f)。为了确定超声介导的压电刺激对STN细胞的实际激活,通过免疫标记观察c-Fos水平,并在第16天对同一组小鼠进行定量评估(图6g,h)。多个HIFU刺激纳米颗粒处理组仅STN区c-Fos+细胞显着增强。这些结果表明超声驱动的DBS与纳米颗粒导致增强行为功能,包括运动协调和身体移动活动。
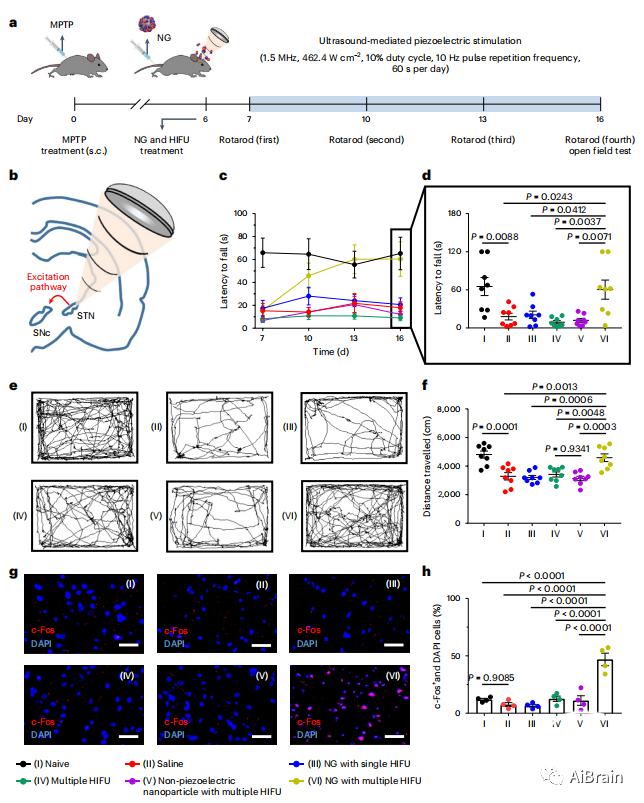
图6 体内DBS
作者通过恐惧记忆回忆试验评估超声介导的压电刺激对STN的神经保护作用(图7a,b)。MPTP处理的对照组在恐惧获得方面没有差异(图7c)。然而,仅在含有多个HIFU刺激的纳米颗粒的小鼠中观察到恐惧水平增强,而在对照组中没有显著差异(图7c,d)。SNc中TH水平的降低反映了黑质纹状体通路中多巴胺能神经元的退化。因此,在脑切片中研究了样品处理后TH水平的变化(图7e,f)。MPTP处理组SNc TH+神经元明显减少。然而,在用HIFU辅助纳米颗粒处理的小鼠中观察到更多的TH+神经元。这些结果表明,压电刺激通过抑制多巴胺能神经元的退化诱导多巴胺的释放来缓解帕金森病的症状。
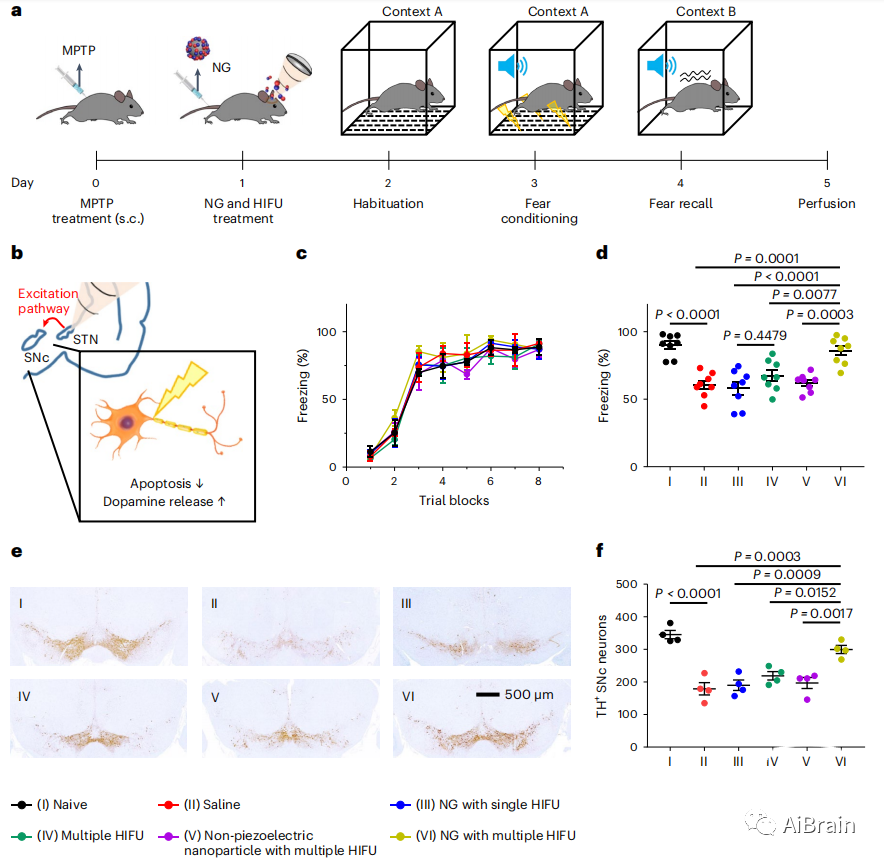
图7 活体DBS神经保护
在H&E检测中,纳米颗粒和HIFU处理后,脑组织(图8a,b)以及其他主要器官组织(图8c)中观察到形态学差异。治疗后也未发现任何炎症相关的脾脏肿大、肝酶活性升高或显著的体重减轻(图8d,e)。这些结果表明,含有HIFU的纳米颗粒没有引起任何局部和全身毒性。考虑到纳米颗粒的尺寸对于肾脏或肠道的清除来说太大了。因此,评价了纳米颗粒的生物分布和体内清除率。作者发现,在注射后60天,每个组织中累积的纳米颗粒数量显著减少。这强调了纳米颗粒在体内能够被很好的清除(图8f)。
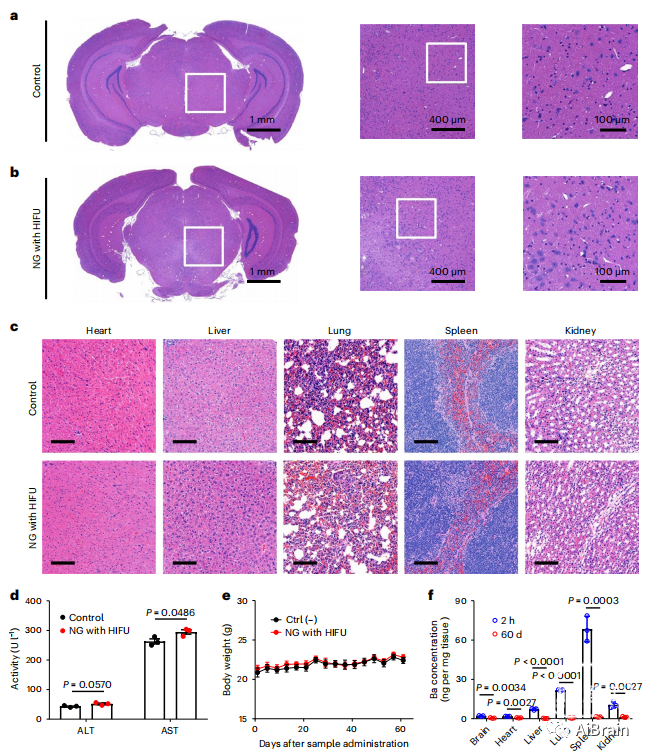
图8 纳米颗粒的体内安全性
参考文献及文章链接(上下滑动查看):
AiBrain内容团队为大家整理了文章的pdf,如有需要,请公众号后台留言“pdf”或扫码添加AiBrain助手微信获取。


✦往期精彩回顾✦


声明:脑医汇旗下神外资讯、神介资讯、脑医咨询、AiBrain所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享。