排版 | AiBrain 编辑团队
继发性全身性癫痫(sGS)是颞叶癫痫(TLE)中常见的一种严重症状,威胁着约70%的癫痫患者,并且难以受到抗癫痫药物的控制1。关于sGS的潜在机制仍不清楚。
由于癫痫被认为是与不平衡的兴奋-抑制相关环路功能障碍,因此在治疗上有必要确定TLE中的关键脑区和相关环路。下托(Subiculum, Sub)是海马输出的瓶颈,它向皮层和皮层下区域发送广泛的投射。之前研究已经发现,海马下托在海马癫痫发作的开始和传播中至关重要,并且下托中的电刺激具有很好的抗癫痫作用2。
就TLE中功能失调的下托细胞机制而言,局部去极化的GABA能信号和兴奋性的长投射锥体神经元协同促进癫痫活动。然而,癫痫信号是如何从锥体神经元传递到多个下游区域的,目前尚不清楚。
2022年8月25日,浙江中医药大学陈忠/汪仪团队在《Nature Communications》杂志在线发表了题为“Discrete subicular circuits control generalization of hippocampal seizures”的研究论文,研究人员在小鼠癫痫模型中结合了钙纤维光度法、光遗传学/化学遗传学、病毒示踪技术和电生理记录,首次证明了海马下托存在结构和功能异质性的神经亚群,确定了TLE中下托环路的多样性。此外,丘脑前核(ANT)环路能够双向调节海马癫痫发作,下丘脑环路具有不同的作用,这表明有必要精确定位特定神经环路,以有效治疗癫痫3。

研究人员首先关注了海马癫痫发作期间锥体神经元(主要类型)的功能变化。为此,在钙/钙调素依赖性蛋白激酶IIα(CaMKIIα)启动子下,将遗传编码的钙指示剂GCaMP6s表达到野生型小鼠的下托锥体神经元中。
随后,植入了光学套管,以捕获诱发癫痫发作期间的钙信号,这是一种反映临床局灶性癫痫发作(FS)和sGS的动物模型。免疫组化分析证实,GCaMP6s病毒在CaMKII+神经元下表达(图1a),表明钙信号群体是细胞类型特异性的。同时记录了癫痫发作活动和荧光强度的变化,并在FSs(图1b)和sGSs(图1c)期间检测到下托GCaMP荧光的显著增加。这种癫痫诱发的荧光增强与癫痫行为和脑电图(EEG)的强度平行。在sGSs期间,荧光的增加(ΔF/F)远高于FSs期间。
此外,研究人员发现与假手术(无癫痫发作)组相比,FS和sGS组均存在显著的c-Fos蛋白激活(图1d)。与仅经历FSs的小鼠相比,在经历sGSs的小鼠的下托中观察到更高水平的c-Fos表达(图1e)。免疫组化显示c-Fos和CaMKII的共定位(超过82%,图1f),证实大多数激活的下丘脑神经元是谷氨酸能神经元。
sGSs后,癫痫诱发的c-Fos激活主要在位于深层下托细胞中,在近端和远端区域之间未发现这种不一致(图1g)。这些结果表明,在海马癫痫发作期间,具有亚区域异质性的下托锥体神经元高度激活。
接下来,研究人员通过光遗传学选择性操纵下托锥体神经元,以检测是否会影响癫痫发作的严重程度(图1h)。体外记录证实,光激活下托锥体神经元加速了行为发作阶段的发展,延长了放电后持续时间(ADD),而光抑制延迟了发作阶段,缩短了ADD(图1i)。
光抑制下托锥体神经元的抗癫痫效应也反映在达到FS(第2阶段)和sGS所需的刺激次数增加上,而光激活下托锥体细胞的促癫痫效应则反映在达到sGS所需要的刺激次数减少上(图1j,k)。海马CA3的典型脑电图如图1l所示。
接下来,当小鼠完全发作时,研究人员选择性调节了下托锥体神经元对sGS表达的影响(图1m)。结果发现,下托锥体神经元的激活延长了sGS持续时间(GSD),使癫痫发作期和ADD不受影响(图1n-p)。相反,下托锥体神经元的失活减少了GSD(图1q-s)。这些数据表明,具有亚区域异质性的脑室下托锥体神经元双向调节海马癫痫发作。
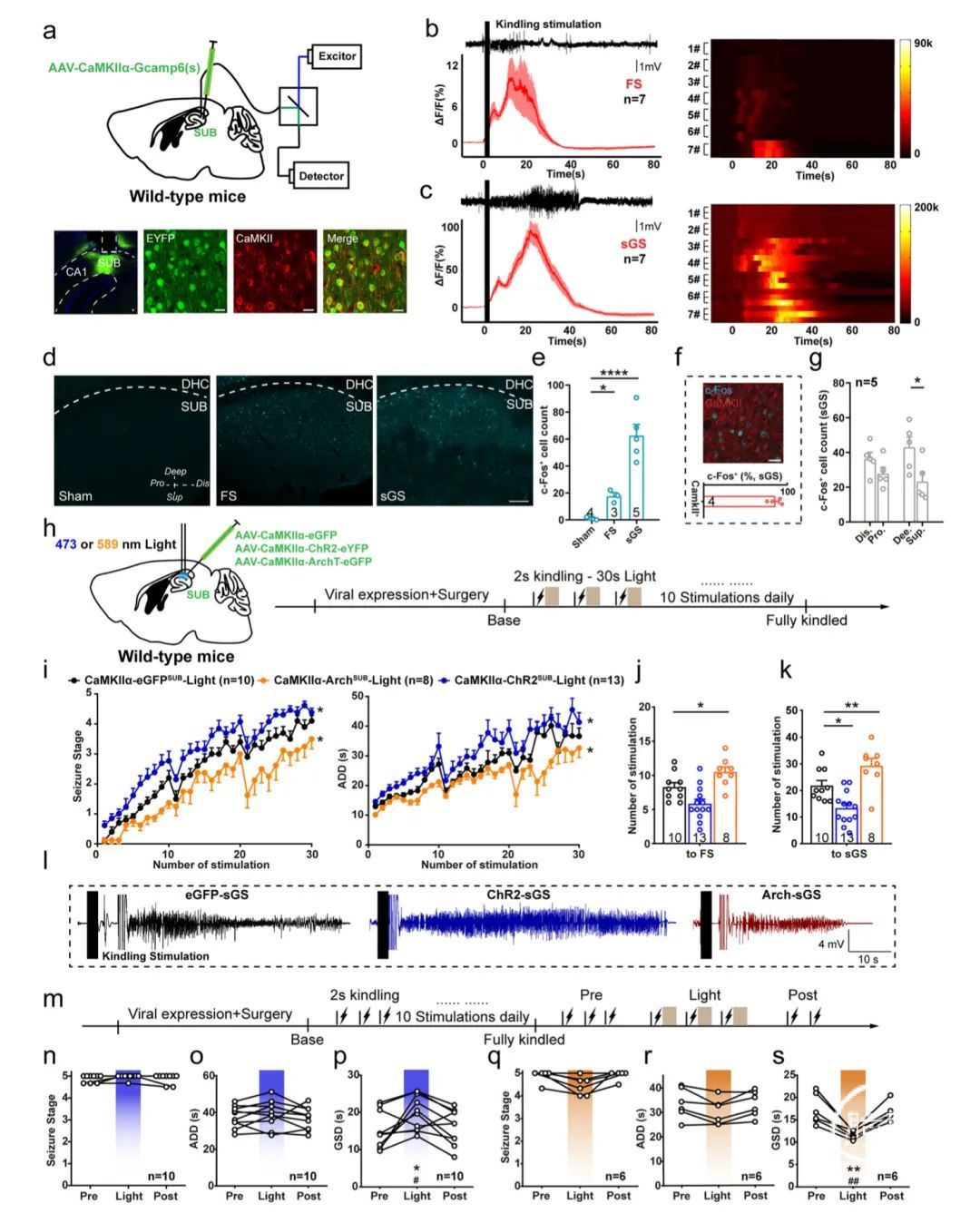
图1 海马下托锥体神经元控制海马癫痫泛化发作
考虑到下托为ANT提供了大量输入,研究人员利用模型评估了该通路的激活是否是加重癫痫严重程度的必要条件。将光学套管植入CaMKIIα-ChR2SUB小鼠的ANT(CaMKIIα-ChR2SUB-ANT,图2a)。光刺激强烈促进了海马癫痫发作的发展(图2b,c)。SUB-ANT投射的光激活也延长了sGS表达期间的ADD和GSD(图2d-f)。频谱分析显示在ANT末端激活期间海马EEG的绝对功率显著增加(图2g)。典型的EEG和相应的功率谱如图2h所示。
相应地,将光学套管插入CaMKIIα-ArchSUB小鼠的ANT中,以实现SUB-ANT环路的末端超极化(CaMKII a-ArchSUB-ANT,图2i)。ANT中的黄光抑制减少了癫痫发作阶段,并缩短了海马癫痫发作过程中的ADD(图2j,k)。光抑制该环路也通过减少癫痫发作阶段、减少ADD和GSD减轻sGS的表达(图2l-n)。在ANT末端超极化期间,有效地降低了CA3的绝对EEG功率(图2o)。典型的EEG和相应的功率谱如图2p所示。总之,这些结果表明SUB-ANT环路双向介导了海马癫痫的严重程度。
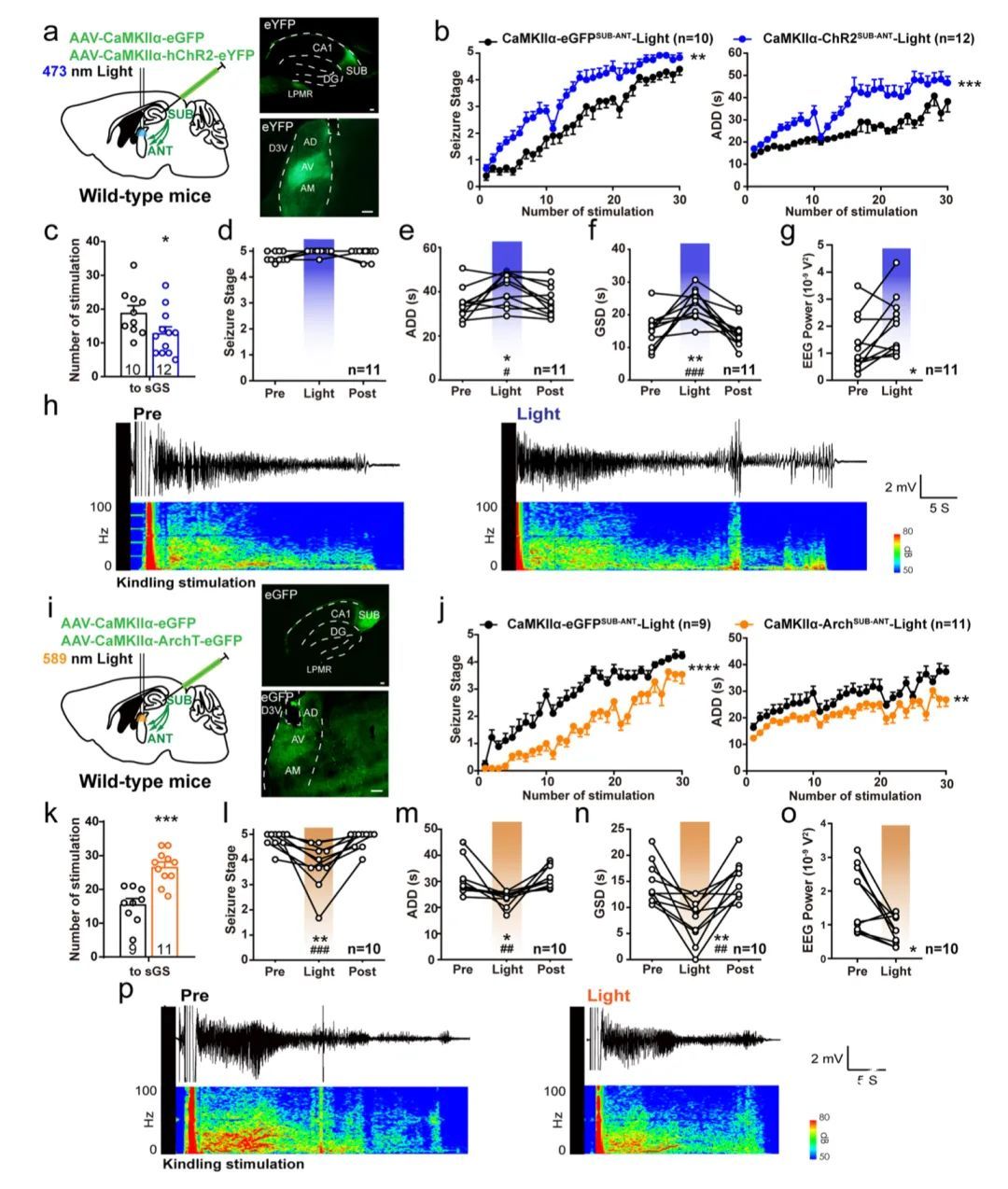
图2 SUB-ANT谷氨酸环路双向介导海马癫痫发作
研究人员又检测了SUB的其他下游投射是否参与癫痫调制。另外三个区域,内嗅皮层(EC)、伏隔核(NAc)和乳头体(MMB),它们也显示了激活的c-Fos免疫荧光。将光学套管植入CaMKIIα-ArchSUB小鼠的EC、NAc或MMB中,以选择性地抑制(超极化)这些环路终端(分别为CaMKIIα-ArchSub-EC、CAMKIα-ArcSub-NAc和CAMKIIIα-ArhSub-MMB,图3a,f)。当SUB-EC环路超极化时,癫痫发作阶段和ADD的发展加快(图3b)。此外,在sGS表达过程中,EC投射的末端超极化适度延长ADD和GSD(图3c,d)。如功率谱所示,EEG功率主要在小鼠发生sGSs的后期增强(图3e)。相比之下,NAc-和MMB投射下托终末的超极化对海马癫痫发作的发展没有明显影响(图3g)。
综上所述,这些结果表明,下托下游环路对海马癫痫发作有不同的影响。具体而言,SUB-ANT环路抑制能够减轻海马癫痫发作,而SUB-EC环路的抑制加重了癫痫发作。
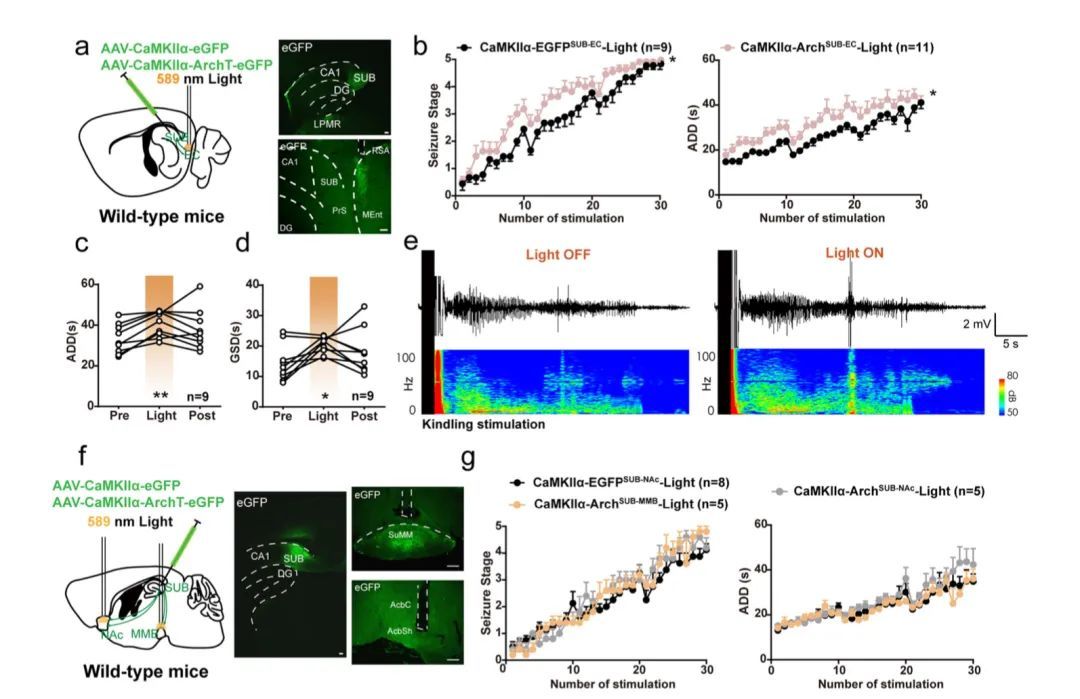
图3 SUB-EC、SUB-MMB和SUB-NAc环路在调节海马癫痫发作中的功能不同
接下来,研究人员通过向WT小鼠海马CA1注射红藻氨酸(KA)诱导慢性TLE模型,利用化学遗传学手段做进一步验证。在下托及其下游区域(包括ANT和EC)中检测到mCherry免疫活性的强烈表达(图4a,b)。在ANT局部应用CNO显著减少了FSs的数量和时间(图4c-e)。在一些小鼠中,还检测到了行为sGSs。CNO处理减少了CaMKIIα-hM4DiSUB-ANT小鼠中sGSs的数量和时间(图4f,g)。
图4h显示了CNO注入前后的代表性EEG和相应的功率谱。相反,当CNO局部注射到EC中时,CaMKIIα-hM4DiSUB-EC小鼠中FSs和sGSs的数量和时间均增加(图4i-m)。这些数据表明,下托锥体神经元通过不同的下游环路对海马癫痫发作进行差异调节,其中SUB-ANT和SUB-EC对海马癫痫发作起相反的作用。
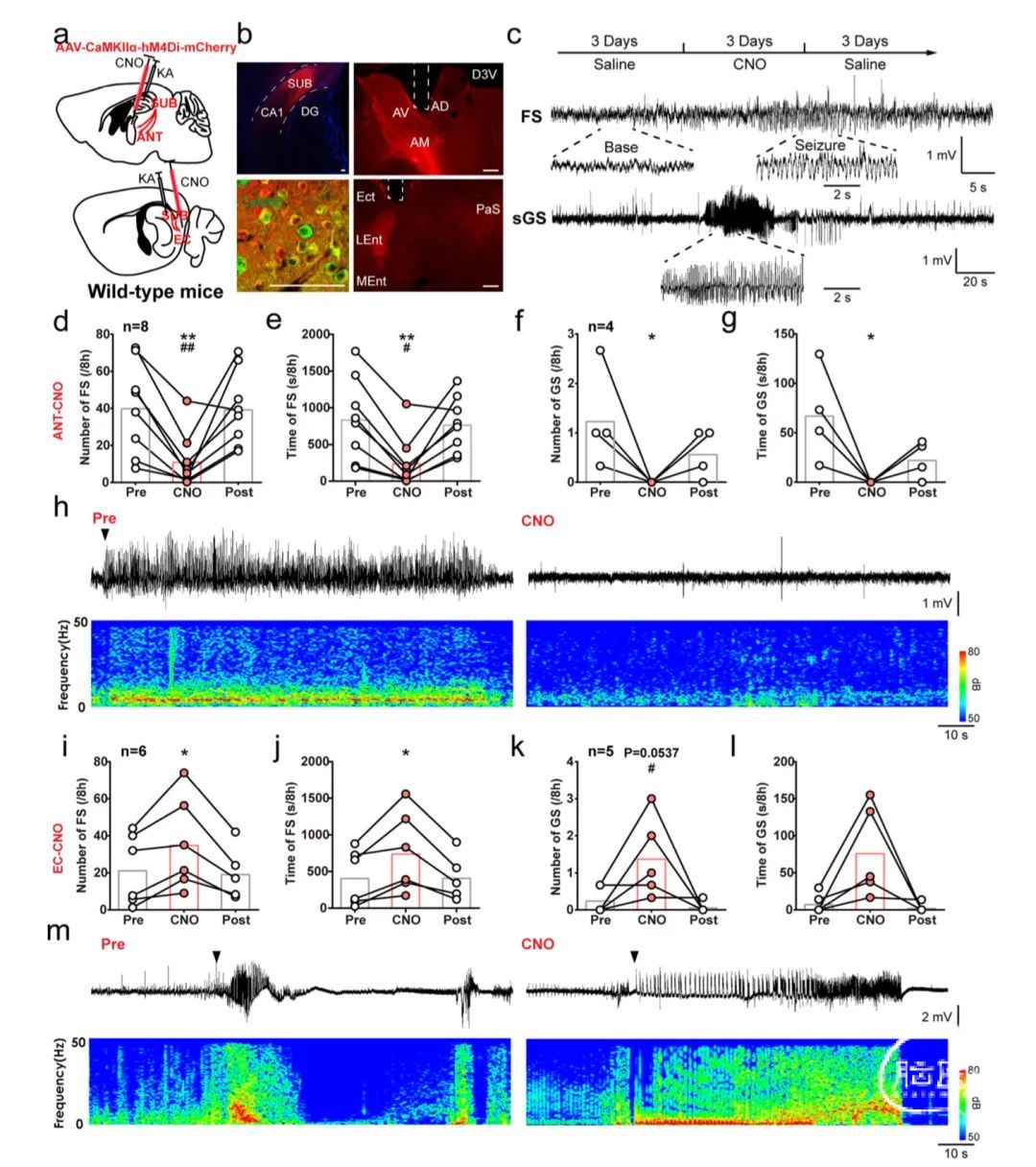
图4 KA诱导的慢性TLE模型中SUB-ANT和SUB-EC环路对海马癫痫发作具有相反影响
基于上述结果,研究人员首先使用与Alexa Fluor-555和647缀合的霍乱毒素B亚单位(CTB-555与CTB-647,图5a,B)进行逆向追踪。可以观察到,ANT投射神经元几乎完全位于深部,而EC投射神经元主要分布在浅层。这种分布在前后轴上是一致的(图5c,d)。这些结果表明,大多数投射到不同下游区域的下托神经元具有结构异质性。将AAV-Ef1α-DIO-轴突-GCaMP6(s)引入CaMKIIα-cre小鼠的下托,将光学套管立体定向植入每只小鼠的ANT和EC,并监测海马癫痫发作期间的钙荧光变化(图5e,f)。ANT和EC末端表现出不同的神经活动。在FSs期间(图5g),ANT末端表现出钙信号增加,而EC降低(图5h,i)。在sGSs期间(图5j),ANT末端的荧光随着癫痫发作的发展而延迟增加(图5k,l);而在EC终末,荧光暂时增加(对应于GS的行为潜伏期),但随后甚至低于基线,在sGS终止后持续很长时间(图5m,n)。这些结果表明,这两个锥体神经元亚群对海马癫痫发作的功能反应完全不同。
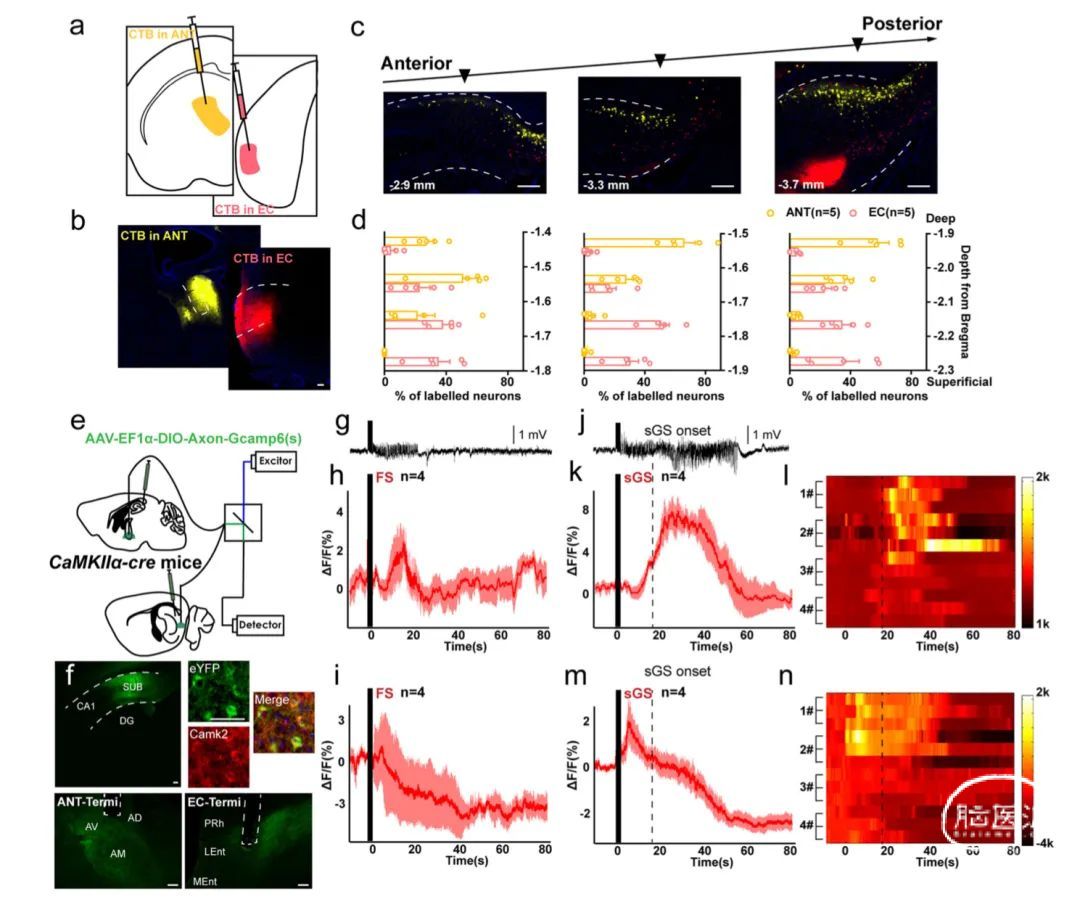
图5 ANT投射和EC投射的下托神经元亚群对海马癫痫发作有不同的反应
研究人员进一步在下托中进行体内多单位记录(图6a)。通过后期验证,确定记录单元在深层(SUBa, ANT-投射神经元的主要位置)或浅层(SUBb, EC-投射神经元的主要位置)的位置。虽然SUBa和SUBb中的单位在其平均发射速率上没有区别,但SUBa中单位具有更强大的突发放电能力(每分钟突发次数更高,图6b-d)。为了更准确地识别和表征环路特异性的下托神经元,接下来进行了基于CTB的切片电生理学(图6e)。在ANT注射CTB-555,并在下托进行膜片钳记录。几乎所有的ANT投射神经元都分布在定义为SUBa的区域。每个记录细胞在超过阈值(100Pa)的情况下以规则的尖峰或簇状方式放电(图6f)。凹陷比率在ANT投射的突发神经元中较高,但在ANT投射规则放电神经元和非ANT投射神经元中中等(图6g)。同时,ANT投射神经元中的Ih密度也显著大于非ANT投射神经元(图6h)。这些电生理特性由体细胞超极化激活的环核苷酸门控阳离子(HCN)通道介导。
结果,ANT投射的簇状神经元显示出更高的突发放电强度,其突发动作电位中出现更多的尖峰和更短的尖峰间隔(图6i,j)。使用选择性HCN通道阻断剂ZD7288(图6k-m)可以减少这种强烈的突发性放电,表明HCN通道有助于增强ANT投射的下托神经元突发性活动。这些数据表明,ANT投射和EC投射的下托神经元亚群具有结构和功能异质性。
具体而言,主要分布在下托深层的ANT投射锥体神经元显示出增强的HCN通道介导的簇状放电额能力,并且容易被海马癫痫发作激活。
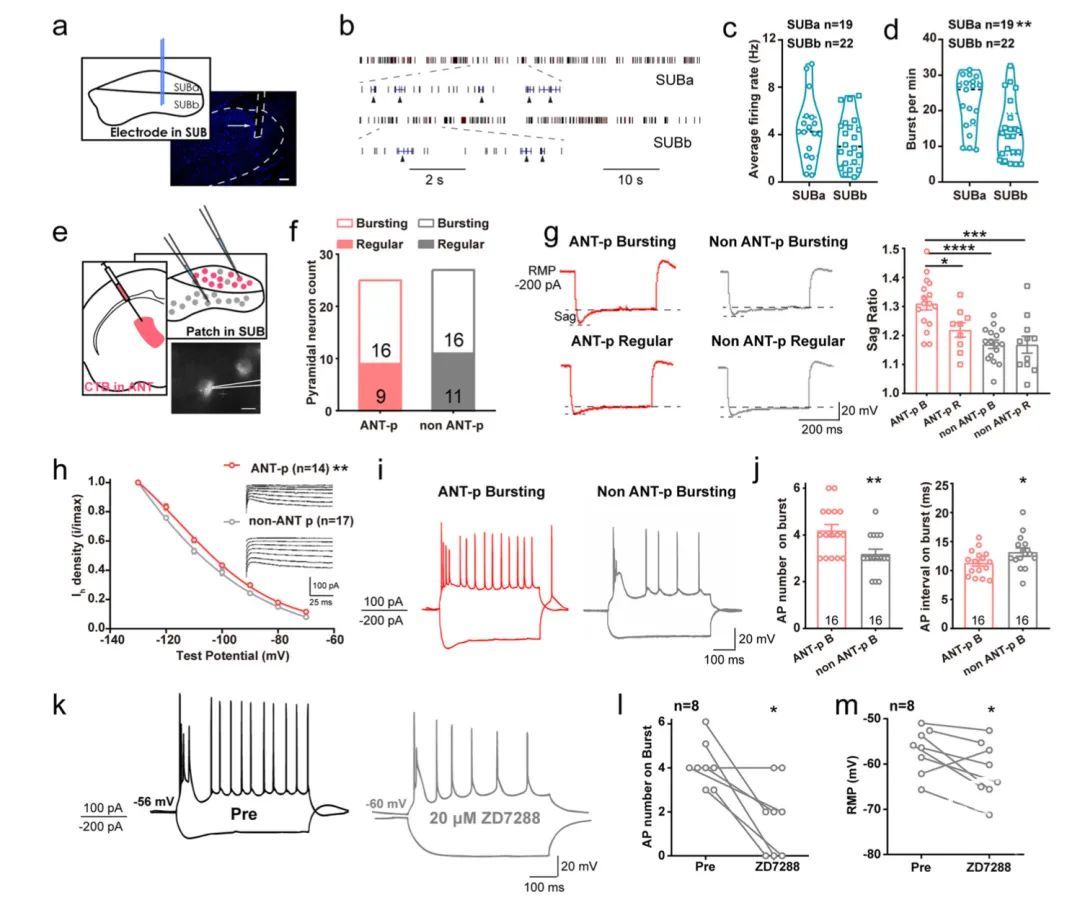
图6 ANT投射的下托神经元在HCN通道介导下显示出更强的簇状放电强度
鉴于ANT投射神经元显示出比其他下托锥体神经元更大的超极化凹陷和突发能力,研究人员试图测试这些神经元中的HCN通道功能是否直接导致海马癫痫发作。
首先将ZD7288注射到小鼠的下托中。在sGS表达过程中,对HCN通道的体内阻断显著且剂量依赖性地降低了发作期、ADD、GSD和sGS的发生率(图7a,b)。由于HCN1亚型是在啮齿动物下托中表达的最丰富的HCN通道亚型,研究人员进行了选择性地敲减抑制HCN1活性。为此,将逆行Cav2-cre病毒注射到野生型小鼠的ANT或EC中,然后将AAV-EF1α-DIO-miR30shRNA(Hcn1)-mCherry病毒注射到下托中(图7c)。选择性地敲减ANT投射下托神经元中HCN1的表达减轻了海马癫痫发作,而敲低EC投射的下托神经元中HCN1通道没有影响(图7d)。
这些结果表明,ANT投射的下托神经元HCN通道功能参与海马癫痫发作。在海马癫痫的泛化过程中,下托锥体神经元的簇状放电发挥重要作用。
研究人员引入了单脉冲测试来测量癫痫中SUB-ANT通路的突触可塑性:在下托施加单个电刺激,并记录ANT的电压响应(图7e)。随着刺激电流的增加,记录在ANT中的电压逐渐增加,最终达到饱和。选择感应最大电压一半的电流作为测试电流(图7f)。
下托HCN通道的阻塞和SUB-ANT环路的光遗传抑制都抑制了ANT中的单个脉冲,表现为场兴奋性突触后电位(fEPSP)的较低振幅和斜率(图7g-i)。总之,这些结果表明,SUB-ANT环路中基于HCN通道的突触可塑性促进海马癫痫发作的发展,而抑制该环路HCN通道额能够阻断海马癫痫发作。
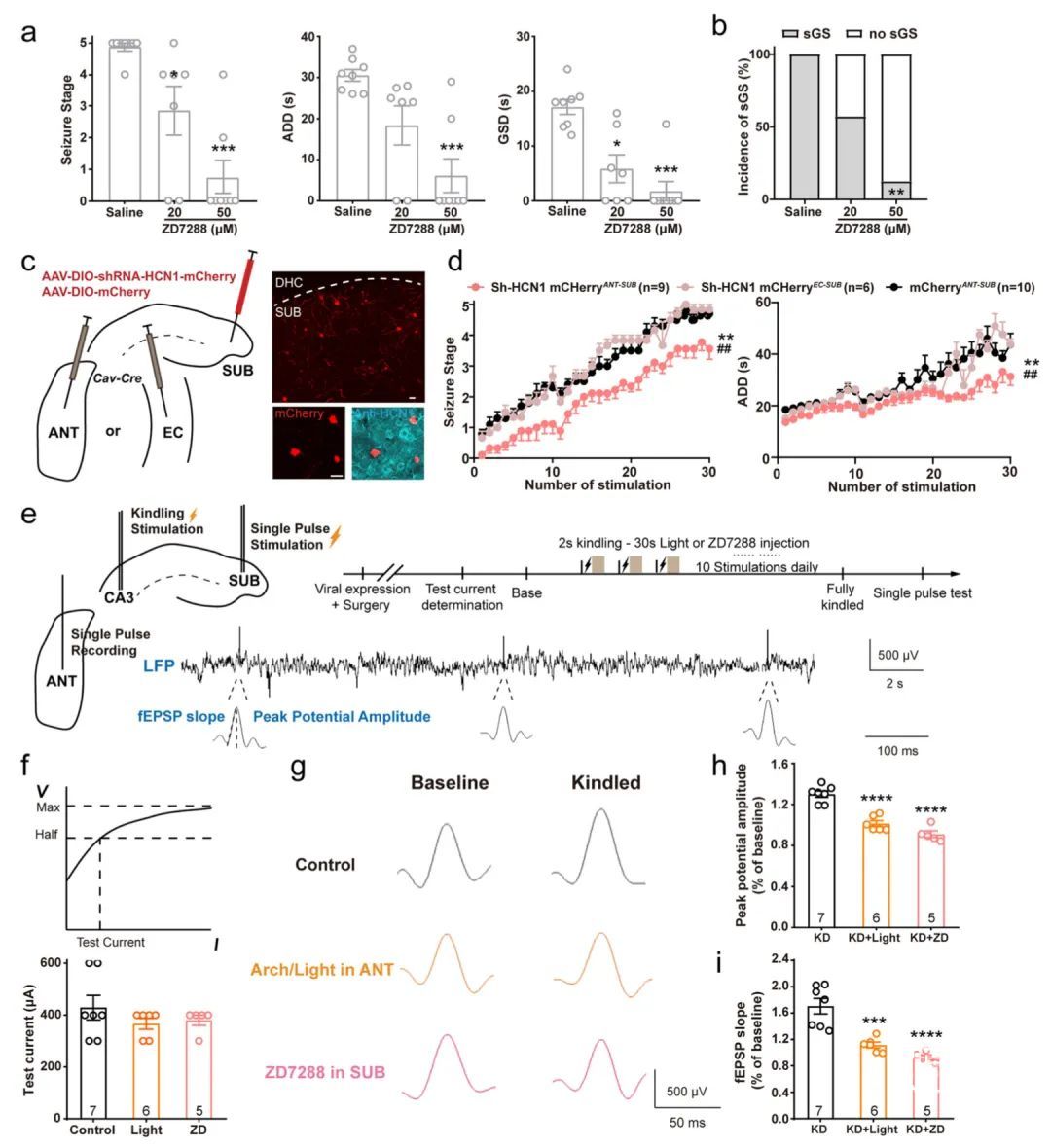
图7 SUB-ANT环路中基于HCN通道的突触可塑性促进海马癫痫发作
综上,该项研究结果证实了下托神经元在结构和功能上是异质的,并且通过不同的下游靶点在TLE中具有相反的作用。
特别是,在ANT投射的下托锥体神经元中,内在增强的簇状放电强度有助于突触可塑性和癫痫的泛化。这些结果揭示了在癫痫发作过程中针对下托进行精确干预的治疗意义。

参考文献(上下滑动查看)

✦往期精彩回顾✦


声明:脑医汇旗下神外资讯、神介资讯、脑医咨询、AiBrain所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享。