
撰稿 | 随艺
排版 | AiBrain 编辑团队

应激反应是由感知到的压力源触发的同种异体机制。这种自然的适应性反应有助于生物体应对和克服压力情况,并且主要由下丘脑-垂体-肾上腺(HPA)轴介导。然而,反复暴露于压力事件会导致慢性HPA过度激活,对几个身体系统产生有害后果。
慢性压力(CS)会影响大脑结构和功能,多项研究表明,受CS高度影响的大脑区域之一是纹状体,导致纹状体介导的行为受损。因此,CS是许多神经精神疾病的公认危险因素。尽管有证据表明CS暴露时纹状体功能障碍,但其在细胞,分子和突触水平的神经生物学后果以及这些如何影响神经精神运动症状仍然难以捉摸。
2022年11月29日,葡萄牙布拉加米尼奥大学医学院的Patricia Monteiro课题组在Nature Communications上发表了题为“Chronic stress causes striatal disinhibition mediated by SOM-interneurons in male mice”的研究文章,该研究报道CS通过影响GABA能中间神经元群和生长抑素阳性(SOM)中间神经元来改变雄性小鼠的背侧纹状体(DMS)环路的功能。


作者首先以不同的方式将雄性小鼠暴露于不同的日常压力源中,以模仿日常生活中遇到的压力源的不可预测性和可变性。在慢性压力暴露21天后,作者检查了所有小鼠的个体体重,肾上腺和胸腺,以评估慢性HPA轴激活的后果。结果显示,应激组的小鼠体重增加减少(图1a),肾上腺重量增加(图1b)和胸腺重量降低(图1c)。此外,当放置在矿场(OF)竞技场时,应激小鼠组表现出显著增加的运动,并且与同窝非应激对照小鼠相比,更有可能避开其明亮的中心区域(图1d)。这些结果表明,动物产生了与HPA轴慢性激活一致的生理改变。
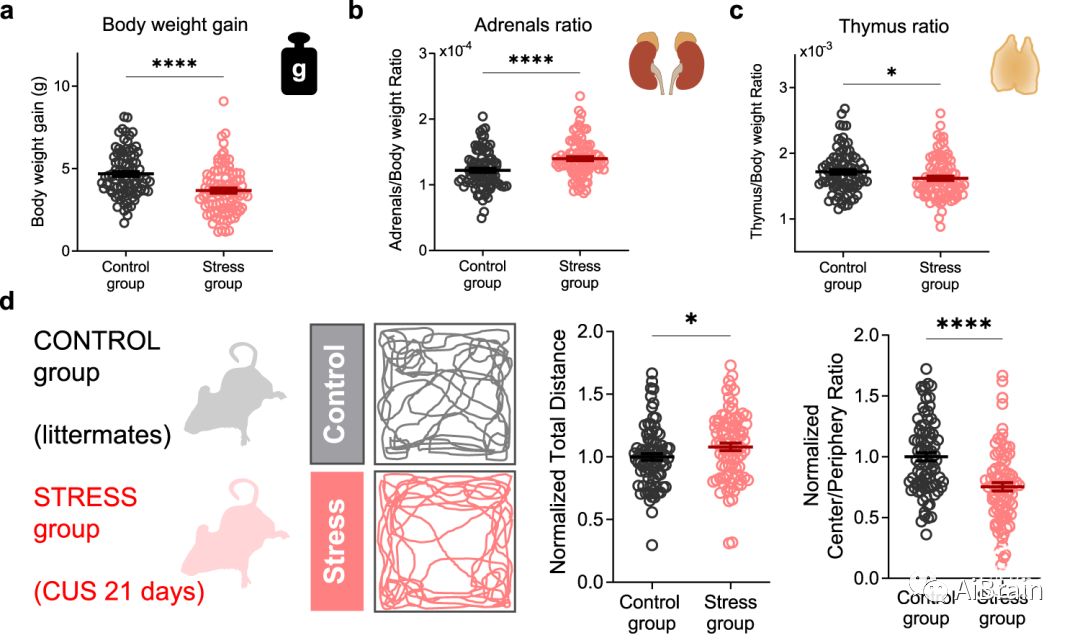
图1:慢性应激诱导的生理表型分类。

为了剖析CS对纹状体环路的分子影响,作者首先对对照组和应激小鼠的纹状体样品进行了无偏定量蛋白质组学分析(图2a)。使用SWATH-MS方法,作者鉴定和定量了2328种纹状体表达蛋白。Reactome数据库的全基因组概述和通路分析表明,在2328个蛋白质中,160个蛋白质在神经元系统的通路中过表达(图2b)。
当观察对照和应激样品之间这160种神经元蛋白的富集时,作者发现CS下调的前十种蛋白质包括由GABA能中间神经元表达的五种蛋白质(γ-氨基丁酸(GABA)受体α3,β1和γ2,Shank1,DLGP1),以及与抑制性突触相关的四种蛋白质(GABA受体α3、β1和γ2、SLIK5)(图2c)。这些结果表明纹状体抑制途径和GABA能中间神经元具有很强的收敛性。
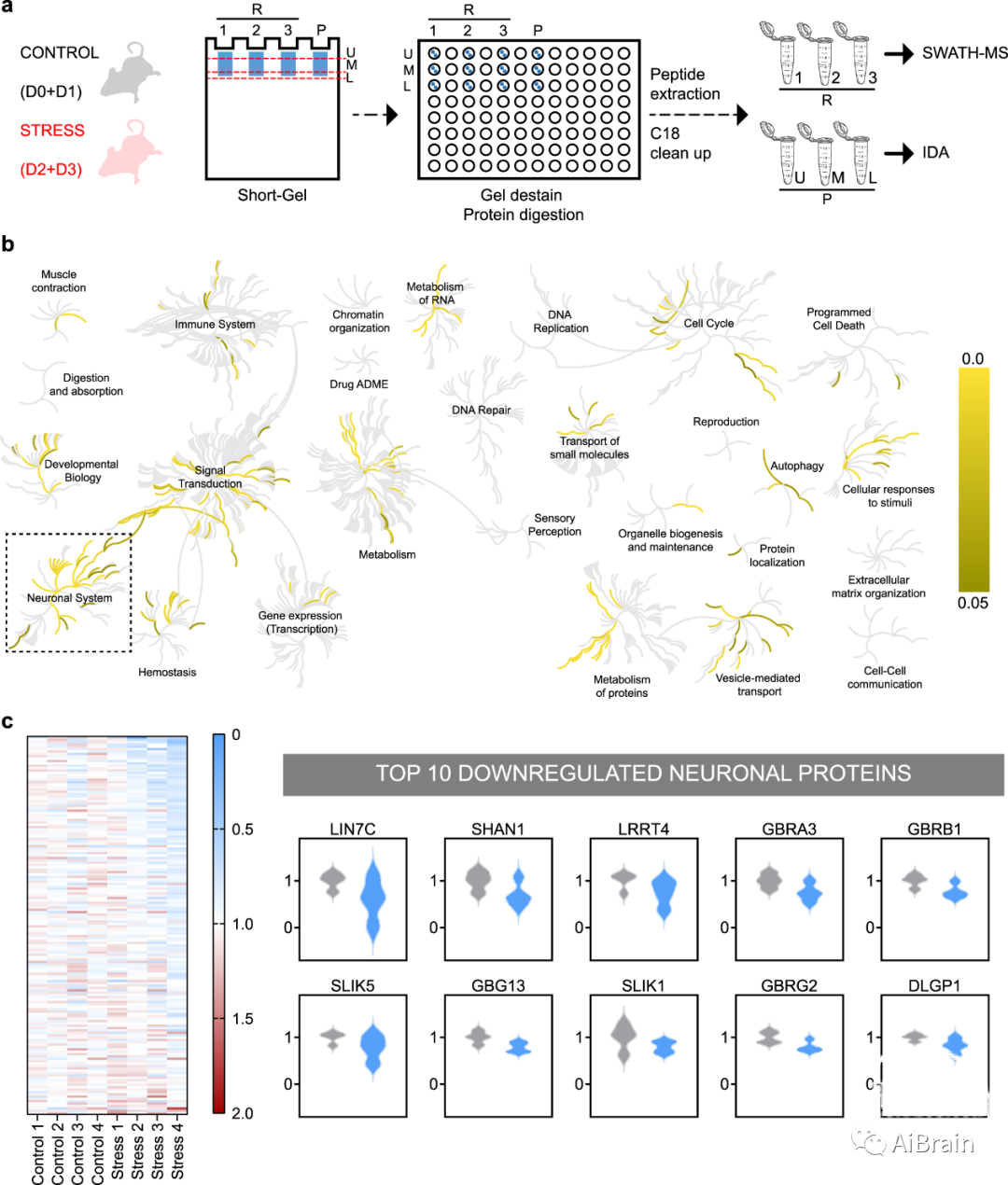
图2:液相色谱-质谱(LC-MS)分析揭示了慢性应激后纹状体的蛋白质组学变化。

鉴于蛋白质组学数据表明CS可能影响GABA能中间神经元,作者决定在麻醉小鼠中进行电生理记录,以评估CS对在体纹状体中间神经元的功能影响。
首先,作者利用在CS后对FosB/∆FosB进行了脑免疫组织化学定量,探究了CS是否会影响整个纹状体或任何纹状体区域。结果显示,背侧纹状体(DMS)区域表现出强烈的FosB/∆FosB荧光信号。与对照同窝小鼠相比,反复暴露于应激的小鼠在DMS区域中显示出FosB/∆FosB阳性细胞的数量显著增加(图3a,b),并且每个细胞的FosB/∆FosB荧光强度更高(图3a,c,d)。
接下来,作者在DMS中进行在体电生理记录(图3e),以检查CS是否会在功能水平上影响纹状体环路,特别是影响GABA能中间神经元,正如神经蛋白质组学结果所表明的那样。根据尖峰波形的特征,对照组和应激小鼠中所有记录的单个单元中有95%被归类为MSN(图3f,g),在根据两种细胞类型对所有单个单元进行分类后,数据显示中间神经元在应激小鼠中表现出降低的平均放电率(图3h),这表明CS正在损害纹状体中间神经元的功能。相反,相同的电生理记录显示应激小鼠的MSN放电率增加,揭示了纹状体中间神经元放电减少的情况,伴随着MSN的去抑制/过度激活(图3i)。这些发现共同表明,中间神经元对MSN的抑制控制丧失,导致慢性应激后纹状体环路的异常持续激活。
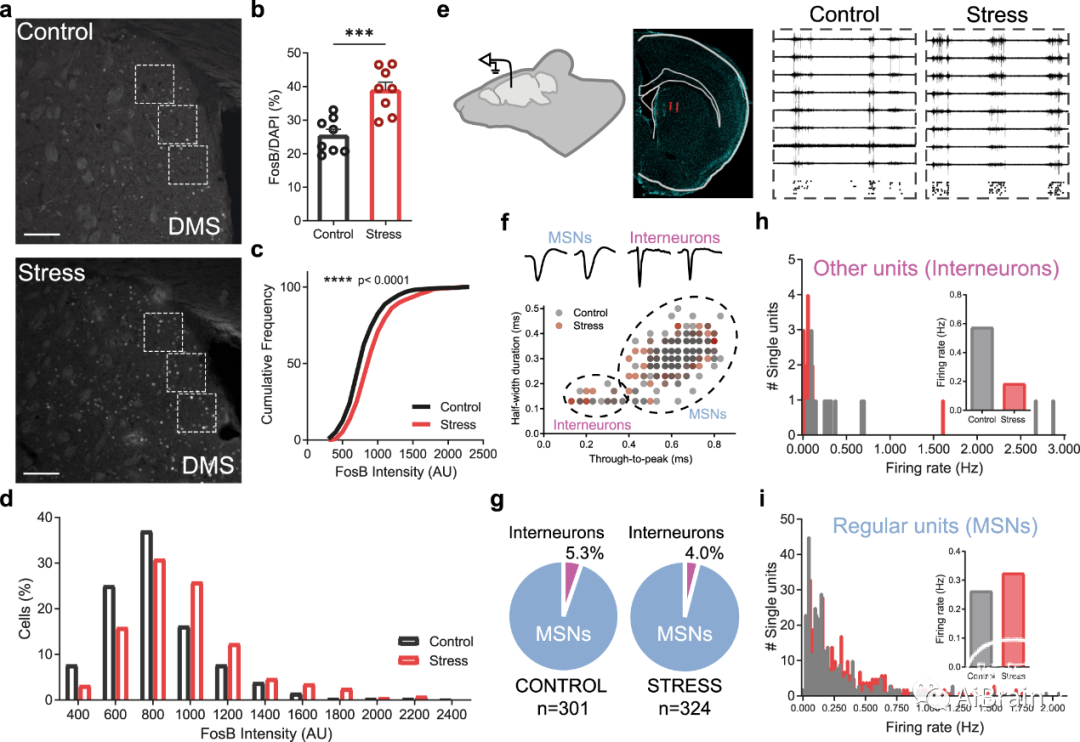
图3:慢性应激损害纹状体中间神经元,并在体内引起纹状体去抑制。

为了剖析哪些人群受到CS的影响,作者对SOM-Cre小鼠的PV(图4a)和SOM中间神经元(图4f)进行了离体膜片钳电生理记录。微型抑制性突触后电流(mIPSC)的记录显示,应激小鼠在PV中间神经元中表现出较高的频率(图4b),在SOM中间神经元中表现出较低的mIPSC频率(图4g),而幅度没有显著差异(图4c,h)。这表明CS对纹状体的影响是细胞类型特异性的,可能导致PV中间神经元中抑制性突触总数的上调和SOM中间神经元的相反减少。
作者还观察到PV中间神经元的mIPSC衰减增加(图4d),但在上升时间(图4e)和SOM中间神经元的mIPSC动力学(图4i,j)中没有变化。mIPSC衰减而不影响上升时间的这种差异可能是由于GABA-A受体亚型的突触组成不同,为了检验这种可能性,作者进行了一系列额外的急性脑切片电生理实验。
为了避免与不同水平的ChR2表达相关的问题,作者使用了遗传靶向策略而不是病毒介导的ChR2表达。PV-Cre和SOM-Cre小鼠与Ai27D小鼠杂交,Ai27D小鼠在暴露于Cre重组酶后表达ChR2/tdTomato。结果显示,在应激小鼠中表达ChR2的PV中间神经元的光刺激在MSN上诱发的向内电流量没有差异(图4l)。相反,当在应激小鼠中刺激表达ChR2的SOM中间神经元时,纹状体oPSC(opto-evoked postsynaptic currents)的峰值振幅和面积显著减小(图4n),揭示了慢性应激下,SOM-MSN突触连接响应发生了非常显著的改变。
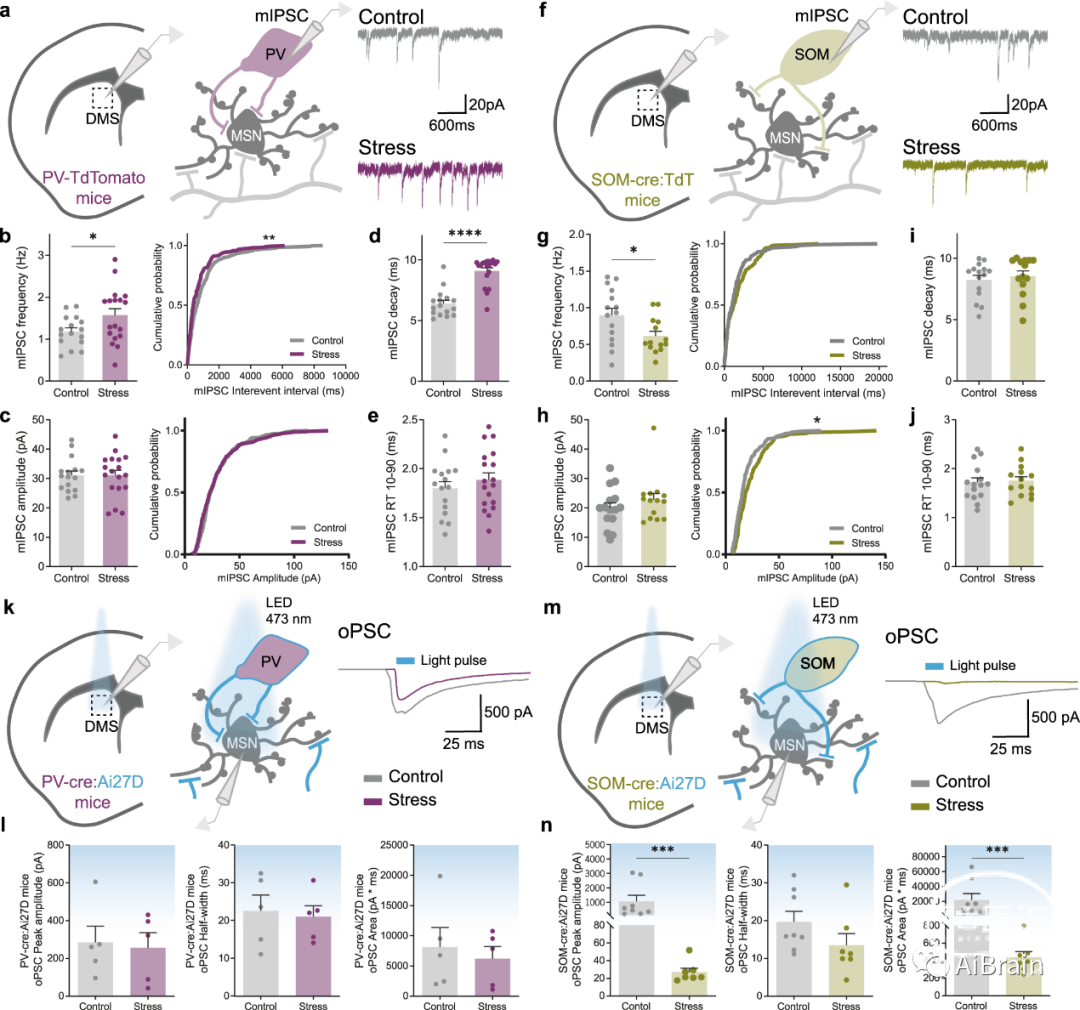
图4:纹状体SOM中间神经元是慢性应激的主要靶标。

为了测试SOM中间神经元对MSN的控制丧失是否可能介导应激诱导的纹状体行为表型,作者对对照和应激小鼠的SOM中间神经元进行了化学遗传病毒操作(图5a)。结果显示,与对照组相比,应激小鼠具有运动过度表型,并且应激小鼠中SOM中间神经元的激活足以将运动降低到对照水平(图5b)。
作者还进行了无监督的行为表型分析自发行为的潜在结构。使用 DeepLabCut来自旷场探索的无标记姿势估计作为概率机器学习的输入,作者将多元信号聚类为38个行为基序。然后将这些基序分组到具有事后粗略行为标签(如行走(walk),转身(turn),后仰(rear),梳理(groom))的基序群落中(图 5c)。检查SOM激活和非激活的对照和应激小鼠之间基序使用的差异,揭示了组间不同的几个基序(图5d)。
社区行为(behavioral communities)的进一步比较显示,应激小鼠的行走增加,在SOM中间神经元的纹状体激活后可以恢复到控制水平(图5e)。此外,作者发现自我梳理(一种已知在暴露于应激时受到抑制的自然行为,self-grooming)在CS小鼠中减少,但可以通过激活纹状体SOM中间神经元来恢复(图5e)。这些结果表明纹状体SOM中间神经元特别容易受到慢性应激的影响,并且操纵其活性足以调节应激小鼠的运动表型。
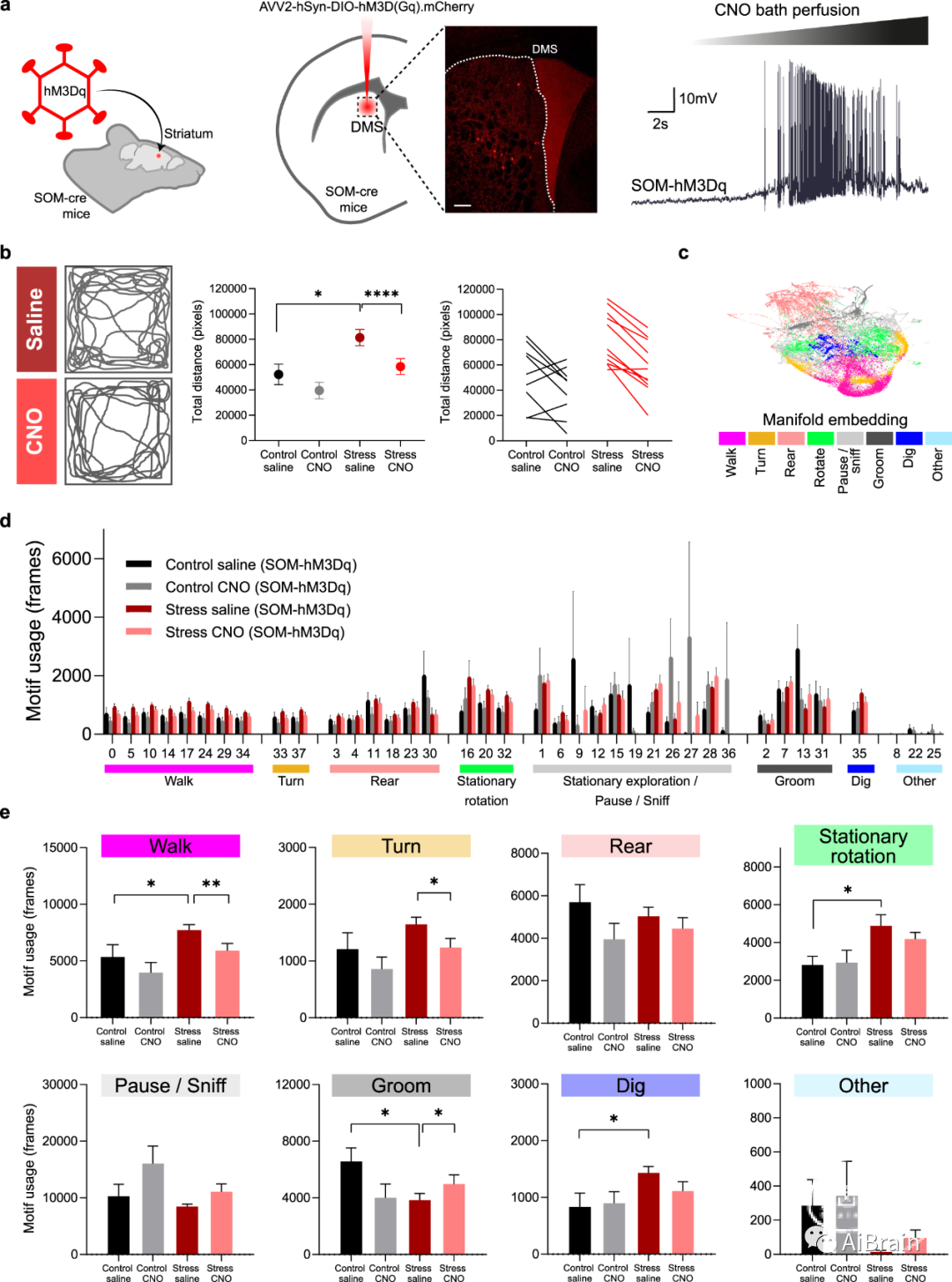
图5:应激小鼠纹状体SOM中间神经元的体内操作逆转了应激诱导的运动行为表型。
综上所述,本研究表明CS对纹状体GABA能中间神经元群的影响不同,SOM中间神经元特别脆弱。
虽然这项研究揭示了CS和行为运动症状之间的机制联系,但应该注意的是,长期压力暴露的行为表现是一系列可分离的行为症状,这些症状可能依赖于不同的大脑区域和不同的神经元微环路。
了解纹状体环路如何导致压力诱发的运动症状并不能完全解决焦虑、强迫症或创伤后应激障碍的神经基础,但肯定是建立症状特异性治疗的重要一步。因此,这些发现可能为压力相关神经精神疾病的转化研究提供有价值的见解。
参考文献(上下滑动查看):
AiBrain内容团队为大家整理了文章的pdf,如有需要,请公众号后台留言“pdf”或扫码添加AiBrain助手微信获取。


✦往期精彩回顾✦


声明:脑医汇旗下神外资讯、神介资讯、脑医咨询、AiBrain所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享。