
撰稿 | 严贵忠
排版 | AiBrain 编辑团队

运动是动物和人类共有的基本行为。很多行为的表达需要借助运动,如朝着目标前进的认知欲望,或探索环境的情感冲动。
运动的产生需要神经系统运动环路在多个层次整合。运动的执行,需要在精确的时间内激活特定的肌肉并并精确协调,很大程度上通过脊髓本身的神经网络的活动来完成。运动的规划,发生在脊髓上的结构,包括皮质运动区和基底节。
然而,脊髓环路的直接中枢控制区位于脑干,脑干对运动的开始、速度、终止和方向施加控制。脑干环路由于其组成异质性,传统上很难解剖。电生理学、分子遗传学、网络和行为学方法为理解这些环路铺平了道路,这些方法将特定的神经元群体与行为的不同方面联系在一起。
近期,丹麦哥本哈根大学Roberto Leiras教授团队,对哺乳动物脑干运动环路的最新研究进展进行了综述,讨论了指令如何实现运动的启动、停止和转向,以及这些指令如何与脊髓中的执行环路相互作用。还阐述了脑干运动环路如何在不同的行为环境中被选择,以及关于控制运动的大脑、脑干和脊髓网络的整合功能尚存在的问题。综述以“Brainstem Circuits for Locomotion”为题,近期发表于Annual Review of Neuroscience杂志上。

重
磅
综
述

此前,AiBrain对另一篇重量级综述也进行过介绍。鉴于综述篇幅,AiBrain分为四部分,以专题的形式为读者带来详细的解读。欢迎感兴趣的读者点击查看:

运动控制的一个关键功能是启动或开始运动。脊髓中的运动执行网络被适当激活时,能够产生并维持由协调的肌肉活动组成的运动输出。这种对脊髓运动网络的兴奋性命令或启动信号起源于脊髓上区域。
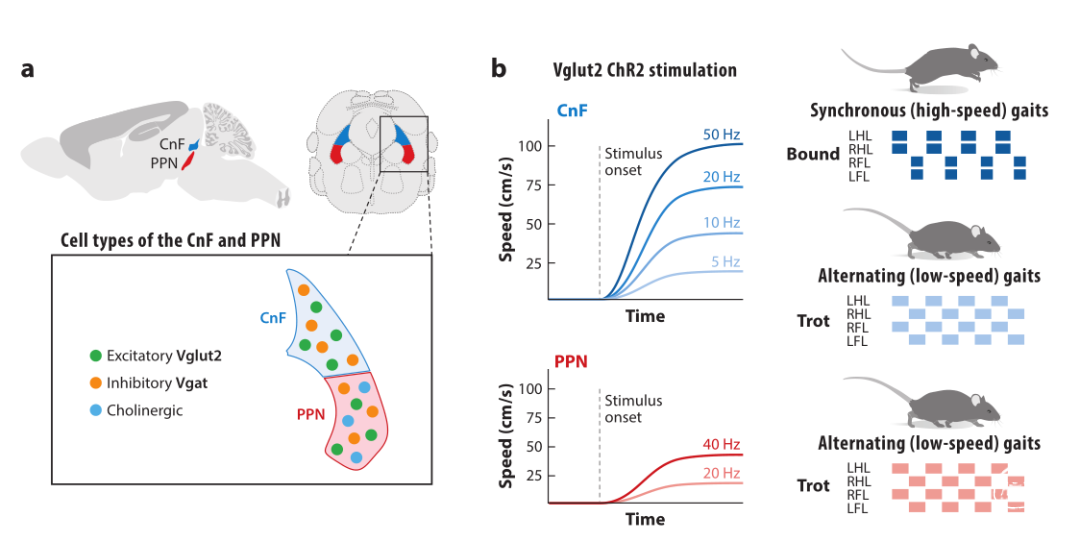
电刺激中脑楔形核(CnF)内或周围区域时启动运动。刺激强度不同引起不同的步态,低刺激强度表现为行走,稍高刺激强度时为小跑,更高刺激强度时为奔跑。将这个中脑区域命名为中脑运动区(MLR)。
MLR的性质和解剖位置仍然是一个争论的问题。除了CnF,脚桥核(PPN)也是MLR的主要组成部分。使用电或化学刺激方法证明,猫的PPN或大鼠的尾侧PPN是MLR的主要组成部分,特别是尾侧的大型胆碱能神经元。虽然电刺激和化学刺激实验表明CnF和/或PPN足以启动运动,但损伤这些区域出现了相互矛盾的结果,在一些研究中,PPN或CnF的损伤不会影响自发运动,而在其他研究中,PPN的损伤会导致运动活动减少或步态障碍。因此,从功能上定义的MLR指向了脑干中的两个不同区域:CnF和PPN。
CnF和PPN是中脑紧邻的结构,包含有兴奋性长程投射的神经元,在CnF中是谷氨酸能,在PPN中是谷氨酸能和胆碱能。CnF和PPN中的兴奋性神经元也与抑制性中间神经元混合在一起。因此,电或化学刺激实验或广泛的损伤研究无法区分激活或损毁的神经元性质。
光遗传激活表明,CnF中表达囊泡谷氨酸转运体Vglut2的谷氨酸能神经元的激活可以启动从静止到短潜伏期的运动,并调节小鼠正在进行的运动速度。CnF-Vglut2神经元允许获得完整的运动速度和步态,在较低的刺激频率下为低速交替步态,如步行和小跑;在较高的刺激频率下为高速步态,如疾驰和跳跃。PPN尾侧的PPN-Vglut2神经元的光遗传刺激也启动了小鼠和大鼠的运动。
与CnF相反,PPN激活仅导致缓慢交替的运动步态。而启动高速步态(疾驰和跳跃)依赖于CnF中的谷氨酸能神经元而非PPN-Vglut2神经元,表明神经元活性编码了运动节律的频率。
其他研究无法证明通过刺激PPN-Vglut2神经元可以启动运动,但在不运动的动物中刺激这些神经元会引起时相性肌肉活动或强直性肌肉活动。研究之间的结果差异可能反映了不同的靶向方法和/或刺激模式导致PPN-Vglut2神经元不同亚群的激活。事实上,PPN的谷氨酸能神经元亚群混合在一起,并表现出与不同身体动作相关的神经元活动,包括直立、身体伸展和运动,这些神经元根据其向基底节、脊髓或髓质的不同轴突投射而分层。选择性光遗传刺激投射到黑质网状部的PPN-Vglut2神经元引起运动的抗动力调节。此外,PPN-Vglut2神经元的运动促进作用仅限于尾侧PPN,PPN嘴侧的谷氨酸能神经元控制全身运动停止。因此,广泛靶向PPN-Vglut2神经元将导致不同的效应。
PPN胆碱能神经元的激活对运动有不同的研究结果:可能没有影响,降低,或略微提高正在进行的运动速度。这些实验强烈表明,哺乳动物中的PPN胆碱能神经元并非是运动指令的必要部分,尽管它们的活动可能通过上行联系调节正在进行的运动(图1)。
细胞类型特异性研究显示,速度依赖性运动控制位于PPN和CnF的谷氨酸能神经元中。这两条独立的启动指令通路以互补的方式编码运动速度。尾侧PPN-Vglut2神经元支持探索性运动,而CnF-Vglut2神经元对于逃跑反应的高速运动是必要的。运动启动的双通道通过CnF-和PPN-Vglut2神经元的不同输入连接来反映。PPN-Vglut2神经元接收来自基底节的强输入,包括来自黑质网状部(SNr)和致密部(SNc)和丘脑底核(STN),以及皮质区和传递感觉运动信息的几个脑干区。CnF-Vglut2神经元的输入比较局限,来自SNr的输入较弱,但来自导水管周围灰质和上丘(SC)的输入较强,这两者都与逃避行为有关。
△上下滑动查看△

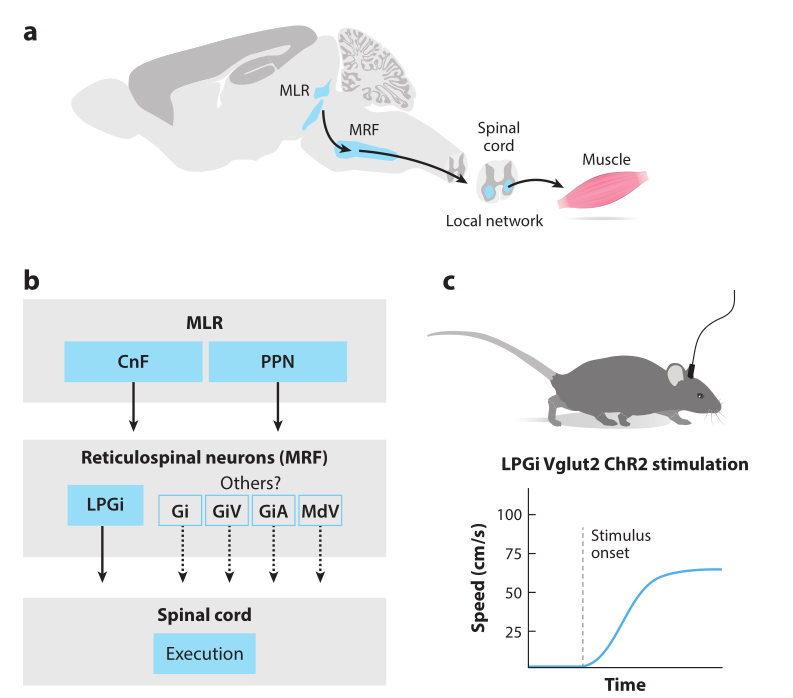
来自MLR(CnF/PPN)的运动启动信号并不直接作用于脊髓的执行环路。MLR起始神经元首先连接到脊髓网状神经元,再向脊髓的运动网络提供最终命令信号(图2)。脑干中的解剖追踪和电/化学激活实验表明,延髓网状结构(MRF)中的神经元,包括网状巨细胞核(Gi)和网状大细胞核(Mc)的神经元,可能介导来自MLR的最终运动命令。位于这些区域的两个主要神经元群被认为是:5-HT能神经元和谷氨酸能神经元。
实验表明5-HT能引起离体脊髓的运动活动,并且电刺激锥体束旁核的5-HT能神经元可以启动运动。脊髓的谷氨酸能激动剂也可以启动运动,表明CnF诱发的运动通过下行网状脊髓神经元传递,并且CnF诱发的运动可以通过脊髓中谷氨酸能受体阻断而被中断。然而,由于脊髓中产生运动节律的环路本身是谷氨酸能的,药理学干扰仅提供了下行谷氨酸能信号存在的间接证据。光遗传实验证实了脊髓网状指令的谷氨酸能性质,广泛光遗传刺激脑干谷氨酸能神经元可以在分离的脑干-脊髓中启动运动样活动。
通过研究Mc亚结构域中神经元类型特异性功能发现,Mc亚结构域由位于外侧副巨细胞细胞核(LPGi)和Gi本身中的巨细胞细胞核(GiA)的α部分和巨细胞细胞核(GiV)的腹侧部分组成。光遗传刺激LPGi谷氨酸能神经元,引起了自由运动小鼠向前运动的启动(图2)。广泛刺激Gi谷氨酸能神经元不能启动运动。GiA、GiV或Gi中抑制性神经元的光遗传激活破坏或阻止了运动。这些实验表明LPGi是一个重要的脊髓网状运动指令节点,调节高速运动的表达。因为,有研究观察到,促进运动的CnF神经元到LGPi有很强的投射并且证明了消融LPGi-Vglut2神经元能减弱CnF-Vglut2诱导的运动。尽管如此,CnF-Vglut2神经元也投射到GiA和GiV,促进运动的PPN-Vglut2神经元投射到不同的MRF核,包括LPGi,Gi,GiA,GiV和延髓网状结构腹侧部分。
因此,下行谷氨酸能运动通路很可能在脑干网状结构中有几个起源,形成对应于从CnF和PPN到脑干核的不同下行投射模式的平行通路(图2)。未来的实验可能会通过绘制与两个MLR(CnF/PPN)区域直接相关的行为环境中的通路来解决这个问题。
△上下滑动查看△

终止运动是运动控制的一个重要组成部分。皮质区和基底节被认为参与了正在进行的运动终止。然而,产生运动停止的特定脑干机制还不清楚。运动可以被CnF或PPN的GABA能神经元的激活而抑制。这种MLR介导的运动停止被认为反映了对启动或速度指令的抑制,而不是主动运动停止本身。
最近的研究发现了脑干运动主动停止的机制。双侧光遗传刺激Gi谷氨酸能Chx10阳性神经元停止了正在进行的运动,这种运动停止被定义为标准停止,动物完成运动循环并采用固定的坐姿。离体脊髓的运动样活动记录表明,Chx10 Gi神经元的双侧刺激可抑制腰髓两侧的脊髓运动活动,当消除Chx10 Gi神经元的突触传递后运动停止行为减少(图3)。钙成像显示,一部分Chx10 Gi神经元在自发运动停止期间是活跃的,表明它在介导停止中的积极作用。具有停止运动能力的神经元是脊椎动物神经系统的一个普遍特征。这些实验指出了一条脑干通路,它的作用是引起有意的停止运动,这种停止运动被恰当地整合到运动行为中。

△上下滑动查看△

对MLR(CnF)的实验表明,单侧刺激引起双侧、全身运动,没有方向偏差。这一发现在许多的研究中得到证实,包括刺激CnF和PPN中特异性细胞类型的研究。表明,对称性是启动运动并控制其速度环路的一种特性。CnF和PPN的神经元表现出对称性的解剖和功能特征,包括延髓中网状脊髓靶点的双侧投射和募集。此外,LPGi向脊髓双侧的投射,使对称性在网状脊髓投射的水平得到加强。
许多下行运动相关系统表现出功能对称性,迫切需要寻找能够单向调节脊髓网络的通路。Chx10 Gi神经元可以作为候选靶点,因为Chx10神经元是同侧投射的,至少在脊髓内是如此。事实上,Chx10 Gi神经元表现出向脊髓的同侧投射,在同侧灰质内它们形成分支和突触。在自由运动的小鼠中,单侧刺激Chx10 Gi神经元导致同侧偏向的运动发作,即转向,而单侧抑制Chx10 Gi神经元使运动偏向对侧。小鼠不能补偿Chx10 Gi神经元的功能障碍,表明这个细胞群对控制运动方向是必须的。
Chx10 Gi神经元的单侧激活导致同侧肌肉收缩,这些肌肉使头部围绕偏航轴旋转,并使躯干弯曲,但在动物休息时没有向前运动。因此,虽然轴向环路调整姿势,因为它涉及头部或躯干的方向,但运动方向最终是通过四肢介导的。虽然强烈的单侧光遗传激活可能会引发双侧运动停止和向同侧的轴向偏转,但更适度的光遗传激活会导致运动转向,并伴有速度下降而不停止。Chx10 Gi神经元的化学遗传刺激也引起运动偏向但不停止。这些发现暗示了转向的单边制动机制。脑干-脊髓的体外实验中,单侧Chx10Gi刺激减少了同侧屈肌相关的运动活动,促进了同侧伸肌相关的运动活动。水生脊椎动物主要使用轴向机制来控制运动方向;哺乳动物已经进化出一种制动机制,用于减少转弯内侧的步幅长度,产生围绕偏航轴的转向力矩。这种单边制动机制似乎解释了在较高运动速度下的转向,在CnF-Vglut2诱导的运动速度增加期间,小鼠制动并转向以避开障碍。
虽然转弯可能是运动不对称的一个明显例子,但人们认为平行系统可以调整与正在进行的运动节律相关的单个步骤(例如,向左或向右)。这种不对称命令被认为对与避障相关的调整和小脑适应至关重要,尽管尚不清楚哪些下行环路可能适应这些功能。此外,虽然Chx10 Gi神经元控制身体绕偏航轴的旋转,但控制身体绕俯仰轴和滚动轴旋转的下行神经元尚不清楚。

脑干环路产生运动的启动、速度、停止和转向的命令,而脊髓运动环路接收这些下行信号并将其转化为协调运动。这种转换是如何发生的,以及脊髓环路中的哪些神经元接收这些脑干命令,目前还不清楚。脊髓运动网络由抑制性和兴奋性中间神经元组成模块化结构,产生运动的主要特征:无肢体动物的节律和左右协调,以及肢体动物的屈肌-伸肌协调。
兴奋性脊髓中间神经元构成运动节律生成的核心,进而激活左右和屈肌-伸肌协调环路以及运动神经元。产生节律的兴奋环路的主要目标是将下行运动开始和速度信号转化为协调运动。事实上,很少有研究证明这种联系与假定的产生节律的神经元有关。在七鳃鳗中,延髓网状脊髓神经元的活动通过单突触激发节律性活跃的兴奋性脊髓神经元。同样,在蝌蚪中发现了兴奋性后脑神经元与节律性活跃的脊髓兴奋性神经元之间的单突触联系。在猫中,刺激CnF激活脊髓神经元(可能通过网状脊髓中间体),产生运动。基于这些研究,在脊椎动物运动网络的几个模型中提出了从MLR到兴奋性网状脊髓神经元再到脊髓节律生成神经元的连接。然而,这种联系还没有得到功能上的证实。这一假设应该可以通过实验来检验,因为在小鼠和斑马鱼中,表达转录因子Chx10(V2a中间神经元)、Shox2和/或Hb9的兴奋性脊髓中间神经元有助于产生节律(图4)。这些分子标记使得对假设的产生节律的细胞的实验成为可能。关于节律是如何建立和速度是如何编码的问题,仍有待研究。
通过增加频率激活CnF或PPN,观察到的速度依赖性步态变化是通过脊髓中不同的网络活动实现的。不同的交替(步行和小跑)和同步(疾驰或跳跃)步态是由左右协调运动环路组织的,该环路由兴奋性和抑制性联合神经元(CNs)群体组成。小鼠实验表明,运动过程中的左右交替取决于抑制性中枢神经系统直接产生的功能性交叉抑制,或兴奋性中枢神经系统作用于脊髓另一侧的抑制性神经元间接产生的功能性交叉抑制。这种双重抑制系统是通过Dbx1衍生的V0中枢神经系统实现的。V0中间神经元的完全消融导致在所有运动速度下左右交替的完全丧失。抑制性背侧V0中间神经元(V0D)控制低速运动时的交替运动。兴奋性腹侧类(V0V)神经元组成了V0中间神经元的另一半,控制着高速运动时的交替。在缺乏V0V CNs的情况下,突变小鼠不表现出小跑,而在消融V0V和V0D CNs的情况下,小鼠只能跳跃。因此,这种双重系统在协调交替步态(行走和小跑)中起着速度依赖性的作用,并允许在受抑制时表达同步步态。

△上下滑动查看△
CN实现了独立于运动节律的模式控制,这表明CnF/PPN和网状脊髓介导的运动命令以V0 CNs为目标,以产生行走、小跑和跳跃之间的步态转换(图4)。最近的一项建模研究提出了速度和步态变化如何通过脊髓环路实现的假设。在这个模型中,PPN、CnF和LPGi神经元可以分别通过两条线路控制速度和步态。速度是通过产生节律的神经元来实现的,而步态是通过CNs的V0V和V0D以及脊髓前肢-后肢连接神经元来实现的。
Chx10 Gi介导的运动停止通过对脊髓中间神经元的直接作用而产生,主要影响控制节律产生的神经元。由于Chx10 Gi下行信号是兴奋性的,因此运动停止的机制是通过直接或间接通过局部兴奋性神经元激活脊髓抑制性神经元。对于运动的转向,Chx10 Gi神经元对节律产生具有不对称的影响,通过减少屈肌收缩和增强伸肌收缩,导致转向内侧的步长减少。这些数据表明,行动路线主要是屈肌节律生成环路。

脑干环路涉及到直接控制运动的启动,速度,停止和转转向,其中一些环路与整合系统有关。本质上,每一种依赖环境的运动行为——包括导航、觅食、躲避捕食者和探索环境——都必须与这些系统互动。脑干环路形成作用于脊髓运动环路的平行下行通路,是这些广泛行为的基础。这些指令通路充当节点,将清晰的运动输出与环境依赖的行为状态和高级大脑功能联系起来。

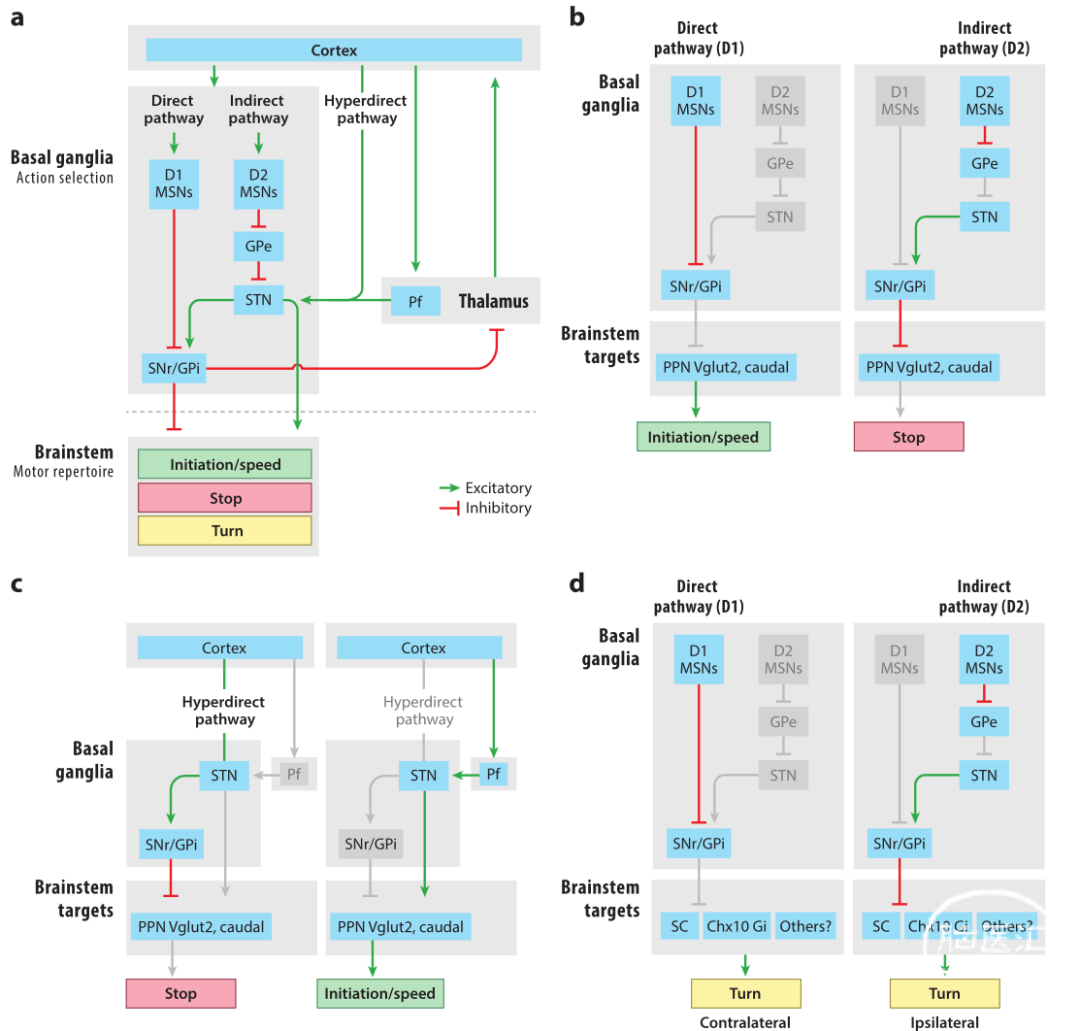
目标导向运动的规划被认为产生于运动皮层区。除了与脑干指令环路的直接连接,运动皮质区还通过基底节与脑干相连。有充分的证据表明,基底节通过经典的直接和间接纹状体通路整合参与运动行为的计划和执行。纹状体直接通路的活动导致基底节输出神经元的抑制,例如在SNr或内部苍白球(GPi)(图5)。纹状体间接通路中的活动通过增加STN的兴奋性,激活SNr和GPi/EP。直接通路的活动导致运动目标的去抑制并促进运动,而间接通路的活动抑制运动。这些作用可能通过SNr-脑干或苍白球-丘脑-皮质通路产生。
这种基底节动作选择的模型表明,直接通路介导的SNr活性降低导致MLR的抑制解除,从而促进运动的启动,而间接通路活动抑制运动。光遗传的实验支持这个模型:纹状体直接(D1R)或间接(D2R)通路中多棘神经元的双侧刺激分别促进或抑制运动。电刺激腹侧SNr对猫的CnF/背侧PPN诱导的运动具有强大的调节作用,并提出SNr主要调节CnF活动。然而,尽管SNr神经元与PPN有丰富的直接联系,尤其与PPN-Vglut2神经元形成密集投射,但与CnF-Vglut2神经元的神经支配却很弱。SNr对运动起始PPN神经元的优势投射,通过直接通路激活的运动起始是由PPN-Vglut2神经元而不是CnF-Vglut2神经元的去抑制介导的。
平行的基底节通路可能有助于募集PPN神经元来支持目标导向运动。通过进化上保守的途径,多巴胺能SNc神经元具有投向PPN的侧支轴突,这可能促进PPN神经元的活动。因此,运动开始时多巴胺能SNc神经元爆发放电的增加可能对PPN活动具有双重作用:通过直接途径去抑制,同时直接激活PPN神经元。
STN活动通过SNr(和GPi/EP)可以调节运动(图5a)。选择性消融Vglut2 STN神经元会导致过度运动,减少运动启动的潜伏期。相反,STN神经元的双侧光遗传刺激抑制正在进行的运动。这些结果符合基底节的标准模型,其中公认的是帕金森病相关的变化导致STN活性增加,引起运动抑制,并且在这种情况下消融STN可以使运动缺陷正常化。除了受外部苍白球活动的调节外,STN还可能直接受到来自皮质区的兴奋性输入的影响——超直接通路。越来越多的证据表明,超直接通路可能在无运动任务中被招募。前运动皮层-STN神经元也可以在视觉引导的运动过程中被招募来执行习得性运动停止,可能通过SNr来抑制PPN诱导的运动。谷氨酸能促进运动的PPN神经元也接收来自STN神经元的直接输入,这暗示了STN激活后的运动促进作用。最近在束旁核至STN的丘脑投射中发现了这种运动促进作用。STN-SNr-PPN和STN-PPN通路对运动的相反作用表明,在特定的行为背景下,这些通路可以被招募来停止或启动运动。
通过单侧刺激纹状体多棘神经元可以诱发转向,单侧刺激SNr或STN也会诱导转向。由于单侧MLR刺激导致对称的向前运动,因此转向必须通过平行的基底节输出通路介导,可能与Chx10 Gi神经元、SC或其他脑干靶细胞连接(图5d)。
△上下滑动查看△

运动的调节是执行防御行为的基础。在其最基本的形式中,防御行为有两种运动结果——冻结或逃跑。这两种行为之间的选择取决于环境而做出最佳决策,即是否逃离令人厌恶或具有威胁的刺激,或者保持不动以降低被发现的风险。这两种运动行为都是主动反应,运动要么急剧增加,要么突然停止。因此,控制防御行为的神经元环路必然会汇聚到脑干运动通路上。
杏仁核在防御行为中起着至关重要的作用。杏仁核中的恐惧环路与脑干运动环路相关。确定了中央杏仁核(CEA)中的抑制环路,该环路通过解除腹外侧中脑导水管周围灰质(vlPAG)中兴奋性神经元的抑制而引起冻结。vlPAG中的兴奋性神经元又投射到Mc中的网状脊髓神经元。冻结通路也接收来自背外侧中脑导水管周围灰质(dlPAG)中调节逃跑环路的输入。dlPAG逃跑环路抑制vlPAG冻结通路,确保逃跑行为的专属表达。冻结和逃跑的相互排斥的表达也表现在CEA的水平上,其中不同的抑制性神经元促进逃逸或冻结。这些抑制环路是相互连接的,这表明行为反应的选择是两个抑制性经元群体之间竞争作用的结果。
Mc信号如何准确地整合到脊髓运动环路中以引发冻反应仍是一个未解决的问题,这需要对Mc投射到脊髓神经元的功能进行分析。另一个问题是如何终止主动运动来表达冻结。运动可以通过将停止命令传脊髓执行环路或通过在CnF/PPN水平阻断运动速度命令来终止。PPN和CnF-Vglut2神经元都接收来自CEA的输入,GABA能CEA神经元与MLR神经元单突触连接。因此,这条通路可能与冻结通路同时被激活,以终止防御行为中正在进行的运动。行为和网络分析也表明,投射到CEA的基底外侧杏仁核神经元可以在动物熟悉新环境时以经验依赖的方式驱动瞬时运动停止。这种运动停止可能是由CEA抑制MLR神经元介导的。因此,CEA-MLR环路可能通过抑制运动驱动来启动停止运动,这既是防御反应的一部分,也是非防御行为的一部分。
防御性的逃跑行为是由对视顶盖或SC的视觉输入触发的。啮齿动物的经典刺激实验和损伤研究表明,内侧SC接收来自上视野的输入,SC的这一区域介导逃避反应。内侧SC对CnF有强烈的直接投射,对CnF-Vglut2神经元有特异性投射。此外,内侧SC投射到dlPAG,与逃跑反应有关。小鼠逃跑模型中,谷氨酸能dlPAG神经元通过突触阈值机制被内侧SC单突触激活,该机制只允许强刺激威胁诱发的逃避。dlPAG还表现出向CnF的直接投射,与CnF-Vglut2神经元有特定的联系。因此,高速CnF-Vglut2神经元接收来自SC的直接和间接输入。逃避行为还包括同时获取通往避难所的最佳通路,可能会招募脑干中的转向神经元。

运动的不对称有两个主要生物功能:(1)对显著环境刺激(如视觉或听觉)的定向,(2)根据内部模型或地图向目标行进。运动不对称所需要的Chx10 Gi神经元的鉴定,为这类系统的自下而上的解剖提供了一个切入点。Chx10 Gi神经元接收来自上游核团的大量单侧投射,包括同侧未定带、对侧小脑内侧深部核、对侧SC等。其中,对侧外侧SC通过Chx10 Gi神经元上的单突触投射发出方向命令。在啮齿类动物中,外侧SC接收来自下视野的输入。因此,SC-Gi交叉投射似乎解释了显著刺激的定向模式。
✦+
+
总结
脑干环路在运动控制中起着核心作用。MLR由两个邻近的兴奋性神经元组成,这两个脑干结构在不同方面控制运动启动和速度。网状结构向脊髓传递MLR信号的同时,会招募其他环路的参与。现在已经确定了参与停止和转向运动的平行脑干通路。
这些指令通路是如何通过执行脊髓环路来协调运动行为的,还没有被很好地理解。但是随着对脑干命令信号的功能组织和脊椎动物脊髓运动网络的关键神经元的理解,有助于建立从脑干到脊髓的功能性连接体。这样的研究将能够直接确定运动节律是如何在脊髓中实现的,以及步态是如何由指令信号控制的。描绘脑干指令通路的最重要的方面可能是,它们作为节点将运动输出的不同方面与运动的上下游相关行为表达联系起来。
对脑干指令通路的功能组织的深入了解不仅有助于我们理解动物和人类如何移动。对于理解运动障碍也有重要的意义,例如,帕金森病的运动障碍,有可能在临床上提供更好的治疗
AiBrain内容团队为大家整理了文章的pdf,如有需要,请公众号后台留言“pdf”或扫码添加AiBrain助手微信获取。


✦往期精彩回顾✦


声明:脑医汇旗下神外资讯、神介资讯、脑医咨询、AiBrain所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享。