
撰稿 | AiBrain 内容团队
排版 | AiBrain 编辑团队

许多与神经发育障碍(NDD)风险相关的基因编码染色质修饰酶和其他表观遗传调节因子,越来越多的证据表明,认知能力的发展和/或维持取决于染色质和表观遗传调控。鲁宾斯坦-泰比综合征(Rubinstein-Taybi,RSTS)是一种罕见的单基因常染色体显性遗传性神经发育障碍,其特征是脑部异常、不同严重程度的智力障碍和多发性先天性畸形。
组蛋白/赖氨酸乙酰转移酶(HAT/KATs)CREBBP的突变(CREB结合蛋白或CBP)和EP300基因(E1A结合蛋白p300)分别占临床诊断RSTS病例的60%和8-10%。CBP或EP300的一个突变等位基因的存在足以引发这种非常致残的疾病,但目前的研究尚未建立明确的基因型-表型相关性,并且对于给定的突变或缺失,无法解释的表型变异性是频繁的。这表明除了CBP或EP300突变对染色质的直接影响外,与塑造RSTS神经发育缺陷有关生物学机制仍然未知,这些途径可能构成重要的治疗靶点。
2022年11月16日,巴黎大学的Valérie Mezger课题组在Nature Communications上发表了题为“CBP-HSF2 structural and functional interplay in Rubinstein-Taybi neurodevelopmental disorder”的研究文章,该研究利用RSTS患者的细胞发现突变CBP或EP300会损害HSF途径的完整性和功能,从而影响短寿命HSF2蛋白的稳定性。


作者首先分析了HSF2和CBP/EP300在人脑类器官(hCOs)中的表达模式30分化第56天(D56)。使用免疫荧光标记,观察到HSF2和CBP/EP300蛋白在hCO增殖层和神经元层的细胞核中表达(PL,由SOX2或PAX6染色;NL,由TBR1或β III-微管蛋白染色)(图1a,b)。HSF2、CBP和EP300蛋白及其相应的基因转录本存在于hCO分化的D20至D60之间(图 1c),以及从E11到E17的小鼠皮层发育的所有阶段。作者还发现HSF2和CBP/EP300共定位于hCO增殖或神经元层的细胞核中。
此外,CBP和p300在发育中的小鼠皮层中与HSF2共免疫沉淀,并且HSF2不仅以乙酰化形式存在于发育中的小鼠皮层中,而且存在于D40 hCO中(图1d-f)。
总之,这些结果表明HSF2和CBP/EP300共存于增殖细胞和神经元细胞的细胞核中,并且这些蛋白质可以在神经发育环境中相互作用,这与HSF2在小鼠产前皮质和hCO中乙酰化形式的存在相关。
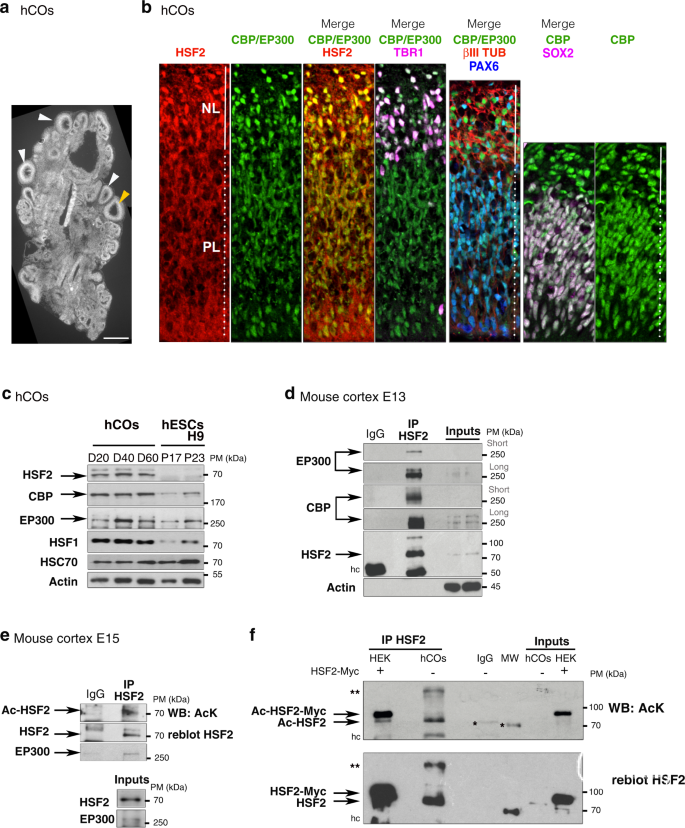
图1:HSF2在神经发育环境中表达、乙酰化并与EP300/CBP相互作用。

由于外源性标记的HSF2在HEK 293细胞中乙酰化(图1f),作者使用人HEK 293细胞共表达CBP-HA或EP300-HA和GFP或Myc标记的HSF2来检查HSF2是否是CBP/EP300的底物。结果显示,免疫沉淀的外源性HSF2蛋白被EP300或CBP乙酰化(图2a),但未被显性阴性CBP乙酰化,无法催化乙酰化(图2b)。为了鉴定HSF2中的乙酰化赖氨酸残基,从与EP300-HA共表达Flag-HSF2的HEK 293细胞中免疫沉淀HSF2,并通过质谱(MS)分析赖氨酸乙酰化。在HSF2的36个赖氨酸中,作者鉴定了8个乙酰化残基:K82(位于DNA结合结构域),K128,K135,K197(均位于齐聚HR-A/B结构域内),K209,K210,K395和K401(图2c)。这表明,与我们的MS数据一致,HSF2的乙酰化发生在多个赖氨酸残基上。
因此,作者定义了几种关键的乙酰化赖氨酸残基,其精氨酸(R)或谷氨酰胺(Q)突变显着降低了HSF2乙酰化:K82、K128、K135和K197(图2d)。为了剖析CBP在HSF2乙酰化中的要求,作者使用了体外乙酰化测定法与高效液相色谱(HPLC)相结合。结果显示,含有K135或K197残基的合成HSF2肽很容易通过CBP的纯化重组全催化结构域以乙酰辅酶A依赖性方式乙酰化,而含有K82的肽没有乙酰化(图2e,f)。综上所述,数据表明HSF2在三个主要赖氨酸残基(K128、K135和K197)中被CBP/EP300乙酰化,这些残基位于齐聚HR-A/B结构域内。
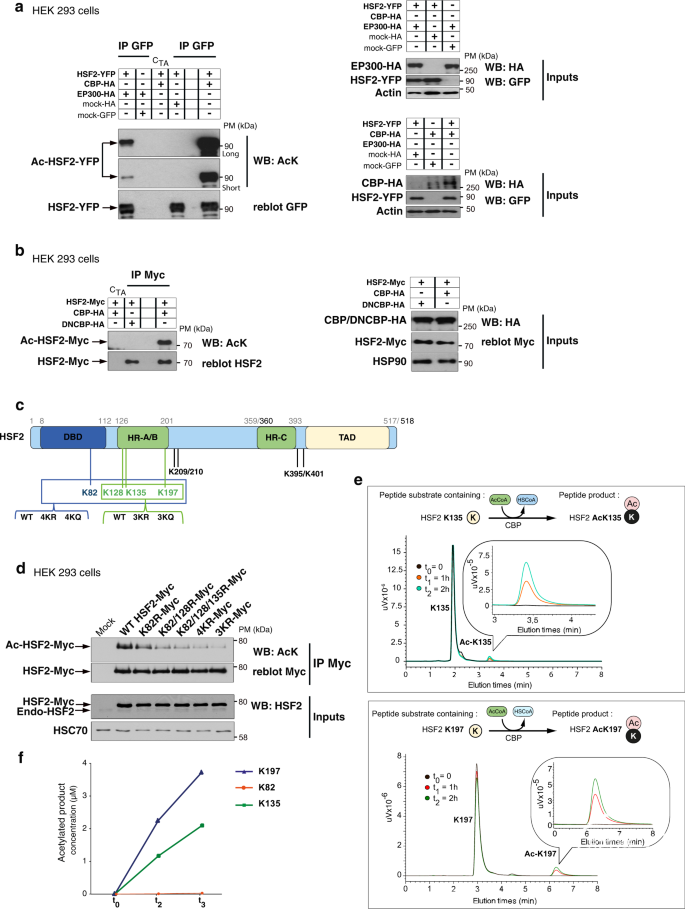
图2:HSF2在正常条件下被CBP和EP300乙酰化。

CBP/EP300对许多转录因子的锚定是通过不同的结合位点发生的,包括激酶诱导结构域(KID)相互作用结构域(KIX结构域)。作者在HSF2的HR-A/B结构域中发现了几个保守的,重叠的和并置的KIX基序(图3a)。
接着,作者模拟了HSF2 HR-A/B KIX基序与CBP KIX结构域之间的相互作用。基于HR-A/B结构域、脂蛋白Lpp56与转录因子GCN4、ATF2和PTRF之间的序列相似性,作者首先开发了HSF2三聚体三聚体三线圈HR-A/B结构域的结构模型。
最后,作者评估了CBP KIX结构域的Y650氨基酸的计算机突变的影响,这是一种在RSTS患者中突变的残基。CBP中的计算机突变Y650A大大降低了CBP KIX结构域与HSF2 KIX基序相互作用的概率(图3e)。使用重组蛋白,作者验证了HSF2在体外免疫共沉淀实验中直接与CBP KIX结构域相互作用,并确认Y650A突变破坏了HSF2和KIX相互作用(图3f)。综上所述,作者将Y650确定为CBP的KIX结构域与位于HSF2寡聚结构域内的KIX基序之间相互作用的关键残基。
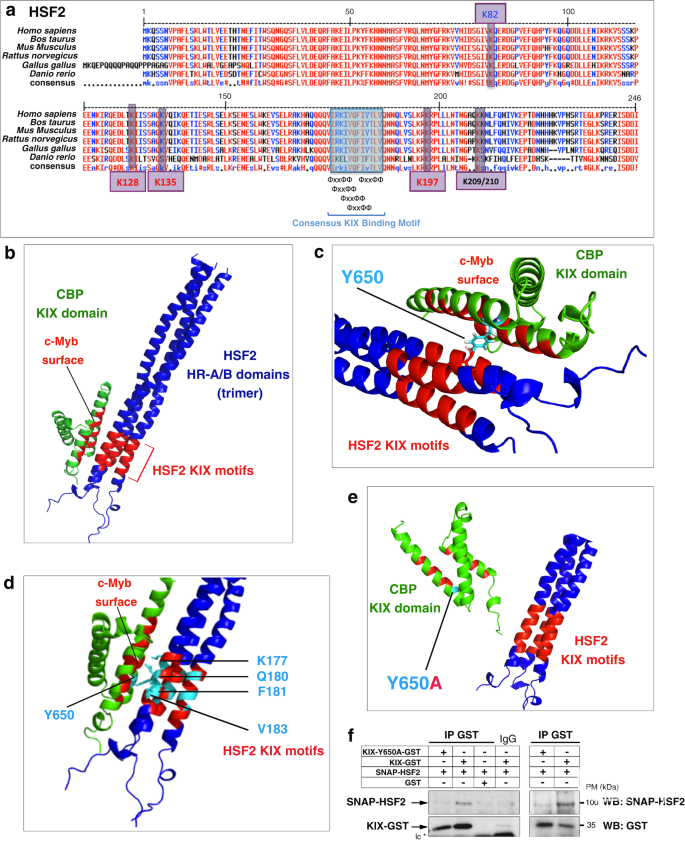
图3:CBP和HSF2相互作用的建模。

由于HSF通路同时参与应激反应和神经发育,并且在存在突变的CBP或EP300时不稳定,因此可以直接参与RSTS的病理学。为了确定在这种病理背景下,受损的CBP和EP300活性对HSF2蛋白水平的功能影响,作者首先比较了来自健康供体(HD)或携带CBP或EP300基因突变或缺失的RSTS患者的细胞中HSF2蛋白的量(图4a)。
结果显示,两名RSTS患者的人原代皮肤成纤维细胞(hPSF)中的HSF2蛋白水平显着降低(图4a-c)。当用蛋白酶体抑制剂MG132处理这些hPSF时,HSF2水平恢复到相当的HD水平(图4b-c);在抑制I类HDACs时,情况并非如此(图4b-c)。这一发现表明,催化HAT结构域和KIX域是调节HSF2稳定性所必需的,符合计算机结果。
总体而言,这些数据表明,HSF2的蛋白酶体周转在RSTS hPSF中增加,并且CBP和EP300是这种病理背景下HSF2蛋白稳定性的关键调节因子。
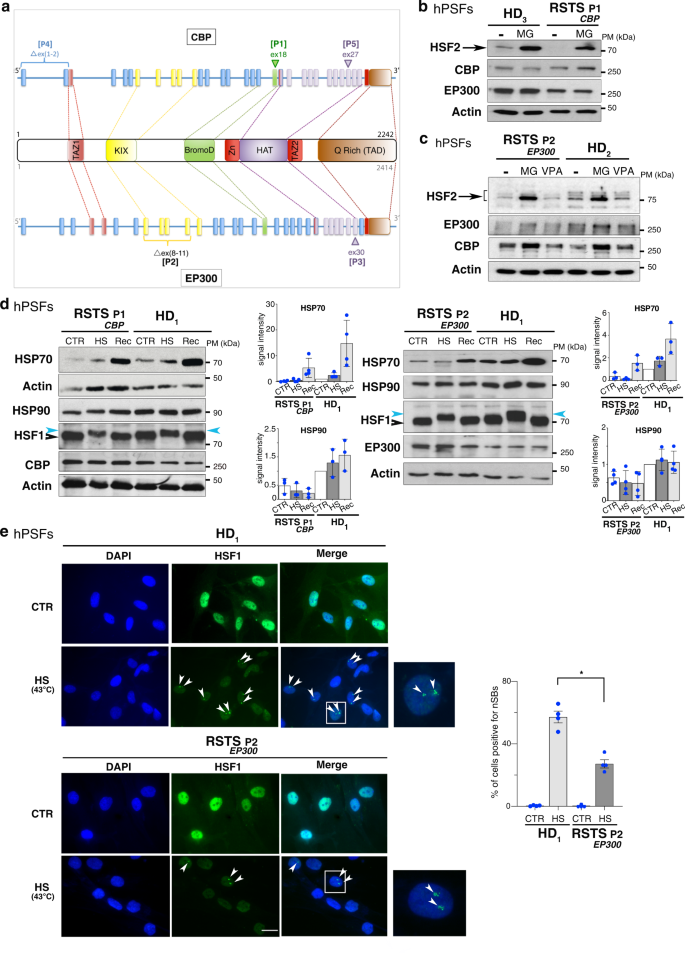
图4:RSTS患者细胞中HSF2蛋白水平改变和应激反应失调。

MG132导致HSF2水平升高。这种增加还伴随着RSTS iNPC和hCO中N-钙粘蛋白和HSP110水平的升高(图5a,b)。作者研究了NDE1,它是皮质祖细胞分裂的重要参与者,其基因与HSF2结合,但其表达不受小鼠发育皮层中HSF2的显着调节,与N-钙粘蛋白和HSP相反。重要的是,在RSTS神经环境中,NDE1蛋白水平对MG132暴露没有表现出重大变化(图5b)。这表明,在这些剂量下,MG132不能全局稳定HSF2靶标,无论是在HD还是在RSTS神经模型中。因此,在RSTS模型中,MG132治疗后HSP110和N-钙粘蛋白水平的升高可能是通过其强阳性调节因子HSF2水平的增加而发生的。
根据发现,N-钙粘蛋白水平降低可能是由于RSTS iNPC和hCO中HSF2的失调所致,与HD对应物相比,作者确定了RSTS衍生iNPC和hCO中神经发育特征的改变。结果显示, RSTSEP300 iNPC的径向组织发生扰动。在RSTS iNPC培养中未观察到FABP7 +放射状胶质样细胞的这种放射状组织。相反,PAX6 +细胞呈散在分布,即没有被FABP7 +细胞包围成簇(图5c)。这与小鼠Hsf2皮质(Hsf2-/- tm1mmr)的表型相似,后者显示出放射状胶质纤维组织的扰动。其次,通过使用磷酸化组蛋白H3标记物(H3S10Ph)对顶端有丝分裂进行染色,作者证明了RSTSEP300 hCO与HD hCOs相比,在距离环的顶端区域(由ZO-1染色)有更高的异位有丝分裂率,具有统计学意义(图5d)。

图5:HSF2水平的药理学增强恢复了其在iNPC和hCO中的靶表达。
综上所述,作者发现HSF2通路在RSTS患者中被破坏,HSF2通路是一种中枢应激反应通路,在生理条件下也控制大脑发育。KATs CBP和EP300催化HSF2的乙酰化,从而有助于其在hPSF和源自患者细胞的神经模型中的稳定性。恢复HSF2水平,无论是药理学还是遗传学,都可以恢复受损的应激反应和神经发育基因的表达,特别是N-钙粘蛋白。
最后,作者表明,在RSTS1和RSTS2患者衍生的iNPC和hCO中,CBP/EP300/HSF2-N-钙粘蛋白级联的失调被重新描述,并通过HSF2的稳定得以挽救。HSF2缺陷小鼠皮质的表型特征和RSTS hCOs中神经源性龛内细胞-细胞黏附的特征性改变提示HSF2在RSTS神经病理中起关键作用。
参考文献:
de Thonel, A., Ahlskog, J.K., Daupin, K. et al. CBP-HSF2 structural and functional interplay in Rubinstein-Taybi neurodevelopmental disorder. Nat Commun 13, 7002 (2022).
https://doi.org/10.1038/s41467-022-34476-2
AiBrain内容团队为大家整理了文章的pdf,如有需要,请公众号后台留言“pdf”或扫码添加AiBrain助手微信获取。


✦往期精彩回顾✦


声明:脑医汇旗下神外资讯、神介资讯、脑医咨询、AiBrain所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享。