撰稿 | AiBrain 内容团队
排版 | AiBrain 编辑团队

目前,癫痫的主流治疗手段仍是抗癫痫药物,然而有1/3的患者效果不佳;抗癫痫药物主要作用于神经元,对癫痫的症状进行控制,但不能改变癫痫的发生,有时会有严重不良反应。因此,需要积极探索以新的细胞和分子靶点为目标的治疗方案。
星形胶质细胞在癫痫的病理过程中其重要作用,使其有可能作为新型治疗靶点的可能。来自意大利、德国、荷兰及美国的多名研究人员,对星形胶质细胞功能紊乱在癫痫发生发展中的作用,及体内监测星形胶质细胞的活动过程和与其相关的生物标志物的研究进展进行了详细的综述。近期,以Astrocytes in the initiation and progression of epilepsy为题,发表在了Nature Reviews Neurology杂志上。

星形胶质细胞在中枢神经系统的生理功能主要有:形成血脑屏障,调节神经血管的耦合;调节脑血流和能量代谢;参与形成三方突触,调节细胞外神经递质、离子,释放胶质递质,维持神经元的兴奋性等。
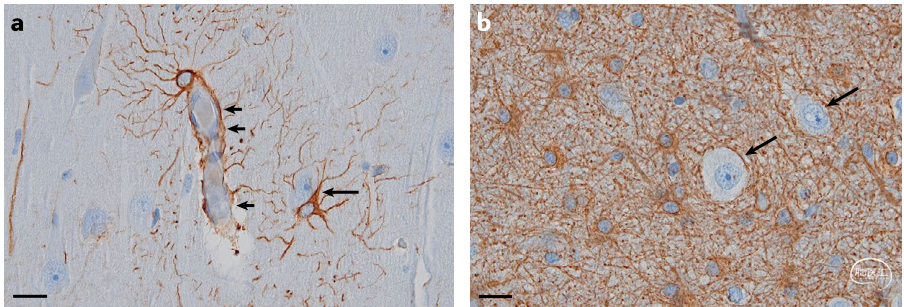
△上下滑动查看△
大脑损伤后反应性星形胶质细胞增生(基因表达、代谢、形态及功能改变),在癫痫的病理生理过程中起双向作用:一方面促进了癫痫的发生和发展,另一方面通过抗氧化应激和炎症反应,对神经细胞发挥保护作用,但作用甚微。

星形胶质细胞与突触密切相关。突触周围的星形胶质细胞突起和突触之间紧密的空间和功能相互作用形成了三方突触,星形胶质细胞通过释放影响神经元活动的所谓胶质递质来检测和响应突触信号。胶质传递是正常脑功能的重要组成部分;胶质传递的异常与癫痫有关。
1.1 健康大脑中的胶质传递
谷氨酸是首先被证明的一种胶质递质,它可以改变培养神经元的活动。由GABA、谷氨酸、内源性大麻素或ATP信号引发的星形胶质细胞Ca2+浓度增加,触发星形胶质细胞释放谷氨酸。释放的谷氨酸通过神经元的NMDA受体诱导缓慢内向电流(SICs),导致神经元活动同步并增加了突触强度。
除了谷氨酸之外,星形胶质细胞还释放NMDA受体协同激动剂D-丝氨酸,调节长时程增强,影响学习和记忆。ATP也是一种胶质递质:从星形胶质细胞释放后,激活嘌呤能P2受体或降解为腺苷,腺苷通过结合突触前腺苷A1受体影响神经递质释放,调节睡眠稳态。星形胶质细胞在不同的脑区释放GABA:在丘脑中,GABA释放引起丘脑皮层神经元的外向电流;在嗅球中,GABA抑制僧帽细胞和颗粒细胞;在海马和小脑中,释放的GABA介导紧张性抑制。
除了Ca2+依赖的胞吐作用,还提出了胶质递质的其他释放机制。这些机制包括通过连接蛋白43(Cx43)半通道、pannexin1通道、容量调节阴离子通道、营养蛋白1阴离子通道、双孔域K+通道、氨基酸转运蛋白和P2X7受体释放。
1.2 胶质传递在癫痫中的作用
鉴于胶质递质调节神经元兴奋性,星形胶质细胞胶质递质释放的障碍可能与癫痫发作和形成有关。
谷氨酸和星形胶质细胞缝隙连接偶联
癫痫中研究最多的神经胶质递质是谷氨酸。在颞叶癫痫(TLE)中,在癫痫发作前和发作时,海马体中细胞外谷氨酸水平在升高。释放的谷氨酸通过神经元的NMDA受体诱发SICs,促进神经元放电的同步化。推测谷氨酸的过量释放是癫痫活动特征性超同步神经元放电的基础。
一些研究认为,星形胶质细胞释放的谷氨酸在癫痫中具有调节作用,而不是致病作用。皮质-海马脑片研究表明,Ca2+依赖性星形胶质细胞谷氨酸释放本身并不触发癫痫样活动,而是通过招募更多的神经元参与同步活动,降低了发作的阈值。星形胶质细胞的Ca2+信号先于发作期,而不是发作间期的放电,表明在超兴奋网络中神经元和星形胶质细胞之间的双向信号传导产生了一个促进局灶性癫痫发作的周期性兴奋环路。在皮质内注射红藻氨酸的小鼠中,星形胶质细胞Ca2+的增加先于癫痫发作几秒钟的研究结果支持了上述观点。
药理学或遗传学抑制星形胶质细胞的Ca2+和遗传学抑制星形胶质细胞的递质释放,减弱了癫痫样活动和神经退化。此外,在TLE小鼠模型的硬化海马中,星形胶质细胞发生了显著的形态和功能改变,影响了它们对谷氨酸的敏感性并削弱了对细胞外谷氨酸浓度的调节。谷氨酸转运蛋白被离子型AMPA受体(特别是GluA1)取代,导致星形胶质细胞去极化时间延长,这种去极化激活了一个恶性循环:细胞外谷氨酸的积累,胶质细胞去极化和神经元过度活动。
ATP和嘌呤能受体
癫痫发作时细胞外ATP水平变化研究结果不一。这种不一致的可能原因是细胞外ATP快速降解为腺苷,难以在大脑中测定。然而,体外研究表明,在耐药性癫痫患者皮质组织样本的发作放电期间,细胞外ATP水平大幅增加。
ATP和腺苷在癫痫中的作用相反。细胞外腺苷通过作用于突触前和突触后腺苷A1受体而具有抗癫痫和神经保护作用。而细胞外ATP水平升高激活嘌呤能受体会促进癫痫发作和发生。在这种情况下,离子型P2X7嘌呤能受体作为治疗靶点引起了广泛关注,研究表明其抑制具有抗惊厥和神经保护作用。在人类和啮齿动物癫痫组织中,P2X7受体主要由小胶质细胞和兴奋性神经元表达,而不是星形胶质细胞,因此P2X7受体抑制的保护作用可能是通过抑制神经炎症和神经元谷氨酸释放来介导的。
代谢型嘌呤能P2Y1受体也与癫痫有关。这种受体由神经元、星形胶质细胞和小胶质细胞表达,被ADP和ATP激活。P2Y1受体在人类和实验性TLE海马中的表达增加,抑制P2Y1受体具有抗惊厥、抗癫痫和神经保护作用,可能是由于抑制了P2Y1受体介导的Ca2+依赖性谷氨酸从星形胶质细胞释放。
然而,有些研究并没有在癫痫组织的星形胶质细胞中检测到P2Y1受体,并表明在P2Y1受体抑制后观察到的炎症反应减弱和抗癫痫作用是由于小胶质细胞P2Y1受体的抑制。因此,尽管关于星形胶质细胞ATP在癫痫中的作用仍存在未回答的问题。
GABA和突触外GABAA受体
在人类和TLE实验动物的海马体中,GABA能中间神经元的丢失以及突触去抑制已经得到证。尽管如此,几项研究表明,强直性(突触外)GABAA受体介导的电流在TLE中得以保留甚至增加,表明非神经元来源的GABA在细胞外的浓度较高。在TLE的小鼠模型中,反应性星形胶质细胞通过从头合成和/或谷氨酸脱羧产生GABA。释放到细胞外后,通过BEST1通道,激活兴奋性神经元的紧张性GABAA受体,降低癫痫易感性,从而明显补偿了中间神经元的丢失。
总的来说,研究表明反应性星形胶质细胞可以在癫痫中释放兴奋性或抑制性胶质递质。但不能确定癫痫过程中具体的参与者和参与程度。此外,虽然兴奋性神经胶质递质的异常释放似乎促进了癫痫发作和神经变性,但它不足以单独引发癫痫病理过程。然而,星形胶质细胞的胶质传递可能是某些形式癫痫的主要原因。总的来说,胶质递质的增加和与稳态功能受损可能驱使神经元网络进入癫痫样活动。
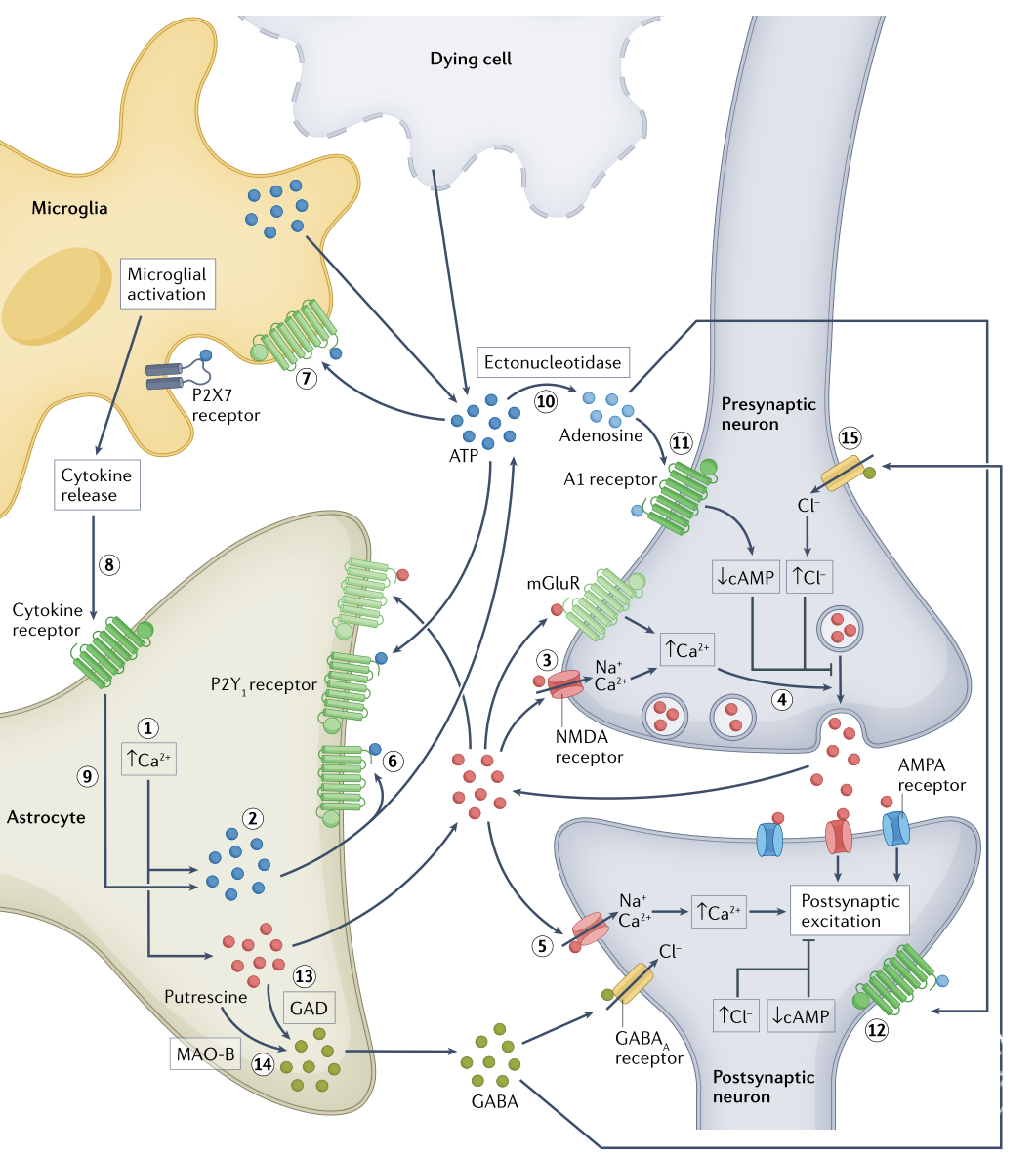
△上下滑动查看△
1.3 以胶质传递为靶向的治疗
对耐药性癫痫替代治疗策略的需求,尝试将胶质细胞功能障碍(如异常胶质细胞传递)作为治疗的靶点。在活体皮质中进行的实验表明,抗癫痫药物丙戊酸钠(ASMs)、加巴喷丁和苯妥英在癫痫发作期间抑制星形胶质细胞Ca2+信号传导,表明这些药物的治疗位点在于对胶质细胞传递的抑制。此后,发现了几种靶向胶质递质不同位点的药物。P2Y1受体拮抗剂MRS2179和MRS2500已被证明可抑制Ca2+介导的神经胶质传递,并具有抗惊厥、抗癫痫和神经保护作用。一项对癫痫患者术后脑组织的研究也表明,高K+水平诱导的发作性放电导致ATP通过Panx1通道释放,尽管尚不清楚ATP是由神经元还是星形胶质细胞释放的。用丙磺舒或甲氟喹(批准用于治疗痛风和疟疾的药物)抑制这些通道可阻断人皮质脑组织切片中的发作性放电,并在获得性癫痫小鼠模型中具有抗惊厥作用。
星形细胞代谢型谷氨酸受体(mGluRs)的失调已在癫痫中得到描述,并且是潜在的治疗靶点。在体外局灶性癫痫发作模型和来自点燃大鼠的离体脑切片中,mGlu1R和mGlu5R拮抗剂(LY456236、LY367385和MPEP)可能通过减弱星形胶质细胞和突触前终末的谷氨酸释放来降低神经元兴奋性。在红藻氨酸癫痫模型中,P2X7受体拮抗剂降低了癫痫持续状态的严重程度和减少了慢性癫痫发作,这可能是通过抑制神经炎症实现的。
鉴于GABA能够降低突触前谷氨酸释放和突触后兴奋性,增加GABA表达及其从星形胶质细胞释放的药物也可能对癫痫有治疗作用,然而,目前尚未进行此类药物的研究。

癫痫发作会导致新陈代谢的变化,而生化紊乱又会导致癫痫发作和发生。星形胶质细胞在腺苷、葡萄糖、谷氨酸和GABA代谢的调节以及甲基转移中起关键作用。星形胶质细胞的这些作用不仅可以治疗癫痫的发作,而且可以比目前的治疗方法更全面地治疗癫痫及其潜在的并发症。
2.1 腺苷的代谢
腺苷是一种进化上古老的能量稳态调节器。能量供应不足会导致ATP下降和腺苷增加,而腺苷能广泛抑制代谢和生理活动。癫痫发作是一种过度消耗能量的状态,可促进腺苷的生成,腺苷可作为内源性抗惊厥药并终止癫痫发作。大脑中腺苷的抑制作用主要由Gi蛋白偶联腺苷A1受体的激活介导,该受体可被非选择性腺苷受体拮抗剂咖啡因和茶碱阻断。因此,这些药物具有促惊厥的特性。
腺苷代谢酶腺苷激酶(主要在星形胶质细胞中表达)的过度表达已经成为TLE的病理标志。在多种癫痫模型中,反应性星形胶质细胞增生与腺苷激酶的过度表达有关,由此导致的腺苷缺乏不仅足以引发癫痫发作,还会促进癫痫的发生过程。因此,腺苷代谢紊乱会广泛影响癫痫的病理生理学,但也提供了新的基于代谢的治疗靶点,以直接干预癫痫的发病过程。
2.2 谷氨酸、谷氨酰胺和GABA的代谢
谷氨酰胺合成酶(GS)是一种基于星形胶质细胞的代谢酶,在癫痫的病理生理学中很重要。这种酶胺化谷氨酸,将其转化为谷氨酰胺,谷氨酰胺又被转运到抑制性神经元转化为GABA,或转运到兴奋性神经元还原为谷氨酸。因此,GS在调节谷氨酸和GABA的平衡中起着重要的作用。GABA的释放又受到代谢控制,因为GABA能神经元对低能量状态敏感。
GS活性的丧失可导致癫痫发作,并通过增加星形胶质细胞释放的细胞外谷氨酸和减少谷氨酰胺供应导致神经元中GABA生成不足来促进癫痫的发生过程。GS活性被神经炎症导致的氧化应激所抑制,表明这些过程可能影响癫痫中的GS。
谷氨酸转运蛋白1(GLT1)的下调会损害星形胶质细胞的谷氨酸清除,从而进一步加剧癫痫患者的细胞外谷氨酸失调。事实上,小鼠中GLT1的缺乏会导致癫痫,并增加其对大脑损伤的敏感性。总的来说,这种代谢紊乱的后果导致了癫痫的发作和发生。
2.3 星形胶质细胞-神经元乳酸穿梭
癫痫活动在受影响的神经元网络中产生对能量的高需求。过度的突触活动刺激星形细胞糖酵解,导致葡萄糖水平迅速下降,乳酸相应上升,乳酸成为神经元的主要能量来源。癫痫发作期间糖原和葡萄糖利用的增加导致丙酮酸通过乳酸脱氢酶(LDH)形成乳酸,使星形胶质细胞通过星形胶质细胞-神经元乳酸穿梭提供能量,维持极度活跃的神经元网络的能量需求,从而维持癫痫活动。
癫痫发作诱导的乳酸形成促进癫痫活动的假设,得到了LDH抑制剂(如stiripentol)具有强大的抗癫痫作用的支持。LDH抑制可能通过限制NAD+的可用性和支持丙酮酸的氧化线粒体代谢来干扰糖酵解。然而,星形胶质细胞糖酵解和星形胶质细胞-神经元乳酸穿梭都依赖于能量传感器星形胶质细胞AMP激活蛋白激酶(AMPK)。小鼠中AMPK的基因缺失导致乳酸耗尽和癫痫发作阈值降低,而星形胶质细胞而非神经元AMPK的缺失诱发了小鼠和果蝇神经元的丢失。这些发现表明星形胶质细胞代谢调节乳酸和能量稳态的复杂性,这对癫痫发作阈值至关重要。
2.4 甲基化反应
癫痫发生甲基化假说是DNA异常甲基化导致癫痫的发生和发展。研究表明,表观遗传过程,尤其是DNA甲基转移酶活性的增加和异常的DNA甲基化,与致痫过程有着复杂的联系。此外,在TLE和海马硬化患者手术切除的标本中,DNA甲基化的变化与癫痫持续时间延长和炎症过程相关基因的诱导相关。
在代谢上,所有的甲基化反应,包括DNA甲基化,都通过腺苷激酶与腺苷代谢相关。腺苷激酶的遗传或药理学破坏导致腺苷水平的增加,使S腺苷高半胱氨酸形成增加,S腺苷高半胱氨酸是DNA甲基转移酶的有效抑制剂。相反,腺苷激酶的病理性过度表达增加了DNA甲基化,从而促进癫痫的发生。
2.5 癫痫的代谢疗法
鉴于星形胶质细胞是大脑活动的代谢主调节者,并且代谢和生物化学紊乱与癫痫发作过程有关,星形胶质细胞是代谢治疗的有潜力的治疗靶点(表1)。
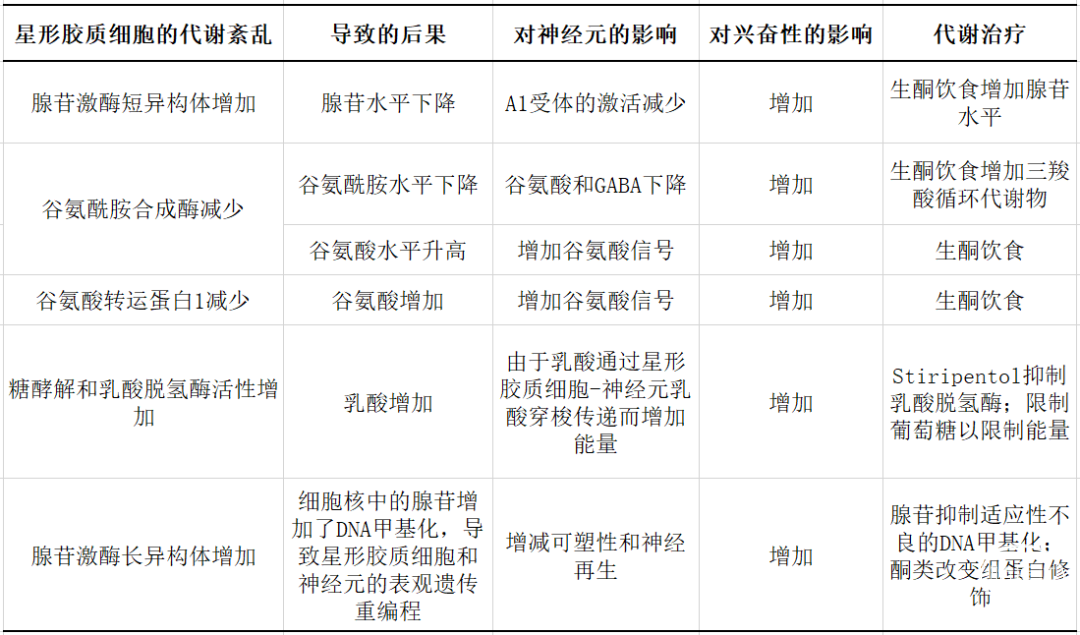
表1 星形胶质细胞代谢功能障碍导致神经元兴奋性增加的关键机制
酮、脂肪酸和葡萄糖限制
使用最广泛的代谢疗法是高脂肪、低碳水化合物的生酮饮食,它迫使大脑使用酮体而不是葡萄糖作为其主要能量来源。在大脑中,星形胶质细胞是脂肪酸氧化的主要场所,并且是唯一能够产生酮体的细胞类型。
生酮饮食和相关代谢疗法抑制了多种耐药性癫痫的发作。临床研究和临床前模型已经表明,生酮饮食干预具有持久的疾病改善,并具有抗癫痫的特性。生酮饮食疗法不同程度地影响神经元和星形胶质细胞的基因表达——在星形胶质细胞中,与谷氨酸能信号、内质网处理和胰岛素信号控制相关的基因表达显著减少。
基于葡萄糖限制是生酮饮食益处的一种机制,糖酵解抑制剂2-脱氧葡萄糖(2DG)破坏糖酵解被认为是严格饮食制度的替代方案。在啮齿动物模型中,2DG通过突触前机制具有急性抗癫痫作用,并在大鼠中具有延迟点燃作用。类似地,在小鼠神经创伤模型中,在损伤后立即开始治疗1周后,2DG减弱了体外皮质切片和体内癫痫样活动的发展。总之,葡萄糖限制而不是酮的产生,提供了代谢疗法的主要治疗益处。因为星形胶质细胞通过葡萄糖转运蛋白GLUT1从毛细血管中吸收葡萄糖,从而承担了大脑中能量稳态的守门人角色。
腺苷对癫痫的预防
生酮饮食疗法的另一个非酮依赖性机制是腺苷的增加和腺苷激酶的下调,这可能是代谢疗法改善疾病特性的解释。鉴于星形胶质细胞中腺苷激酶表达的非适应性增加通过增加DNA甲基化驱动癫痫发生过程,治疗性腺苷增加是癫痫预防的合理方法。此外,腺苷激酶的一种亚型在细胞核中特异性表达,这意味着细胞核腺苷代谢可以作为特异性靶点,改变腺苷的表观遗传效应,同时最小化增加细胞外腺苷的水平。
在红藻氨酸诱导的癫痫模型中,通过向脑内递送腺苷抑制了点燃癫痫的发生和慢性癫痫的发展。重要的是,腺苷的早期治疗似乎提供了长期持久的保护作用。
总之,这些研究表明,降低星形胶质细胞腺苷代谢从而增加腺苷利用率的短暂代谢治疗有可能通过表观遗传学中断致痫过程。因此,短暂的预防性治疗可以减轻癫痫的长期治疗方案相关的副作用。

星形胶质细胞在维持癫痫的神经炎症反应中具有关键作用;这种作用从它们的转录谱和组织学可见。耐药性癫痫患者的尸检或手术切除的标本中星形胶质细胞的转录谱揭示了一系列炎症分子的表达,例如细胞因子、趋化因子、前列腺素和补体。同一标本的组织学研究表明,炎症分子与星形胶质细胞特异性标记物共定位。星形胶质细胞、神经元和其他非神经元细胞(特别是小胶质细胞和微血管系统)之间的相互作用对于神经炎症环境的产生,及其在遗传性和获得性癫痫以及与神经胶质肿瘤相关的癫痫发生中的过度兴奋和癫痫产生中起重要作用。
在人类和实验性癫痫中,星形胶质细胞产生促炎性细胞因子和趋化因子。但由反应性小胶质细胞、周细胞和微脉管系统释放或由血液白细胞输入的促炎性分子也可在星形胶质细胞中诱导炎症表型。类似地,神经元也可以释放危险信号,引发星形胶质细胞促炎分子的合成和释放。
3.1 神经元过度兴奋
星形胶质细胞和其他脑细胞释放的细胞因子和趋化因子通过神经元受体调节神经元活动。这些分子的生理作用是调节突触传递和可塑性。然而,如果过量产生,它们可以通过改变神经元中电压门控和受体偶联离子通道的表达和功能来诱导网络过度兴奋并降低癫痫发作阈值。
细胞因子和趋化因子也影响星形胶质细胞自身的功能。脑损伤或高温后释放的细胞因子可导致星形胶质细胞功能障碍,包括缝隙连接耦合的阻断,从而导致离子和递质稳态受损,并导致复发性自发癫痫发作。
3.2 血脑屏障(BBB)功能障碍
在获得性癫痫中,BBB的通透性发生改变,通常与新生的渗漏血管有关。啮齿类动物BBB功能障碍也足以诱发癫痫的发生。血管周星形胶质细胞通过释放细胞因子(包括血管内皮生长因子、白介素1β、HMGB1和肿瘤坏死因子)、趋化因子和下游效应物,激活微血管周细胞和内皮细胞上的受体,对癫痫微血管的结构和功能变化至关重要。因此,BBB的通透性在多个层面受到影响,包括紧密连接的破坏以及跨内皮小泡运输和白细胞运输的增加。
癫痫患者BBB功能障碍的一个结果是血清蛋白的外渗和随后血管周围星形胶质细胞中转化生长因子受体2(TGFβRII)-SMAD信号的激活。这种信号传导导致炎症基因的转录激活、Kir4.1、GLT1和AQP4的下调以及星形胶质细胞终末Cx43的亚细胞重组。血清蛋白还诱导TGFβ1并抑制星形胶质细胞缝隙连接偶联,从而增强信号激活,并通过丝裂原活化蛋白激酶(MAPK)途径导致反应性星形胶质细胞增生。由于BBB受损,癫痫发作阈值降低,从而促进癫痫的发展。啮齿类动物癫痫持续状态后,对TGFβRII-SMAD信号的长期(3周)药物阻断挽救了星形胶质细胞中的一些分子变化,降低了癫痫的发生率和治疗动物慢性癫痫发作的频率。然而,在红藻氨酸诱导的癫痫持续状态小鼠模型中,星形胶质细胞通过缝隙连接信号的丢失不是由TGFβR1信号介导的,并且在诱导癫痫持续状态前短暂(2天)阻断TGFβR1信号不会影响癫痫的发展。
3.3 细胞外基质与突触重塑
在人类TLE和相关动物模型中,炎性星形胶质细胞在TGFβR和IL-1β信号转导的控制下表达高水平的基质金属蛋白酶(MMPs),从而诱导细胞外基质重塑和病理性突触可塑性。在体外,星形胶质细胞原代培养物中的细胞外基质重塑分布可由内皮细胞诱导,内皮细胞本身已被炎症刺激激活。
体外和体内研究表明,星形胶质细胞在癫痫发作前通过激活TGFβR信号传导来介导兴奋性突触发生,并且它们可能参与轴突发芽。对TLE患者的脑组织和获得性癫痫的动物模型研究表明,星形胶质细胞也参与了快速尖峰抑制中间神经元周围的神经束网络的降解。这些改变与过度兴奋和自发性癫痫发作有关,可以通过TGFβR信号阻断剂来预防;当在癫痫发生期间长时间给药时,这些阻断剂可以抑制动物癫痫的发展。
靶向上调的MMP本身是阻断癫痫发展一种策略。在癫痫的快速点燃模型中,用MMP2和MMP9的抑制剂治疗降低了癫痫发作的严重程度,并且在红藻氨酸盐模型中,在癫痫持续状态后的7天治疗期间以及停药后长达7周,相同的治疗降低了慢性自发癫痫发作的次数并缓解了认知缺陷。
3.4 氧化应激
神经炎症和氧化应激是联系在一起的,氧化还原蛋白质组与免疫反应密切相关。一些证据表明,氧化还原活性影响癫痫患者的过度兴奋和癫痫发作,并且这一过程主要涉及星形胶质细胞。星形胶质细胞是谷胱甘肽的主要生产者,星形胶质细胞-神经元谷胱甘肽穿梭补充神经元谷胱甘肽库。谷胱甘肽通过中和活性氧(ROS)和过氧化氢在大脑中提供了一种主要的抗氧化防御机制。
啮齿类动物癫痫发作期间以及慢性癫痫病灶中星形胶质细胞的氧化应激生物标志物(诱导型一氧化氮、半胱氨酸-谷氨酸转运蛋白、转录核因子Nrf2)增加。当神经元线粒体去极化和衰竭时,星形胶质细胞线粒体功能似乎在癫痫发作期间得以维持,这表明星形胶质细胞提供了持续的抗氧化防御。此外,增加的神经元放电激活星形胶质细胞Nrf2,从而促进抗氧化、抗炎和细胞保护作用。
星形胶质细胞的这些稳态功能与其炎症功能一致。氧化应激导致星形胶质细胞中半胱氨酸-谷氨酸转运蛋白表达增加,不仅促进谷胱甘肽的生物合成,从而防止癫痫活动,而且增加细胞外谷氨酸水平,从而导致皮质兴奋过度、癫痫样活动和兴奋性毒性。半胱氨酸-谷氨酸转运体活性导致的细胞外谷氨酸增加与神经胶质瘤相关癫痫有关。因此,FDA批准的半胱氨酸-谷氨酸转运体阻滞剂柳氮磺胺吡啶可降低癫痫的发作频率。
临床前研究表明,癫痫中氧化还原状态的改变通过小分子激活Nrf2途径或通过用N-乙酰半胱氨酸补充谷胱甘肽池的治疗干预敏感。当在癫痫持续状态之后和癫痫发展之前给药时,这些干预措施降低了已确定的慢性癫痫发作的频率,并且可以阻止癫痫发作的进展,还提供了神经保护和预防认知缺陷。
3.5 铁代谢失调
铁在中枢神经系统发育和功能中非常重要,星形胶质细胞在维持铁稳态中起着关键作用。氧化应激和铁代谢密切相关——高浓度的游离铁会增加活性氧的生成,从而促进细胞功能障碍或死亡。mTOR途径失调引起的遗传性癫痫的研究证据表明,氧化应激和铁代谢协同作用,加剧癫痫的细胞功能障碍。
一些证据表明,大脑中铁含量的增加与癫痫发作有关。在实验模型中,皮质内注射铁引起癫痫发作,中风或神经创伤后的脑内出血(可引发癫痫)导致大脑铁沉积。类似地,由于富含铁的血液成分的渗漏,BBB功能障碍可导致脑内高铁水平。
在TLE患者的手术切除脑标本中,研究了铁代谢改变在癫痫中的作用。这项研究表明,铁超载可能是由于血脑屏障渗漏造成的,铁积聚在固缩形态的神经元、小胶质细胞和星形胶质细胞中,其中铁蛋白水平也很高。铁和ROS培养的人类星形胶质细胞增加了其抗氧化和铁结合能力,但同时在长期暴露后发展为促炎性特征。基于这一证据,减少星形胶质细胞对铁的摄取会减少它们的炎症状态,这是一种对癫痫有治疗潜力的方法。
3.6 抗药性
血管周围星形胶质细胞释放谷氨酸和炎症介质可能有助于BBB内皮细胞多药转运蛋白的上调。这些蛋白质,特别是P糖蛋白(Pgp)在TLE患者和发育性胶质神经元损伤的内皮细胞和星形胶质细胞终足上过度表达。Pgp过度表达可能会限制ASM对其脑靶点的作用,从而降低其治疗效果并导致耐药性。
在TLE患者的脑组织和动物模型中,星形胶质细胞COX2和前列腺素E2的表达与微血管中Pgp的表达相关。在慢性癫痫发作的大鼠中,COX2抑制阻止了Pgp表达,并逆转了ASM抵抗。
3.7 抗炎治疗
在癫痫动物模型中进行的干预性研究有助于确定脑细胞中特定炎症通路的激活会降低神经元的兴奋阈值,从而促进癫痫发作,并且随后的癫痫发作会使神经炎症持续存在。在动物模型中,特定的抗炎治疗,包括抗氧化药物,可以降低急性和慢性癫痫发作的频率。此外,在癫痫持续状态后以及在癫痫临床发作前或发作后立即短暂给予此类药物会干扰癫痫的发生,还会改善认知缺陷。这些治疗的分子靶点是由反应性星形胶质细胞产生的致痫性炎症分子。
一些已经在癫痫动物模型中试验过的药物(例如,IL-1受体拮抗剂anakinra、IL-6受体抗体tocilizumab和1-磷酸鞘氨醇受体调节剂fingolimod)已经用于治疗自身炎症或自身免疫性疾病,并且耐受性良好,因此可以考虑用于治疗耐药性癫痫或作为急性脑损伤后癫痫发作高危个体的预防性治疗。在因新发难治性癫痫持续状态而持续癫痫发作的患者中,使用anakinra可减少癫痫发作并改善神经病学结果。

使用微创工具监测体内星形胶质细胞有助于更好地了解星形胶质细胞在癫痫病理生理学中的作用,并发现癫痫预后的生物标志物。已经开发了两种研究星形胶质细胞的方法:反应性星形胶质细胞的体内成像和生物流体中星形胶质细胞相关分子的测量。
使用基于星形胶质细胞的癫痫生物标志物的证据不足。此外,癫痫的潜在生物标志物相对于其他中枢神经系统疾病的特异性尚未得到验证,候选标志物是否有助于监测人类癫痫的发生也尚未得到验证。尽管有这些限制,神经影像和血液蛋白由于其微创性、可及性和量化的可行性,作为生物标志物具有巨大的潜力。
4.1 反应性星形胶质细胞的成像
质子磁共振波谱(1H MRS)和PET用于癫痫以帮助识别致痫区。1H质谱可用于鉴定各种细胞代谢物,包括星形胶质细胞标记肌醇。1H磁共振波谱与神经胶质纤维酸性蛋白(GFAP)免疫组织化学的结合使用表明,肌醇水平的增加与反应性星形胶质细胞增生有关。在人类中,在结构性癫痫患者的致痫区检测到肌醇水平升高。然而,TLE患者的海马肌醇水平是多变的,这可能是由于患者接受过ASM治疗,研究之间1H MRS协议的差异,和/或队列之间癫痫发作类型和频率的差异。这些因素限制了肌醇测量在检测癫痫灶中的价值。
癫痫反应性星形胶质细胞成像的另一个分子靶标是单胺氧化酶B(MAO-B),这是一种在病理条件下星形胶质细胞中表达的酶,可以用基于不可逆MAO-B抑制剂L-deprenyl的放射性配体显像。在手术切除的海马组织中,TLE患者的3H-L-deprenyl结合率高于尸检对照组,并与组织学评估的反应性星形胶质细胞增生相关。这项研究促使11C -氘- deprenyl PET作为定位癫痫灶的工具。与没有神经疾病的对照个体相比,TLE患者海马中的11C -氘- deprenyl信号更高。
靶向其他基于星形胶质细胞的位点的PET配体也已经在慢性神经退行性疾病中得到开发,并且可能具有用于癫痫的潜力。咪唑啉2结合位点(I2BS)和腺苷A2A受体,前者位于星形胶质细胞线粒体外膜并调节GFAP表达,后者由TLE患者海马中的反应性星形胶质细胞表达。I2BS和A2A PET示踪剂已被用于绘制多发性硬化、阿尔茨海默病和帕金森病的疾病进展图。
4.2 生物流体中的分子
癫痫中星形胶质细胞活性最常研究的生物流体标记物是血浆和脑脊液(CSF)中的GFAP和S100β水平。癫痫儿童或TLE成人CSF的S100β水平增加。鉴于S100β是一种可释放蛋白,而GFAP位于健康星形胶质细胞内,它们的增加可能反映了星形胶质细胞的反应性或损伤。
GFAP
局灶性或全身性癫痫患者的血清GFAP水平高于健康人,但与癫痫发作频率或疾病持续时间无关。在癫痫发作得到良好控制的儿童中,GFAP的血清水平也相对有所增加,这表明这种蛋白是潜在病理学的标志,而不是复发性癫痫发作引起的细胞损伤的标志。
除了GFAP本身,在患有癫痫的5%儿童和成人患者的血液中也检测到了GFAP抗体。这种自身免疫反应可能发生在外周血中GFAP水平升高的易感性个体中,但这是癫痫发作的结果还是导致癫痫发生的原因还需要进一步的研究。
S100β
荟萃分析表明,癫痫患者的血液S100β水平高于健康对照组。在TLE患者中,海马硬化患者的血清S100β水平高于非海马硬化患者,这可能反映了反应性星形胶质细胞增生的程度和癫痫灶的结构损伤。然而,对这些数据的解释必须考虑到S100β由大脑中的其他细胞类型表达,包括神经元和Ng2神经胶质细胞。

关于星形胶质细胞在癫痫中的作用的大部分研究来自动物模型。这些模型能够对致痫过程进行纵向监测,从而提供对疾病机制的深入了解。对星形胶质细胞在人类耐药性局灶性癫痫中的病理作用的深入研究,已经在动物模型中得到验证。
关于星形胶质细胞在遗传性癫痫中的作用仍难以捉摸。支持其参与的证据包括:胶质传递影响与遗传性全身性癫痫有关的丘脑皮质回路;遗传性失神癫痫大鼠的躯体感觉皮质中存在反应性和炎性星形胶质细胞,以及遗传性癫痫性脑病和Lafora进行性肌阵挛癫痫小鼠模型中存在功能障碍性和炎性星形胶质细胞。
尽管癫痫模型中的机制研究揭示了反应性星形胶质细胞中几种信号通路的改变,但不一致和未解决的问题仍然存在。例如,ATP和嘌呤能受体的作用尚不清楚,能量代谢的复杂性如何影响癫痫发作阈值也不清楚。此外,癫痫中星形胶质细胞的反应性伴随着动态转录和分子变化,导致癫痫发生期间代偿和有害表型的复杂组合。
另一个需要进一步研究的方面是星形胶质细胞中某些信号通路的环境特异性作用,如P2Y1受体、COX 2和前列腺素在癫痫模型中根据激活时间的不同而加重或减轻癫痫发作中的双重作用。
单细胞转录组学与功能方法的结合有助于解决这些问题,从而提高我们对癫痫中星形胶质细胞反应性后果的理解,并指导靶向治疗干预的发展。表达可以调节细胞活性的光敏视蛋白的基因治疗,使用CRISPR–cas 9技术的基因编辑,以及选择性靶向遗传修饰的G蛋白偶联受体DREADD的化学遗传化合物的使用,这将实现星形细胞的选择性激活或沉默。
在针对星形胶质细胞功能障碍的药物开发出来并在临床上得到验证之前,必须确定癫痫发展过程中开始治疗的适当时机和最佳治疗持续时间,并且必须选择最合适的患者群体。使用动物模型有助于确定星形胶质细胞变化的动力学及其对病理结果的影响,但将动物体内的这些动力学转化为临床应用的范围有限。星形胶质细胞活化和反应状态的成像或生物流体标记物的鉴定可以帮助设计有效的治疗方案,并促进临床研究中的患者分层。
✦+
+
总结
鉴于星形胶质细胞广泛参与脑稳态并调节大量突触,其功能的改变可导致神经元网络激活的广泛和渐进变化。来自人类癫痫和动物模型研究的证据表明,这种星形胶质细胞功能障碍导致神经元网络异常,从而导致癫痫发作和细胞丢失。
对星形胶质细胞参与癫痫的研究可以为开发专门针对病理机制、具有良好的BBB通透性且副作用最小的药物提供新的机会。这种疗法可以包括胶质细胞传递和缝隙连接偶联的调节剂、代谢疗法、抗炎和抗氧化治疗以及减轻BBB功能障碍的药物。解决导致癫痫发病的星形胶质细胞功能障碍也可以为耐药性癫痫患者提供新的治疗机会。
AiBrain内容团队为大家整理了文章的pdf,如有需要,请公众号后台留言“pdf”或扫码添加AiBrain小助手微信获取。


✦往期精彩回顾✦


声明:脑医汇旗下神外资讯、神介资讯、脑医咨询、AiBrain所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享。