
排版 | AiBrain 编辑团队
帕金森氏症 (Parkinson's disease, PD) 是仅次于阿尔茨海默症的第二大神经退行性疾病,主要影响运动神经系统,随着症状加剧可能有认知和行为问题,失智症在病情严重的患者中相当常见。目前帕金森氏症的成因还不清楚,但普遍认为和遗传与环境因子相关。从病理生理学角度,由于α-突触核蛋白(α-synuclein)以路易氏体(Lewy body)的形式堆积,PD被视为一种突触核蛋白病(synucleiopathy),同为突触核蛋白病变的还有多系统萎缩(Multiple system atrophy, MSA)、路易氏体失智症(Dementia with Lewy bodies, DLB)、帕金森病性失智症(Parkinson's disease dementia, PDD)等。这和阿兹海默症当中Tau蛋白堆积形成的神经纤维纠缠(neurofibrillary tangle)和β-淀粉样蛋白板块(Aβ plaques)截然不同。
2022年9月15日,英国剑桥大学MRC-LMB的Michel Goedert教授和Sjors Scheres教授团队在Nature杂志上发表了题为Structures of -synuclein filaments from human brains with Lewy pathology的文章,第一作者为杨扬博士。

在这项研究中,作者通过提取来源于6名患有PD、PDD、DLB病人脑组织中α-突触核蛋白细丝,应用冷冻电镜技术解析重构了纤维结构。作者发现PD、PDD、DLB的α-突触核蛋白原纤维是一样的,由单个原纤维核心组成(见下图)。
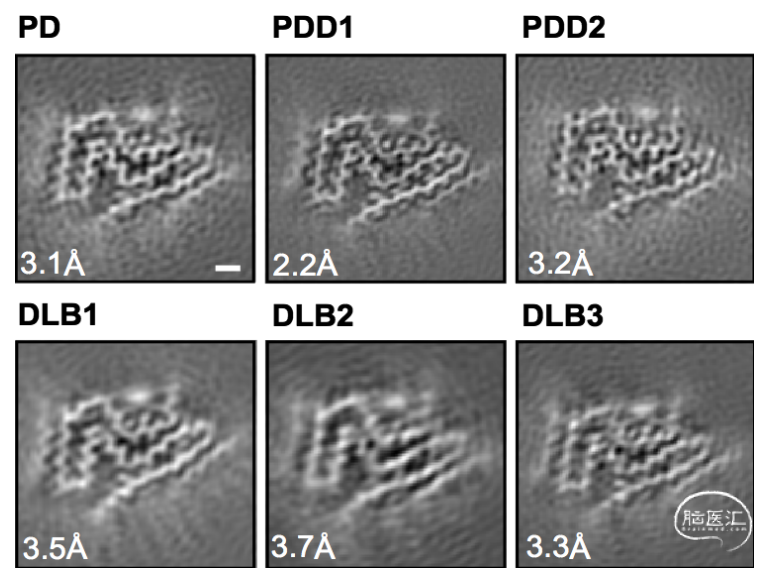
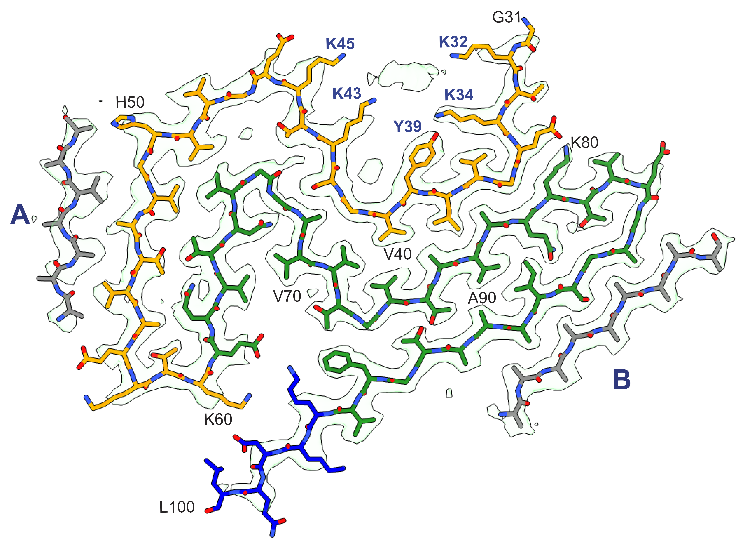
研究人员将这个核心称为“路易折叠”是由α-突触核蛋白的31-100位氨基酸组成,共有9个β-折叠组成的三层结构(见下图)。多个路易折叠的蛋白聚集形成右手螺旋的纤维结构。
路易折叠与多系统萎缩(MSA)患者的α-synuclein原纤维结构形成了鲜明的对比。此前,Goedert和同事在MSA中发现了两种类型的α-synuclein原纤维,每一种原纤维由两种原丝组成,共形成四种独特的折叠。PD的α-synuclein原纤维则采用了另一种全新结构。研究结果表明,与tau蛋白一样,α-synuclein纤维的构象依赖于神经退行性疾病。
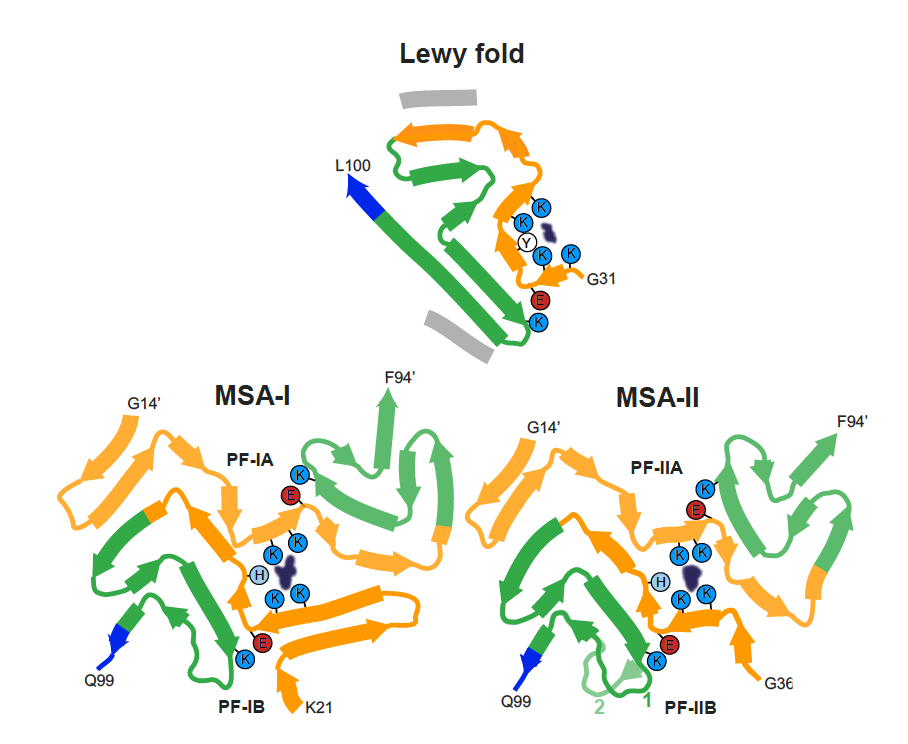
有趣的是,路易折叠类似于体外重组α-synuclein所采用的一些结构,表明至少有一些重组结构可能有生理上的相关性。
总的来说,研究人员通过对6例帕金森氏症、帕金森病性失智症、路易氏体失智症病人的脑组织研究,揭示了α-突触核蛋白细丝结构特征,这些疾病具有相同的原纤维“路易折叠”核心结构,进一步揭示了这些疾病的相似之处。
另外,路易折叠与体外重组α-synuclein结构有一些相似之处。此项研究有助于帕金森氏症及相关疾病的发病机制的探索和治疗药物的研发。
值得一提的是,该团队此前分别揭示了tau蛋白病病人脑组织里的tau蛋白细丝结构1、阿尔茨海默病人和其他疾病病人脑组织中淀粉样蛋白细丝A42蛋白纤维结构2和与衰老有相关性的溶酶体运输调控蛋白TMEM106B纤维结构3。
这些研究非常系统的阐述了不同神经退行性疾病、病理性衰老与相关蛋白tau、A、TMEM106B的高度堆积的关系,为我们理解和针对疾病治疗提供了宝贵的结构基础信息。
原文链接:
https://www.nature.com/articles/s41586-022-05319-3
参考文献(上下滑动查看)
转载自 | BioArt



声明:脑医汇旗下神外资讯、神介资讯、脑医咨询、AiBrain所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享。