
排版 | AiBrain 编辑团队

人类基因组中约有150万个短串联重复位点,迄今为止已发现50余种由短串联重复序列(Short tandem repeats, STR)扩展超过正常范围引起的疾病,统称为多核苷酸重复扩展疾病(Repeats expansion disorders)。
神经元核内包涵体病(Neuronal intranuclear inclusion disease, NIID)是一种以广泛存在于中枢、周围神经系统及外周组织细胞中核内嗜酸性包涵体为主要病理特征的遗传性神经退行性疾病。
NIID临床表现异质性大,主要表现为痴呆、肌无力等,还可见帕金森样症状、小脑共济失调、震颤等运动障碍以及发作性的意识障碍、感觉障碍等症状。2019年,中国、日本不同研究团队独立报道NOTCH2NLC基因5’非编码区GGC重复异常扩展突变为NIID的致病变异。该突变还与东亚人群原发性震颤等运动障碍疾病相关,然而在欧美人群中却很少见。
近年来,有不同学者提出NOTCH2NLC基因GGC重复异常扩展(简称GGC重复)通过GGC上游非经典AUG密码子翻译产生含多聚甘氨酸(polyglycine, polyG)的uN2CpolyG蛋白,产生细胞毒性参与NIID发病。NIID的分子发病机理是研究者的关注热点。
近日,中南大学湘雅医院潘永诚、唐北沙与美国Emory大学金鹏合作在Science Advances期刊发表了题为:Expression of expanded GGC repeats within NOTCH2NLC causes behavioral deficits and neurodegeneration in a mouse model of neuronal intranuclear inclusion disease的研究论文。

该研究构建了国际上首个NIID转基因小鼠模型和NIID患者来源的IPS细胞、人神经祖细胞(hNPCs)模型,发现GGC重复编码产生polyG和多聚丙氨酸(polyalanine, polyA)等多种毒性蛋白共同参与NIID发病,阐明了不均一核糖核蛋白hnRNPM功能缺失引起异常选择性剪接引发NIID的分子机制。
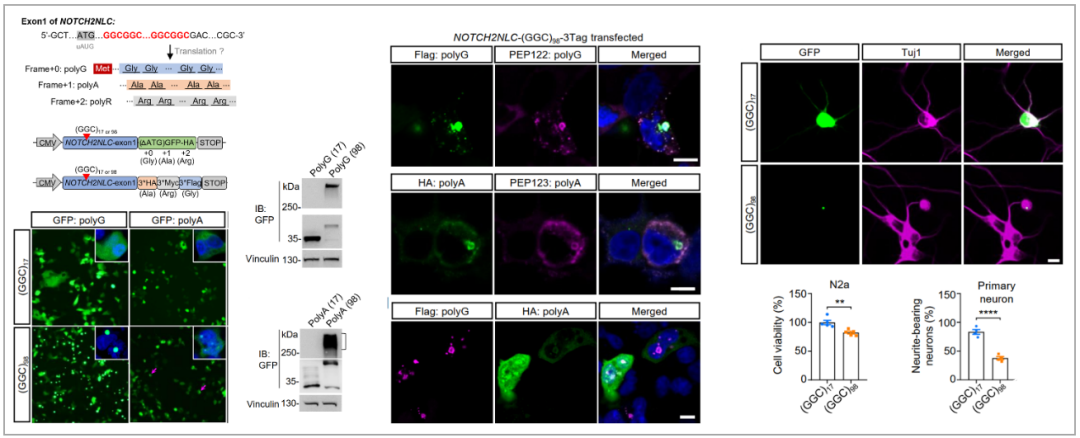
多核苷酸重复扩展疾病中常常可见多核苷酸重复通过不同阅读框产生不同毒性蛋白,论文作者首先通过构建含98次GGC重复序列的NOTCH2NLC-(GGC)98三种不同翻译框的报告载体,表达于HEK293和Neuro2a细胞,发现NOTCH2NLC-(GGC)98通过非经典AUG起始翻译产生NOTCH2NLC-polyG(以下简称为polyG);
与此前几篇研究认为GGC重复只编码产生polyG蛋白不同的是,作者还发现NOTCH2NLC-(GGC)98可能也通过非经典AUG依赖的方式,编码产生了NOTCH2NLC-polyA蛋白(以下简称为polyA)。
作者又通过特异性抗NOTCH2NLC-polyG和NOTCH2NLC-polyA抗体检测和蛋白质谱等方式证实确实产生了polyG和polyA蛋白。作者进一步比较了polyG和polyA蛋白的特性,发现polyG蛋白倾向于形成聚集物,而polyA蛋白可溶性更大;polyA蛋白与部分polyG蛋白存在同一细胞内。并且polyG和polyA均呈泛素和P62阳性,与患者体内核内包涵体呈泛素和P62阳性一致。
这些蛋白在细胞内形成广泛的核内和核周聚集物,对原代培养的小鼠皮层神经元以及Neuro2a细胞都造成一定的毒性。
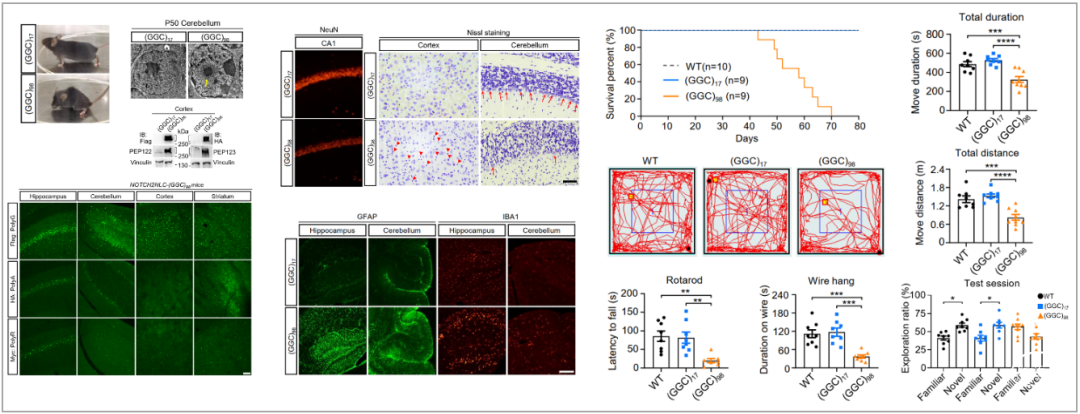
NOTCH2NLC基因是人类特有基因,在小鼠体内无同源基因,为进一步在体内研究该突变的致病机制,作者在小鼠Rosa26位点插入NOTCH2NLC-(GGC)98,建立了条件性转基因小鼠模型。与体外过表达不同的是,作者发现全身性转基因小鼠大脑中除了表达polyG和polyA蛋白外,还产生了多聚精氨酸(polyR)蛋白,在皮层、纹状体、小脑、海马及其他脑区形成广泛的核内聚集物。
同时,作者发现这些蛋白存在时空特异性分布的特点,例如蛋白聚集物最先分布在纹状体、海马和皮层等脑区,逐渐累积到其他脑区;如腓肠肌中只检测到polyG和polyR聚集物等。作者进一步分析了全身性转基因小鼠的病理和行为表现,发现该小鼠模型存在神经元丢失、胶质增生、运动障碍和认知功能障碍等表型,精准模拟了NIID相关的临床和病理特征。
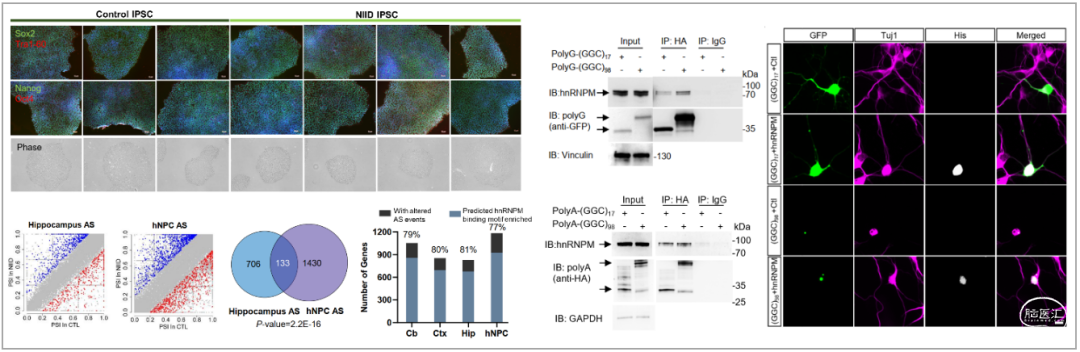
为解析NIID的分子发病机制,作者同时建立了NIID患者来源的IPS细胞并分化成神经祖细胞hNPCs,并对hNPCs细胞模型和转基因小鼠的小脑、皮层和海马组织进行了转录组学分析,通过比较发现了NIID小鼠模型和hNPCs模型之间存在保守的异常选择性剪接事件,利用CLIP-seq数据分析发现不均一核糖核蛋白hnRNPM结合基序的富集。
免疫共沉淀发现hnRNPM与polyG和polyA蛋白相互作用增强,免疫染色发现hnRNPM共定位在polyG和polyA聚集体中可能影响了其剪接调控功能。
进一步,在原代培养的神经元和Neuro2a细胞中过表达hnRNPM可改善过表达NOTCH2NLC-(GGC)98造成的细胞毒性等表型,提示hnRNPM的剪接调控功能异常引发的异常选择性剪接可能在NIID的分子发病机制中发挥重要作用,也为NIID的治疗提供了潜在的靶点。
综上,该研究通过建立NIID患者来源的hNPCs细胞模型和全身性转基因小鼠模型,发现GGC重复异常扩展的NOTCH2NLC基因编码产生多种毒性蛋白,导致NIID样的病理改变和临床表型;发现异常选择性剪接可能在NIID的分子发病机制中发挥重要作用。
中南大学湘雅医院神经内科刘琼、张凯琳和美国Emory大学医学院Yunhee Kang为论文共同第一作者;中南大学湘雅医院神经内科潘永诚、唐北沙和美国Emory大学医学院金鹏为论文共同通讯作者。
唐北沙教授课题组诚邀从事神经退行性疾病基础研究方向的博士后及科研助理加盟,有意者请发送简历至:
bstang7398@163.com,或panyongcheng@csu.edu.cn
论文链接:
https://www.science.org/doi/10.1126/sciadv.add6391



声明:脑医汇旗下神外资讯、神介资讯、脑医咨询、AiBrain所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享。