排版 | AiBrain 编辑团队
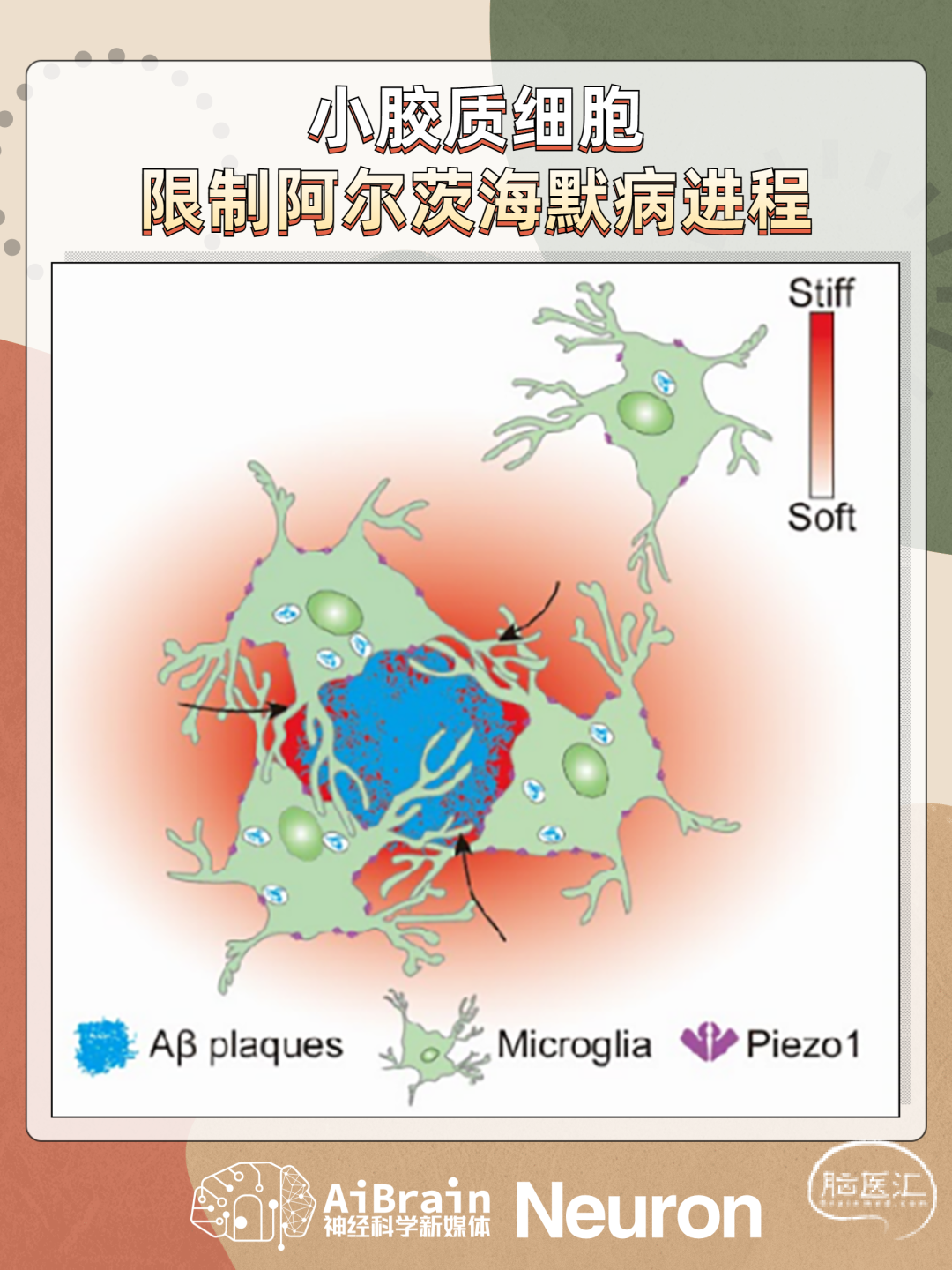
近日,厦门大学莫玮教授团队在Neuron期刊上发表了题为“Microglial Piezo1 senses Aβ fibrils stiffness to restrict Alzheimer’s disease”的研究成果,揭示了小胶质细胞通过机械力受体Piezo1感知纤维化Aβ硬度而激活,并显著改善AD相关病理变化。

此前,AiBrain-爱大脑神经科学新媒体曾对本篇研究作过详细报道,详情点击图片即可跳转查看:

亮点:
Aβ斑块增加组织的硬度
小胶质细胞通过Piezo1感知纤维化Aβ硬度,利于AD小鼠脑中Aβ的清除,减少累积
小胶质细胞Piezo1激活改善Aβ相关病理变化

莫玮教授代表研究团队接受了Cell Press细胞出版社公众号的特别专访邀请,以下是莫玮教授的进一步详细解读:
CellPress
请问您是怎么想到把小胶质细胞、机械力感知受体、阿尔兹海默症联系到一起的呢?
莫玮教授
近年来,随着全基因组测序技术的发展和应用,有许多AD风险基因座被发现,有趣的是,大部分AD相关风险基因在小胶质细胞中独有或在其高度表达,说明小胶质细胞与AD病理变化密切相关。
小胶质细胞可以通过其表面受体与淀粉样斑块中Aβ等化学组分结合,触发小胶质细胞响应,吞噬清除Aβ淀粉样斑块。
有研究表明体外纤维化的Aβ是具有超强硬度的,另一方面小胶质细胞又具有趋硬特性。
所以我们就想纤维化的Aβ在触发小胶质细胞响应中是否有这种物理信号在里面起作用,而细胞对这种硬度等的感知主要通过机械力受体,所以就把这三者联系起来了。
CellPress
我们一直认为阿尔兹海默症病人的大脑与正常人相比是更柔软的,这怎么与您文章提到小胶质细胞感知病人组织硬度统一呢?
莫玮教授
对阿尔兹海默症病人大脑进行硬度测量,确实发现相比正常大脑,病人大脑更为柔软,原因是大量神经元死亡和相伴的脱髓鞘。
我们的发现是在病人大脑的局部区域,文中描述为淀粉样斑块邻近区域,它的物理特性由于淀粉样斑块改变,变得更为刚性。
CellPress
除了小胶质细胞,脑内的其他细胞是否也可能通过Piezo1去感知淀粉样斑块的硬度?
莫玮教授
我们在敲除小胶质细胞Piezo1之后发现,即使再用Yoda1激活Piezo1也不能有效减少AD小鼠脑中Aβ淀粉样斑块累积,说明小胶质细胞Piezo1激活是Yoda1显著降低AD小鼠脑中Aβ淀粉样斑块累积的主要原因。
先前有文献报道少突胶质前体细胞,以及星形胶质细胞也会有Piezo1表达。我们不排除脑中其他细胞比如星形胶质细胞表达的Piezo1会感知淀粉样斑块硬度的可能,那这些细胞中Piezo1对AD病理有何影响,需要进一步探索。
CellPress
您文章中认为小胶质细胞吞噬Aβ淀粉样斑块过程中,Piezo1起到了正向调节作用,怎么解释淀粉样斑块周边小胶质细胞Piezo1高表达,但最后还是不能有效清除Aβ淀粉样斑块?
莫玮教授
对,我们发现在Aβ淀粉样斑块周边的小胶质细胞中Piezo1表达是显著增高的,包括体外软硬胶实验,在有硬度刺激情况下Piezo1蛋白增加。
这种Piezo1蛋白的增高很可能是受硬度刺激形成正反馈的一种作用结果。这提示在有机械力的刺激下,Piezo1可以被激活并引发下游细胞功能,例如吞噬。
所以淀粉样斑块周边小胶质细胞中Piezo1感知不可溶性纤维化Aβ硬度刺激而发挥吞噬功能,但是另一方面也有文章报道可溶性Aβ单体或者寡聚体可以抑制Piezo1活性。
我们知道淀粉样斑块周边是包含大量可溶性Aβ的,所以在前期我们认为Piezo1被激活起到了吞噬、限制淀粉样斑块,但是后期Piezo1活性是被可溶性Aβ抑制了,这可能也是淀粉样斑块周边小胶质细胞即使Piezo1高表达,但最后还是不能有效清除Aβ的一个原因。
在AD小鼠模型中用Piezo1激动剂Yoda1处理确实也发现Piezo1激活是可以缓减Aβ在脑中累积。
CellPress
我看您在文章中用到Piezo1的激动剂Yoda1处理小鼠,在您看来有希望被用到临床上缓解AD的症状吗?
莫玮教授
目前,针对AD治疗还没有完全有效的药物问世。从我们目前的研究结果来看,Yoda1还是有一定潜力的。
我们研究表明Yoda1是可以通过血脑屏障的,小鼠长期皮下给药Yoda1并没有引起明显的肝毒性,同时显著缓减AD小鼠脑中Aβ累积,并改善记忆认知。当然要作为治疗药物,我们还需要做更多,更详细的安全性验证。
总之,我们的研究为AD的药物研发提供了新的潜在靶点。

通讯作者

莫玮 教授
厦门大学生命科学学院教授,细胞应激生物学国家重点实验室副主任,课题组组长,闽江学者,博士生导师,国家杰出青年基金获得者。
研究方向:
主要聚焦在自身和环境变化引起的炎症应激。
学术成就(上下滑动查看):
共同通讯作者

张亮 副教授
厦门大学生命科学学院博士生导师,课题组组长,副教授。
研究方向:
主要从事神经胶质细胞和脑白质相关研究,探索脱髓鞘相关疾病的致病机理,为脑疾病诊治提供潜在靶点。
学术成就(上下滑动查看):
第一作者兼共同通讯作者

胡进 博士
厦门大学生命科学学院工程师。
研究方向:
主要研究方向为阿尔兹海默病等神经退行性疾病致病机理研究。
学术成就:
研究成果以第一或通讯(包含共同)作者发表在Neuron, Molecular Neurodegeneration, Neuropharmacology, PloS One等期刊。
共同第一作者

陈强 博士研究生
厦门大学生命科学学院博士生,师从莫玮教授。
研究方向:
目前从事代谢与炎症方面的研究。
共同第一作者

朱泓瑞 博士研究生
厦门大学医学院硕士毕业生,目前为中国科学技术大学附属第一医院麻醉学在读博士。
研究方向:
从事重症脑保护的相关研究。
共同第一作者

侯立朝 教授
厦门大学医学院教授、博导,厦大附属翔安医院麻醉科主任、主任医师,福建省引进高层次人才,教育部高等学校麻醉学教学指导分委员会委员。
临床特长及研究方向:
在临床上擅长各种疑难危重病人的手术麻醉、急救与复苏、重症救治等,深谙脓毒症的临床表现和诊治现状;在科研上,主要从事脓毒症与围术期脏器功能保护研究,尤其聚焦中枢神经系统损伤免疫炎症机制与防治策略研究。
相关成就(上下滑动查看):



声明:脑医汇旗下神外资讯、神介资讯、脑医咨询、AiBrain所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享。