
排版 | AiBrain 编辑团队
中枢神经系统中,少突胶质细胞形成髓鞘包裹神经元轴突,对快速神经冲动传导有重要支持作用1。因此,少突胶质细胞在中枢神经系统中的广泛分布至关重要。然而少突胶质前体细胞(OPC)在发育中仅在几个有限的区域形成(如大脑中胚胎时期的MGE与LGE,出生后的SVZ)2,并需要经过长距离的迁移,最终实现全中枢神经系统的分布3。
牛建钦教授2016年在Science上发表的文章揭示,OPC利用脑血管作为支架进行迁移4。然而,OPC在迁移到达目的地后,如何从血管上脱离,以及OPC从血管上的脱离是否是其分化的前提,仍然未知。
2022年11月15日,来自陆军军医大学牛建钦团队及中山大学附属第七医院易陈菊团队联合在Neuron上发表了题为Astrocyte endfoot formation controls the termination of oligodendrocyte precursor cell perivascular migration during neocortical development的文章。该研究揭示了发育中星形胶质细胞足突促使OPC在迁移终点脱离血管,并得以分化的偶联机制。

为研究OPC脱离血管的机制,作者首先关注了中枢神经系统中胶质细胞在发育时空中的形态改变,并发现星形胶质细胞足突的形成在时间与空间上与OPC-血管的互作呈现出明显的负相关关系。
形态学上,星形胶质细胞足突介于OPC与血管之间,将二者隔开。作者通过培育Aldh1l1-eGFP:NG2-CreERT:LSL-tdTomato小鼠,分别标记星形胶质细胞(GFP)和OPC(tdTomato),并静脉注射Lectin-Dylight 649,标记血管,从而实现了对小鼠大脑中星形胶质细胞、少突胶质谱系细胞、及血管的活体成像。
实验发现:星形胶质细胞足突的生长与OPC从血管上的脱离,密切相关(图1)。
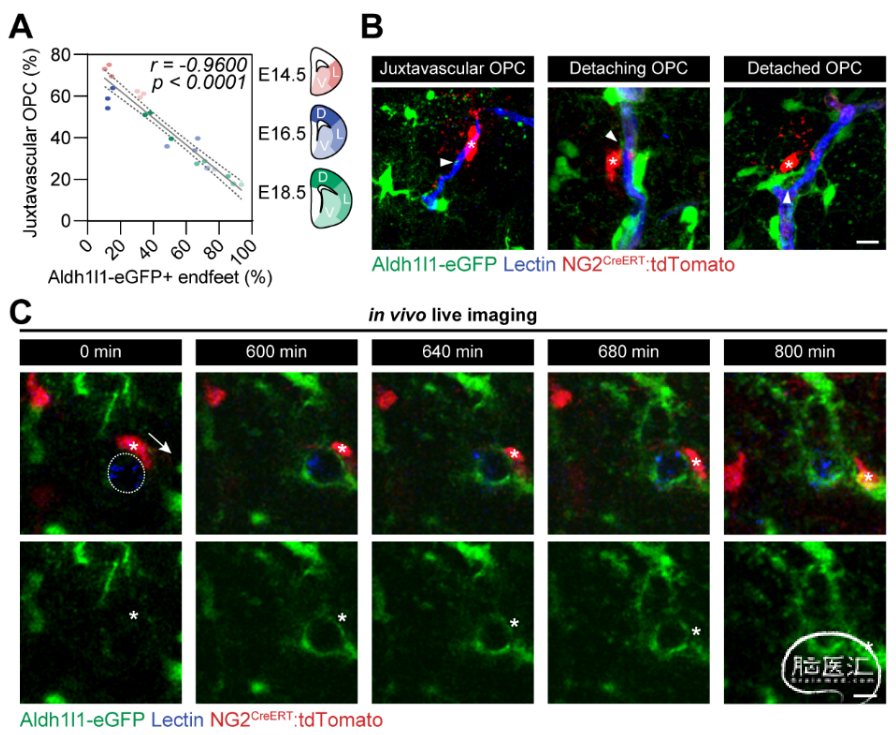
图1 星形胶质细胞足突生长促使OPC从血管上脱离
为了进一步验证星形胶质细胞足突形成促进OPC脱离血管的必要性,作者建立了两种模型(双光子激光消除星形胶质细胞(图1),以及条件性表达DTA以消除星形胶质细胞),并在这两种模型中都观察到OPC-血管互作的增加。说明:星形胶质细胞足突对OPC脱离血管有必要作用。
从细胞发育的角度推测,OPC以血管为支架迁移时,应该存在某种机制抑制其过早分化,从而利于OPC在全中枢神经系统中的扩散,但一直缺乏相关实验证据。在本研究中,作者发现:成熟少突胶质细胞与血管的互作,较OPC显著减少,提示血管可能抑制了OPC的分化。进一步通过体外实验证实,脑血管内皮细胞可通过接触和分泌方式,抑制OPC的分化。而在消除星形胶质细胞的小鼠模型中,由于OPC与血管互作的增加,OPC分化与髓鞘生成减少。因此,OPC脱离血管是其正常分化所必须的。
为探寻星形胶质细胞促进OPC从血管上脱离的机制,作者通过蛋白组学解析了星形胶质细胞与OPC表面潜在的互作蛋白,发现Semaphorin-Plexin的化学排斥作用可参与调控OPC迁移5,因此推测:星形胶质细胞Semaphorin与OPC Plexin的互作,可能介导了星形胶质细胞调控OPC血管脱离的过程。
虽然体外实验中,Sema3a/6a对OPC的分化并没有直接影响,但在体实验敲低星形胶质细胞Sema3a/6a的表达,可增加OPC-血管互作,使更多的OPC保持与血管的接触,从而抑制OPC的分化。反之,在星形胶质细胞中过表达Sema3a,则可促使OPC从血管的脱离,增加OPC的分化(图2)。
这些证据都说明:在发育过程中,星形胶质细胞可通过Sema3a/6a,促使OPC从血管上脱离,并得以进行后续的分化。
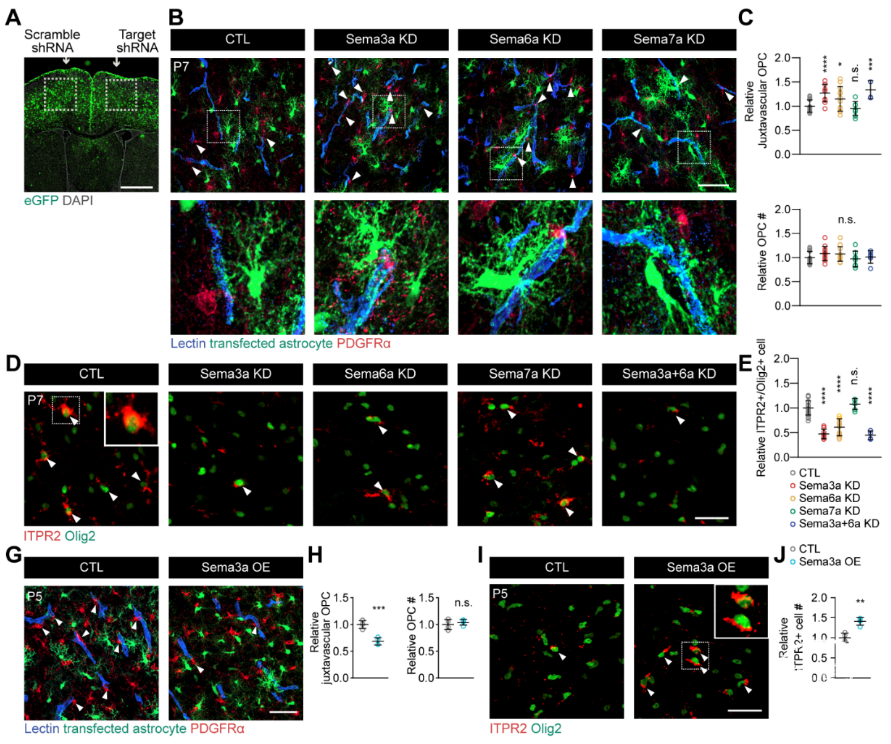
图2 星形胶质细胞通过Sema3a/6a促使OPC从血管上脱离从而进行后续分化
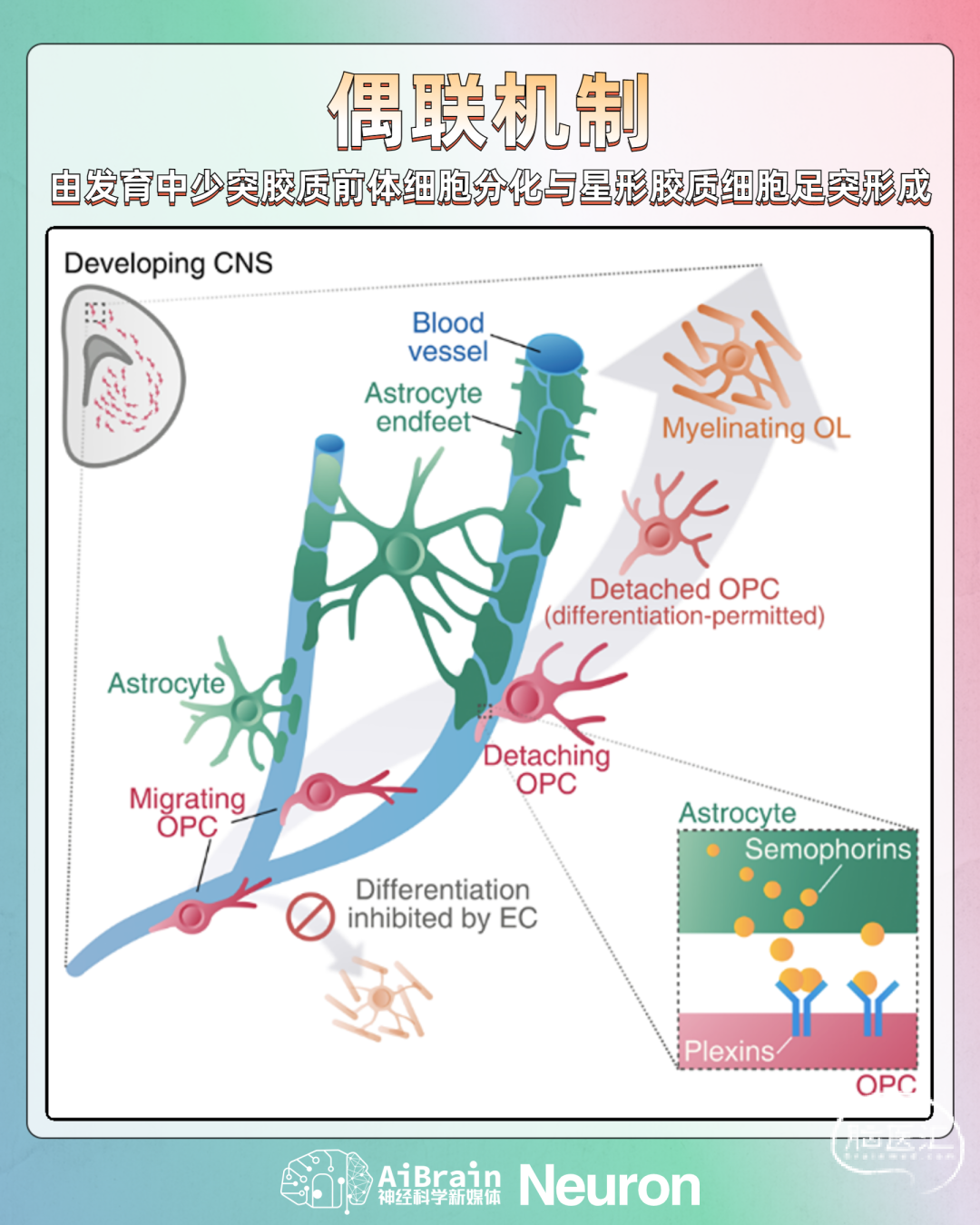
综上,作者们揭示了星形胶质细胞足突形成与少突胶质前体细胞迁移和分化之间的偶联机制。在OPC以血管为支架进行迁移过程中,血管内皮细胞抑制OPC过早分化;而在OPC迁移终点,星形胶质细胞在血管表面形成的足突,促使OPC与血管脱离,使OPC得以分化为成熟少突胶质细胞(图3)。
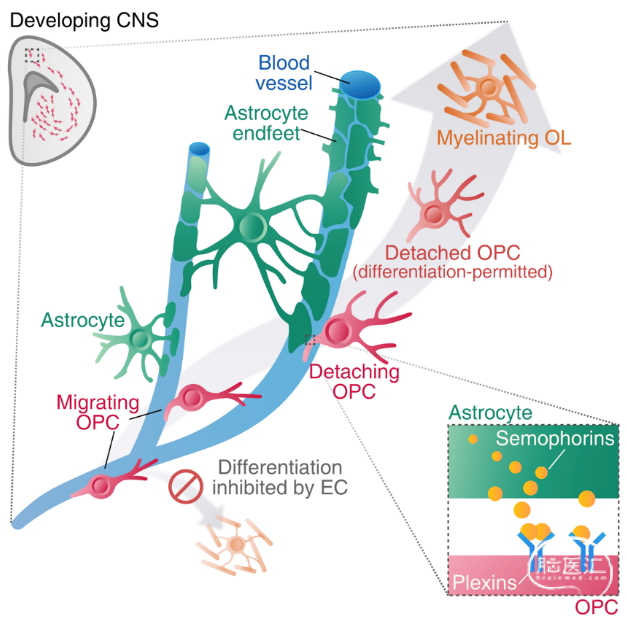
图3 工作模型
该论文的第一作者为陆军军医大学及中山大学附属第七医院助理研究员苏一洵。加州大学旧金山分校(UCSF)的Stephen Fancy教授,中山大学附属第七医院易陈菊教授,与陆军军医大学牛建钦教授(Lead Contact)为共同通讯。
原文链接:
https://doi.org/10.1016/j.neuron.2022.10.032
参考文献(上下滑动查看):
转载自 | BioArt
AiBrain内容团队为大家整理了文章的pdf,如有需要,请公众号后台留言“pdf”或扫码添加AiBrain助手微信获取。



声明:脑医汇旗下神外资讯、神介资讯、脑医咨询、AiBrain所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享。