
基因表达的表观遗传调控,如DNA甲基化和组蛋白修饰等,在脑膜瘤的发生发展中起着重要的作用。研究表明,异常的DNA甲基化是脑膜瘤最常见的表观调控之一,而且结合DNA甲基化进行分子分层,相比于WHO分级,更能对脑膜瘤的预后进行精准预测[5]。
Zeste基因增强子同源物2(enhancer of Zeste homolog 2,EZH2) 是一种重要的甲基转移酶,能够通过调控转录活性进而促进肿瘤细胞的增殖、转移和耐药。在胶质瘤、肺癌、结直肠癌等恶性肿瘤中高表达,并且与不良预后有关[6-8]。但在脑膜瘤中的研究尚缺乏,因此,本文总结了EZH2在脑膜瘤中的相关研究进展。
EZH2的结构和功能
EZH2是PeG蛋白家族的主要成员之一,是多梳抑制复合物2(PRC2)的核心亚基之一,该亚基由其他几个成分组成,如EED、SUZ12和RpAp46/489。能通过其C端SET结构域催化组蛋白H3K27me3和非组蛋白,促进染色质浓缩,调控相关靶基因的表达[9]。

图1. EZH2的功能域示意图及SET结构域催化蛋白质上的赖氨酸残基甲基化的机制
EZH2的作用机制
(1)最早、最经典的的作用机制便是EZH2与其它亚基组成PRC2复合物,通过SET结构域对细胞核中的底物组蛋白H3中27位的赖氨酸残基三甲基化(H3K27me3),导致目标基因的沉默。(2)由EZH2组成的PRC2复合物还可以作用于非组蛋白,导致其甲基化,参与转录调控。(3)EZH2还可通过非PRC2依赖的方式引起非组蛋白的甲基化。(4)EZH2还能通过直接与其它因子形成转录复合物,而不需要依赖PRC2,激活下游的目标基因转录。[10,11]

图2. EZH2的作用机制
EZH2在非典型脑膜瘤中表达上调
在一项149例脑膜瘤(I级102例,II级47例)的研究中,EZH2的免疫组织化学表达在II级肿瘤中明显高于较低级别肿瘤(38.3%比6.0%;p<0.001)。大多数阳性病例显示低表达水平,仅在2例非典型脑膜瘤中检测到EZH2的强表达。凸面脑膜瘤的EZH2表达比颅底更高(19.5%比6.3%)。EZH2免疫阳性在增殖活性高的区域更为明显。EZH2表达高的病例其增殖活性(MIB-1 LI)显著高于阴性病例(平均值±SD–7.9±6.2 vs 3.7±3.3;p<0.001)[12]。在mRNA转录分析中也验证了EZH2在非典型脑膜瘤中的表达更高[13]。此外,研究还发现,EZH2在复发性脑膜瘤中的表达更高[14]。
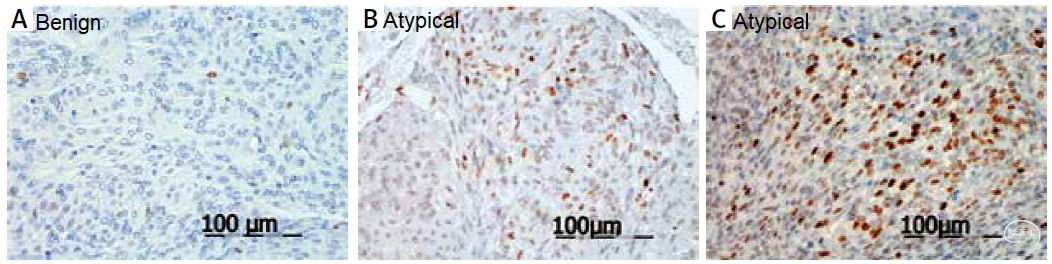

图3. EZH2在脑膜瘤中的表达。A, B, C:EZH2免疫组化在脑膜瘤中表达阴性,低表达和高表达;D:mRNA转录结果表明EZH2在非典型脑膜瘤中高表达;E:EZH2在复发组(红色)比未复发组表达更高(p=0.003)
EZH2对脑膜瘤预后的影响
研究发现,EZH2是脑膜瘤无进展生存期的独立影响因素,与阴性病例相比,EZH2表达阳性的病例,其无进展生存期明显缩短(平均PFS 135.4 vs 223.7周;p=0.007)[12]。

图4. EZH2与对脑膜瘤无进展生存期的影响
在脑膜瘤中Let-7家族负调控EZH2的表达
研究发现非典型与良性样本中ESCs中H3K27me3和EZH2靶点的超甲基化增加,超甲基化水平与非典型的可能性相关。研究者还发现let-7家族的5个成员(let-7a, let-7b, let-7c, let-7d, let-7e)在非典型脑膜瘤中有异常表达。该miRNAs家族已被证明在各种癌症,如前列腺癌和神经母细胞瘤中表达下调。研究发现非典型脑膜瘤中let-7家族的下调与EZH2mRNA表达的上调相关。重要的是,除let-7b外,这些miRNA的表达水平(在非典型脑膜瘤和良性脑膜瘤中分别缺失75%和47%)不受CNV事件的影响。[13]

图5. EZH2-ChIP-seq信号的聚集图。显示了以高甲基化(红线)和低甲基化(蓝线)位点为中心的EZH2-ChIP-seq信号(先前在hESCs中报道)的聚集图。分析显示非典型与良性样本中ESCs中H3K27me3和EZH2靶点的超甲基化增加。超甲基化水平与非典型的可能性相关。

小结
EZH2是表观遗传学方面的重要基因,在多种恶性肿瘤的已被广泛研究,但在脑膜瘤中的研究尚缺乏。目前的研究发现EZH2在非典型脑膜瘤中高表达,并且与不良预后相关,let-7家族负调控着EZH2的表达。由于EZH2复杂的作用机制,既可以甲基化组蛋白和非组蛋白,也可以通过PRC2依赖和非PRC2依赖的方式,导致基因沉默或转录激活。因此,EZH2在脑膜瘤中的作用及机制仍需要进一步研究。
参考文献
作者简介

余锦秀
复旦大学附属华山医院神经外科
复旦大学附属华山医院神经外科,肿瘤学硕士,神经外科博士在读
导师:复旦大学附属华山医院神经外科宫晔教授
目前的主要研究方向:脑膜瘤的基础与临床研究
“阔然生物医药科技(上海)有限公司(Shanghai KR Pharmtech, Inc. , Ltd.)”简称“阔然基因”,成立于2015年,总部位于上海,专注于精准医学转化研究与应用,致力于提供多应用场景的一站式分子诊断解决方案。旗下拥有三家高新技术企业和一家专精特新小巨人企业,拥有上海和徐州双研发中心、两家医学检验实验室(“零缺陷”通过CAP权威认证)和精准医学科技研究院,凭借“服务+产品”双重模式开展肿瘤分子诊断、肿瘤免疫微环境检测等业务。首创NGP(下一代病理)+NGS(下一代测序)的临床新应用服务,推动精准医学发展、行业联盟及行业标准的建立,注重分子诊断试剂产品研发、注册、生产和销售,目前拥有6款IVD产品注册申报储备,服务中国500余家医院和科研机构,建立了庞大的基因组数据库,秉承“践行精准医疗”的使命,推动我国医疗事业发展。
阔然精准诊疗脑肿瘤产品CaptioX-M是一款以NGS技术为基础的检测产品。CaptioX-M用于脑膜瘤的分子诊断,涵盖了脑膜瘤复发相关的67个基因(NF2、TERTp、CDKN2A/B、ARID1A和BIP1等)、预后相关的染色体(22q、1p、5、10等)拷贝数变异和潜在靶向治疗相关基因的信息,脑膜瘤CaptioX-M可用于脑膜瘤患者分子分型、预后评估和辅助医生制定治疗策略。

声明:脑医汇旗下神外资讯、神介资讯、神内资讯、脑医咨询、Ai Brain 所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。




