
撰稿 | 飞猪 加州理工学院博士后
排版 | AiBrain 编辑团队

食物中毒后会引发恶心呕吐,促使机体将毒素从体内排出,这些反应是机体很重要的防御措施,而这个防御机制也导致了化疗药物的副作用。
大量研究已证实位于后脑延髓的孤束核(NTS)、3型5-羟色胺受体(5-HT3R)和神经激肽1受体(NK1R)等在介导恶心呕吐中发挥关键作用,但消化道中的毒素如何通过肠脑轴将信号传递到大脑从而导致行为,尚不清楚。
来自北京生命科学研究所(NIBS)的曹鹏博士实验室在小鼠上构建了研究呕吐行为的啮齿动物行为范式,详细解析了这一机制,在线发表于近期的《Cell》上。第一作者兼通讯,谢志勇,已入职复旦大学脑科学转化研究院。

Cell (IF 41.58) 2022.11.01上线
由于啮齿类动物没有呕吐反射,之前对呕吐的大量研究都是利用其它哺乳类动物,例如狗、猫、鼩鼱等,而弄清呕吐在分子和神经环路水平的肠脑轴机制需要便捷的分子工具和技术,实验室小鼠作为此类需求最成熟的动物模型之一,是最佳选择。
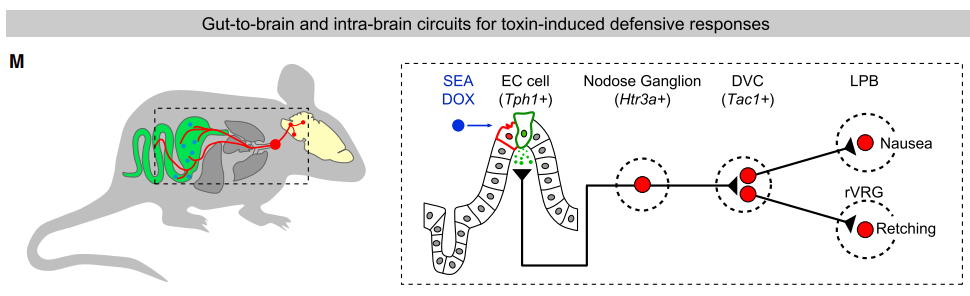
作者首先建立了检测小鼠呕吐的行为范式——腹腔注射葡萄球菌肠毒素A(SEA)或化疗药物等,测量与干呕相关的张嘴角度、横膈膜肌肉和腹肌的肌电图(EMG),以及条件性口味回避(CFA)。
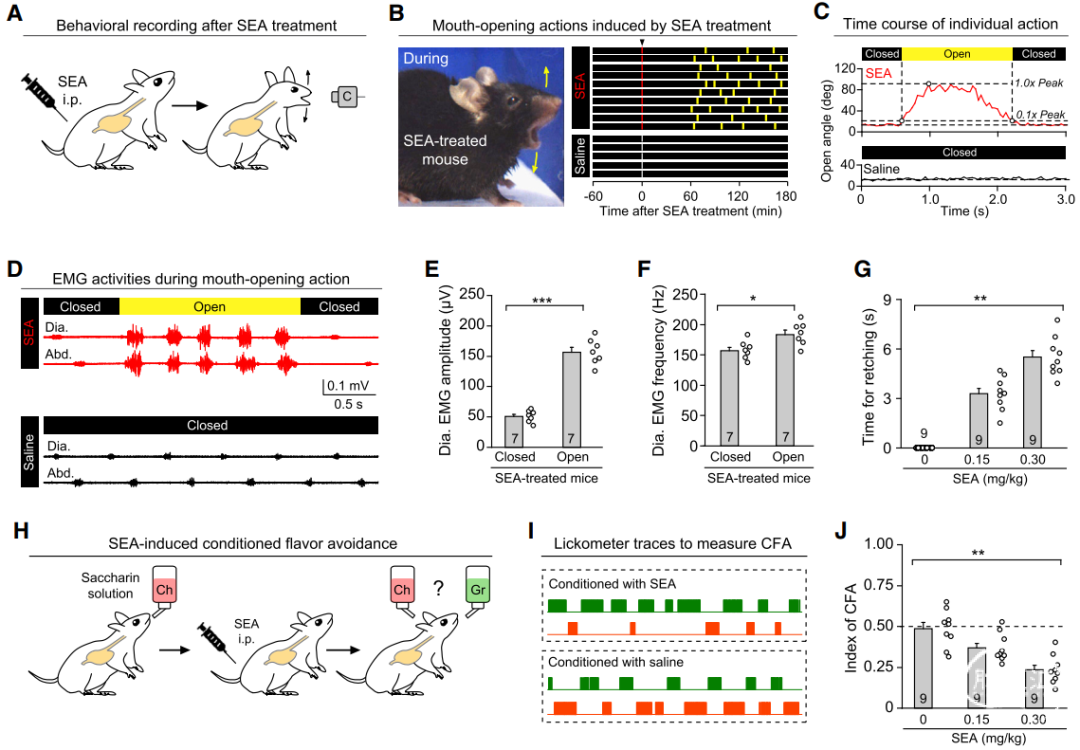
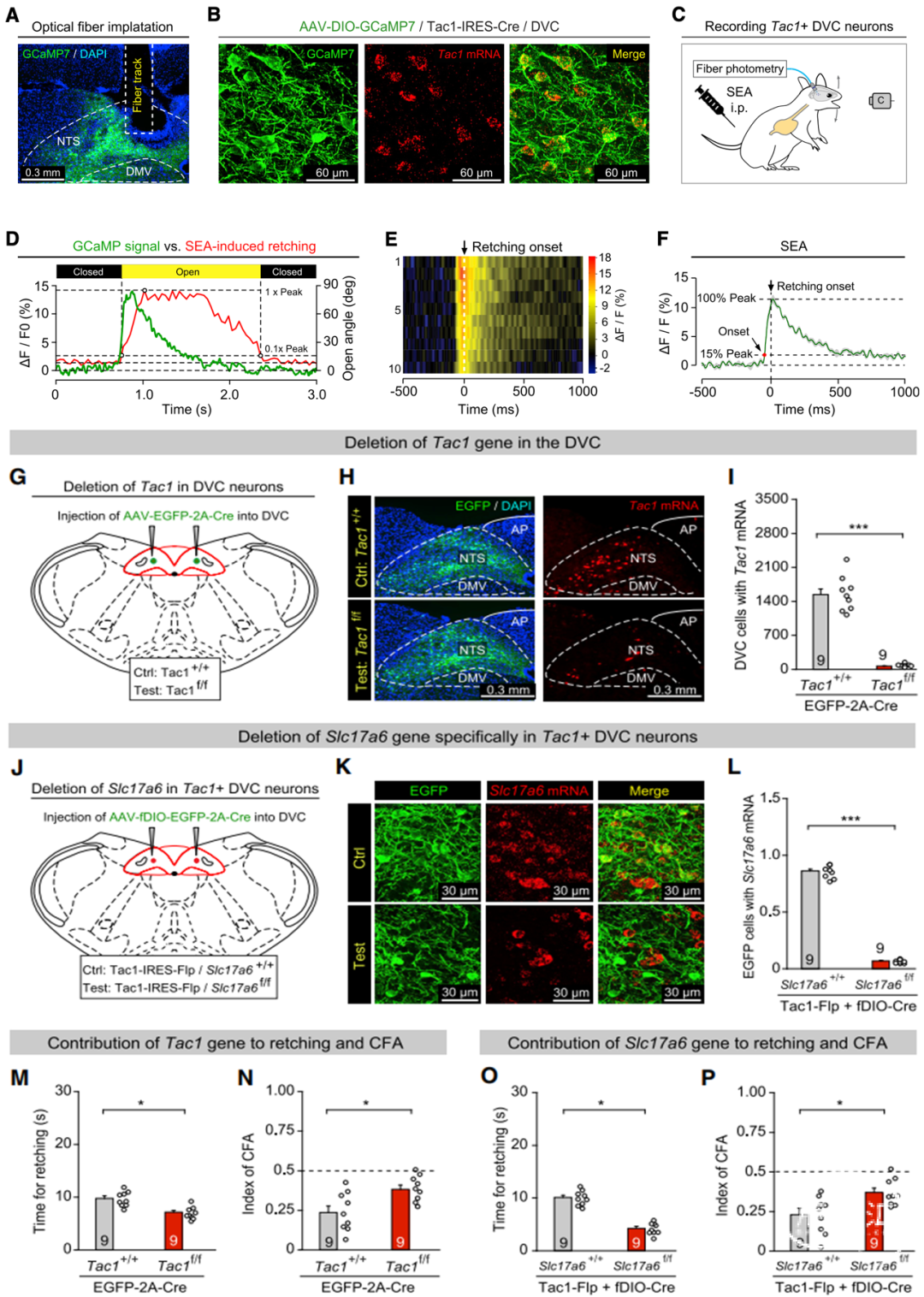
利用FosTRAP2技术,作者成功标记了与作呕行为相关的背侧迷走复合体(DVC)神经元,主要集中在NTS;利用单细胞RNA测序和荧光原位杂交(FISH)技术,文章确认这群DVC神经元能被Tac1标记。
通过光遗传学和化学遗传学实验,激活这群神经元能诱导干呕和CFA,失活则能抑制这两种行为;而荧光光度计成像也证实,DVCTac1在作呕行为中被激活,其钙信号响应与行为在时间上高度相关。实验还发现,DVCTac1是一群谷氨酸能兴奋性神经元,释放谷氨酸和Tac1编码的神经肽。在不影响细胞其它功能的情况下,特异性敲除Tac1和Slc17a6基因分别抑制神经肽和谷氨酸的合成与释放,都能够有效抑制干呕和CFA。
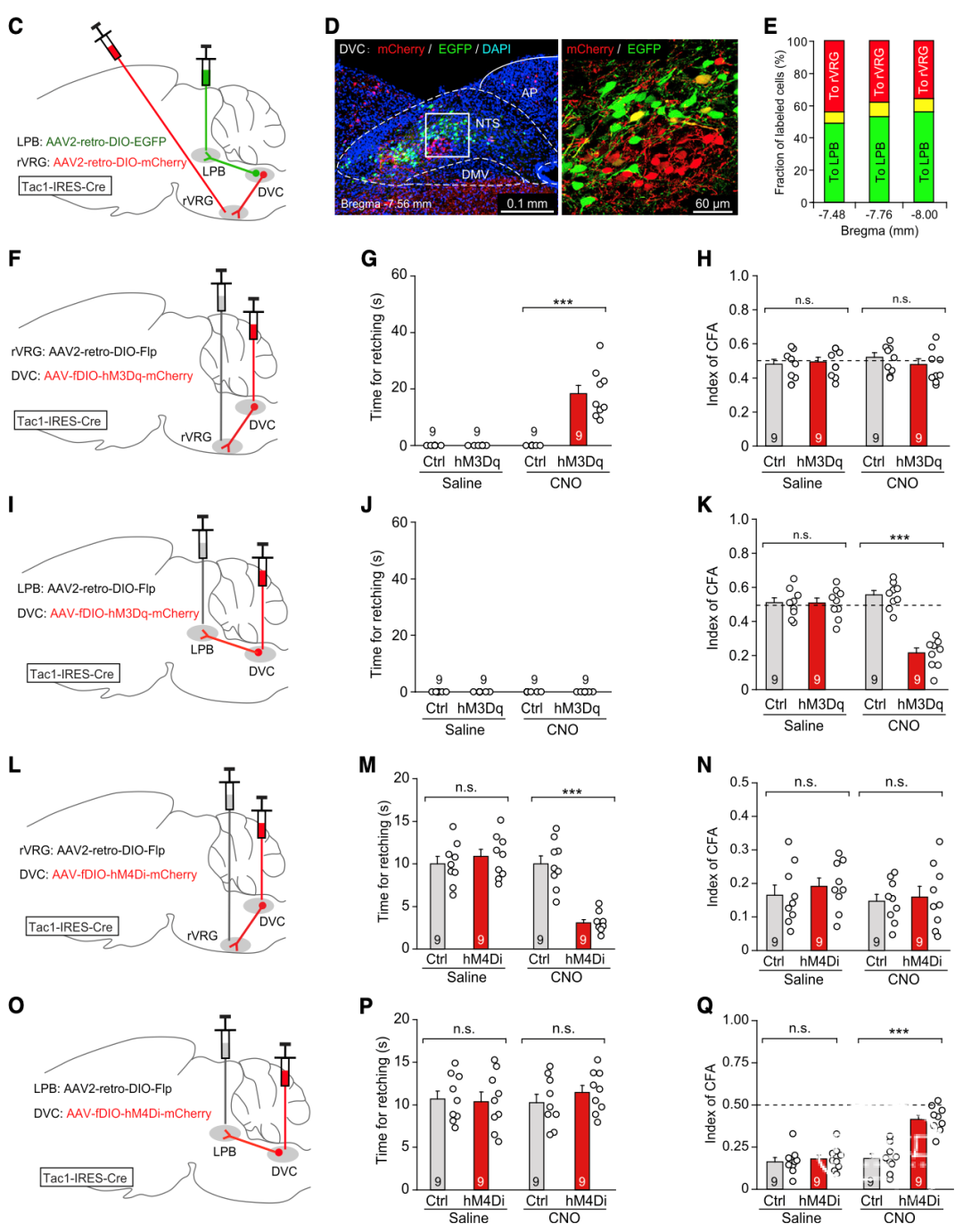
进一步分析DVCTac1的下游,文章发现两个独立通路——一路投射到腹外侧延髓的腹侧呼吸群喙部(rVRG),介导干呕而非CFA;另一路投射到外侧臂旁核(LPB),介导CFA而非干呕。
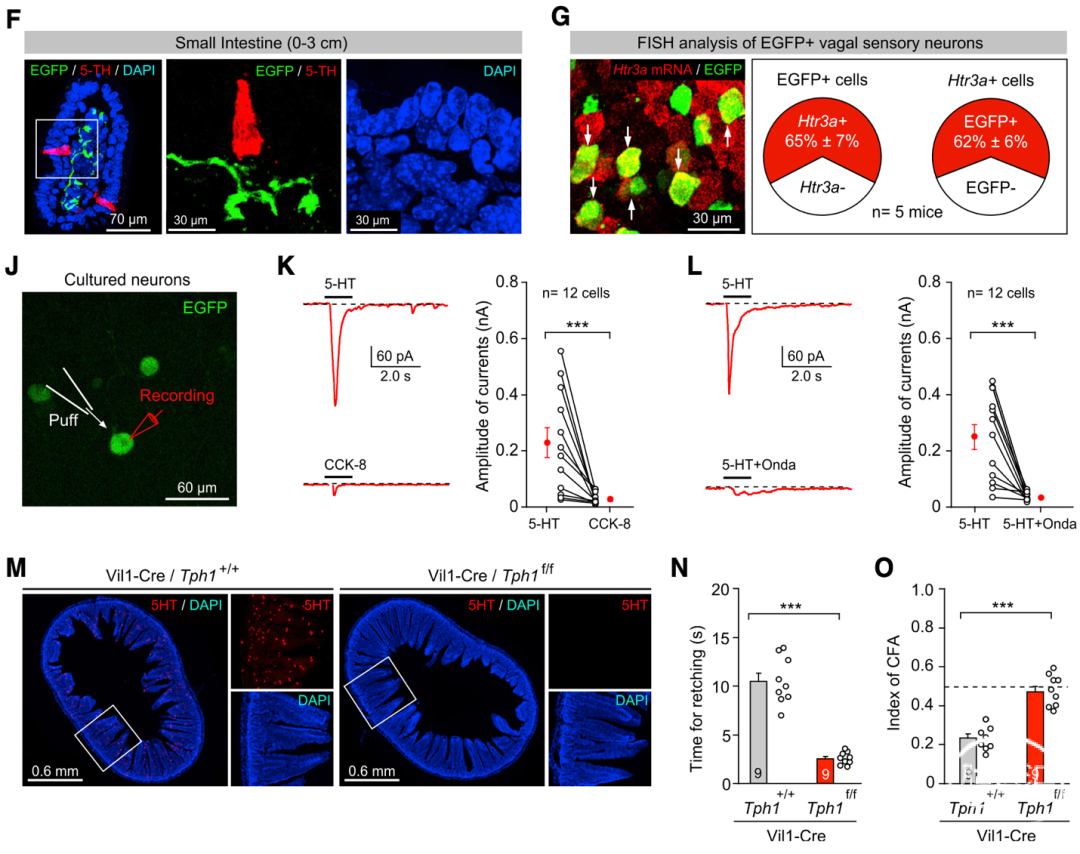
接下来为确认投射到DVCTac1的外周神经输入,文章利用重组狂犬病毒(RV)的单突触逆向追踪和FISH等技术,发现其直接上游是一群大部分能被Htr3a标记的迷走神经结状神经节(NG)神经元。这些神经元在胃肠道的末梢与5-HT阳性的肠道内分泌细胞(EC)十分靠近,离体实验也证实,它们能被5-HT通过5-HT3R受体激活。
进一步的功能缺失实验表明,EC释放的5-HT参与介导干呕和CFA。由于SEA或化疗药物不能直接激活这些EC细胞、NG神经元或DVCTac1,作者推测它们引起的作呕很可能是通过免疫-神经内分泌通路实现的——小肠上皮细胞释放细胞因子IL33,通过EC上的IL33受体促进其5-HT释放。
✦+
+
亮点
本文通过各种分子工具和技术,详细解析了食物毒素或化疗药物引起恶心呕吐的肠脑轴机制——通过免疫-神经内分泌通路促进消化道EC释放5-HT,激活5-HT3R阳性NG神经元,从而激活位于后脑延髓的DVCTac1神经元,再通过其到rVRG和LPB的投射,分别介导干呕和CFA。
曹鹏
北京生命科学研究所研究员
研究方向:脑功能和脑疾病的生物学基础
个人介绍:
http://www.nibs.ac.cn/yjsjyimgshow.php?cid=5&sid=6&id=1633
文章链接:
https://www.sciencedirect.com/science/article/pii/S0092867422013149
AiBrain内容团队为大家整理了文章的pdf,如有需要,请公众号后台留言“pdf”或扫码添加AiBrain助手微信获取。

✦往期精彩回顾✦



声明:脑医汇旗下神外资讯、神介资讯、脑医咨询、AiBrain所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享。