
排版 | AiBrain 编辑团队
机体内绝大多数的炎症反应伴随着局部组织的红肿热痛及机能障碍。机体通过一群外周神经系统的感受神经(Nociceptor感觉神经元,痛觉感受器)来感受外界不良刺激介导的生理性疼痛。
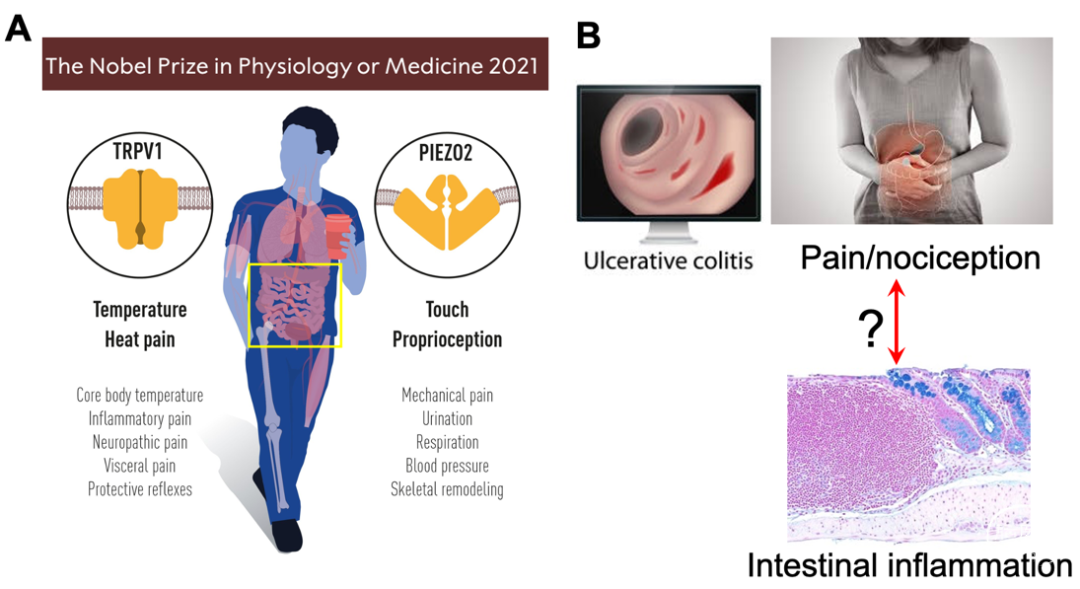
痛觉感受器高表达非选择性阳离子通道TRPV1,可以被各种物理及化学刺激所激发(如温度超过43°C、低pH值(酸性环境)以及辣椒的有效成分辣椒素),活化的痛觉感受器分泌相应神经肽(Neuropeptide)向中枢神经系统传递和调节痛觉(Nociception)以及整合各种疼痛信息(2021年这项研究工作被授予了诺贝尔医学奖)1-3。
近年来的研究发现痛觉感受器除了传递和调节痛觉,也具有一定免疫调节功能4,5。这项研究工作关注的炎症性肠病(IBD)是一种病因尚不完全明确的慢性肠道炎症性疾病,其主要症状包括腹痛和腹泻等6,7。
IBD目前并没有根治的方法,因此进一步了解炎症性肠道疾病的发病病理对于开发新型治疗有着重要的作用。
2022年10月14日,美国康奈尔大学威尔康奈尔医学院David Artis实验室团队(张雯博士为第一作者)在Cell杂志上发表了题为Gut-innervating nociceptors regulate the intestinal microbiota to promote tissue protection的文章,首次揭示了痛觉感受神经元TRPV1+痛觉感受器通过调控肠道微生物菌群在肠道损伤和肠道炎症中起到的关键保护作用。

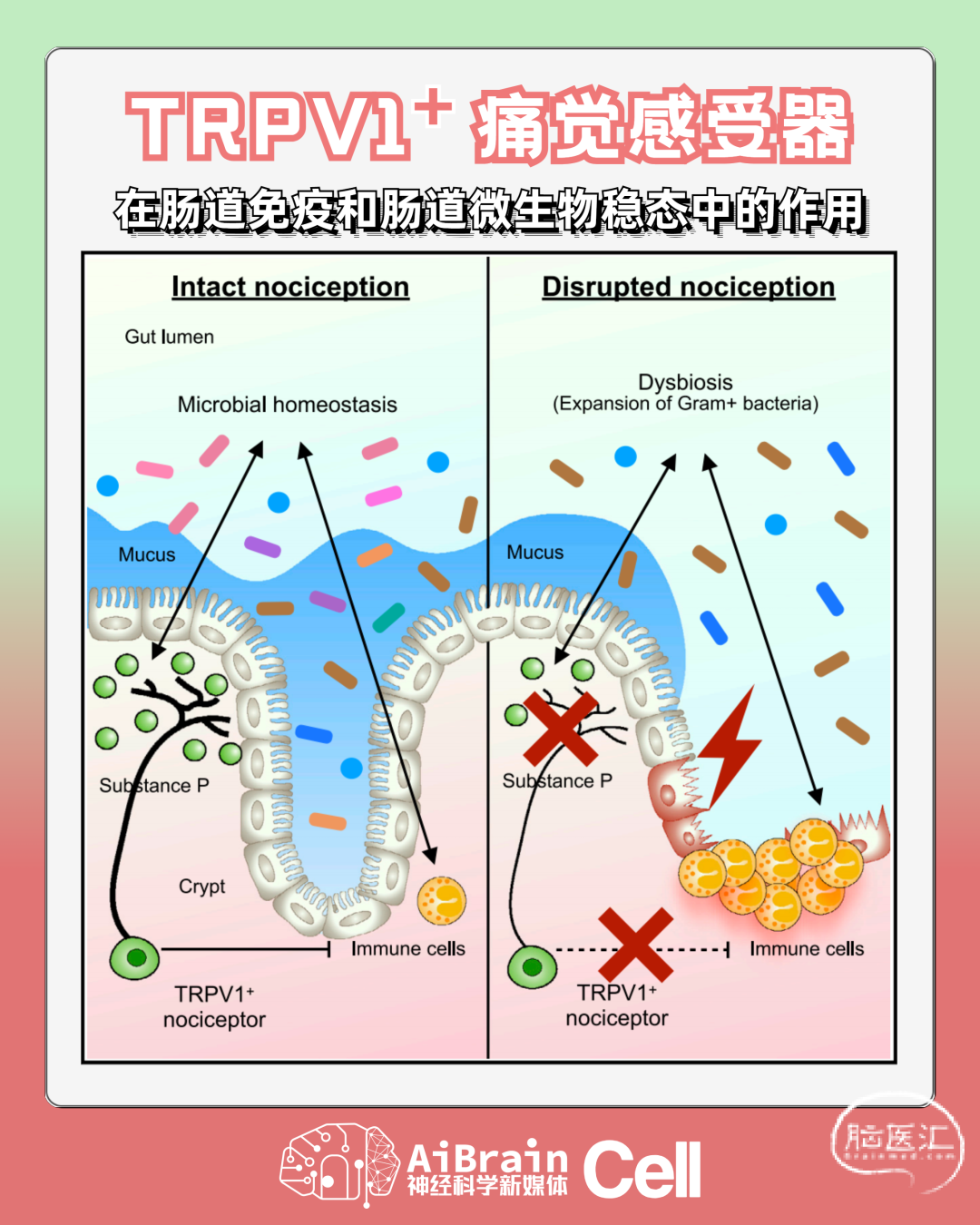
为了研究“TRPV1+痛觉感受神经元在调控肠道炎症以及炎症性肠病中具有什么功能”这一科学问题,研究人员运用神经生物学和化学遗传学(Chemogenetics)的方法,通过特异性调控TRPV1+痛觉感受器的活性和功能,结合小鼠的肠炎损伤模型,发现在抑制痛觉感受器的活性和功能之后,小鼠对肠炎损伤的易感性显著加重。
此外,通过使用一种天然化学物质树脂毒素(Resiniferatoxin/RTX)永久清除TRPV1+痛觉感受器之后,缺失痛觉感受器的小鼠同样对肠炎损伤具有更高的易感性。这些数据说明TRPV1+痛觉感受器在小鼠肠炎损伤模型中具有关键的组织保护功能。
那么,TRPV1+痛觉感受器具体是如何介导这种组织保护功能的呢?研究人员通过一系列免疫学分析和微生物学高通量测序研究,发现缺失痛觉感受器的小鼠的肠道微生物菌群发生了显著的变化。
通过运用无菌小鼠和含特定菌群的小鼠模型(Gnotobiotic mouse model),研究人员发现如果将缺失痛觉感受器小鼠的肠道微生物菌群移植到无菌小鼠体内,被移植缺失痛觉感受器小鼠微生物菌群的受体小鼠也会获得对于肠炎损伤更高的易感性。
通过使用一系列抗生素来特异性清除不同的微生物菌群,研究人员发现革兰氏阳性菌(Gram+)的菌群失调是导致缺失痛觉感受器小鼠具有更高的肠炎损伤易感性的主要原因之一。
有意思的是,研究人员在梭状芽孢杆菌属Gram+ Clostridium spp.的单菌群小鼠模型中也看到了和SPF小鼠的一样的表型。这些数据说明TRPV1+ nociceptor通过调控肠道菌群的稳态来保护肠道组织免受外界损伤诱导的肠炎。其中,革兰氏阳性菌群以及Gram+ Clostridium spp.是可能受到这群神经元调控的关键靶向菌群。
接下来,TRPV1+痛觉感受器具体是否通过分泌神经肽来调控肠道微生物菌群以及肠道炎症呢?研究人员发现痛觉感受器在小鼠肠炎损伤模型中会活化并分泌神经肽Substance P,而且Substance P的缺失也会导致小鼠肠道菌群失调进而获得更严重的肠道炎症。
关键的是,通过在缺失痛觉感受器的小鼠体内回补Substance P之后可以一定程度降低其对肠道炎症损伤的易感性,也说明了痛觉感受器是通过分泌Substance P来介导其在肠道损伤和肠道炎症中的组织保护功能。
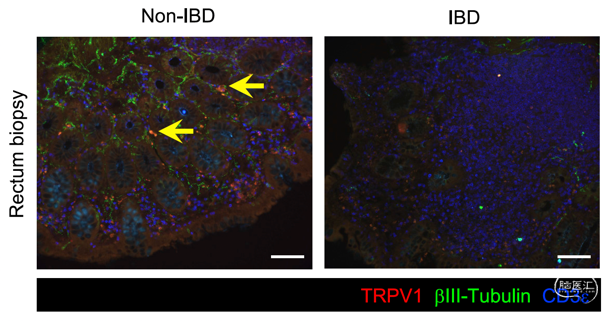
最后,研究人员观察到在IBD病人的肠道活检组织中,痛觉感受器的标识蛋白TRPV1水平显著降低,这说明在IBD病人中这一群痛觉感受神经元的功能也可能受到慢性炎症或者失调肠道菌群的调控。
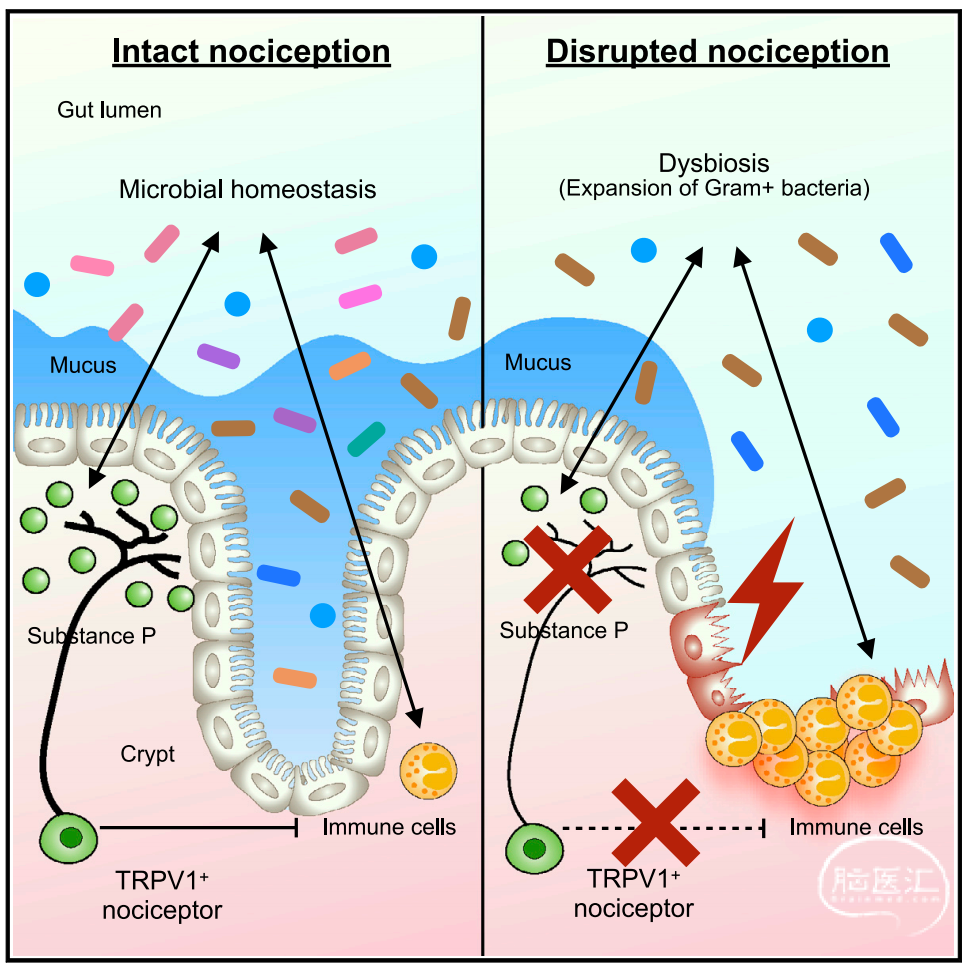
综上所述,这项研究首次揭示了TRPV1+痛觉感受器作为痛觉感受神经元的全新免疫调控功能以及神经——微生物相互作用(neuron-microbiota crosstalk)在肠道免疫和肠道微生物稳态中的关键作用,更是对肠道疾病患者的临床治疗提供了重要的理论参考和新的思路。
该研究主要由康奈尔大学威尔康奈尔医学院David Artis实验室团队完成,其中张雯博士为论文第一作者。在该研究中做出贡献的还有多个科研团队,包括康奈尔大学威尔康奈尔医学院Chun-Jun Guo实验室团队和圣路易斯华盛顿大学医学院Hongzhen Hu实验室团队。
在同期Cell上,来自哈佛大学的Issac Chiu实验室团队也发表了相关研究论文Nociceptor neurons direct goblet cells via a CGRP-RAMP1 axis to drive mucus production and gut barrier protection,得出了相似的结论,以上研究丰富了感受神经元TRPV1+痛觉感受器在肠道免疫中的调控功能,为研究神经免疫互作在调控肠道稳态以及肠道炎症中的机制做出了重要贡献。
对此,AiBrain也进行了报道,欢迎感兴趣的读者点击查看:

原文链接:
https://doi.org/10.1016/j.cell.2022.09.008
https://www.cell.com/cell/fulltext/S0092-8674(22)01196-5
参考文献(上下滑动查看):
转载自 | BioArt



声明:脑医汇旗下神外资讯、神介资讯、脑医咨询、AiBrain所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享。



