撰稿 | AiBrain 内容团队
排版 | AiBrain 编辑团队
脑损伤后,丘脑胶质细胞激活触发的炎症反应会增加癫痫发作的风险,并导致认知障碍。近期,美国加利福尼亚大学Gladstone 研究所Jeanne Paz作者在《Science Translational Medicine》发表了最新的研究成果,表明小鼠脑损伤后丘脑激活的星形胶质细胞GABA 转运体(GAT3)表达减少,导致癫痫和产生认知功能障碍的风险升高。在该细胞群中恢复 GAT3 的表达可以缓解脑损伤带来的负面影响。因此,丘脑星形胶质细胞可以作为治疗脑损伤的潜在靶点。

在中风或创伤性脑损伤时,损伤部位的许多细胞几乎都会死亡。炎症细胞的聚集,有助于清理坏死细胞和分子碎片。丘脑位于大脑中心深处,可能远离损伤部位,该区域星形胶质细胞被激活后,可以导致级联的炎症变化。
该团队先前的研究表明,在啮齿动物中,丘脑中星形胶质细胞的激活是脑损伤模型的常见后果。然而,星形胶质细胞也发挥着支持神经元的关键作用,例如控制神经元的微环路并为它们提供营养。
丘脑星形胶质细胞增生
在这项研究中,科学家们想要确定丘脑中星形胶质细胞的激活是否有助于大脑恢复或导致继发损伤,或者同时具有积极和消极的影响。
研究者们首先假设激活的丘脑星形胶质细胞可能在脑损伤的一些长期症状中起作用——包括癫痫发作和睡眠问题的风险增加。因此,该团队最初并没有研究脑损伤的小鼠模型,而是在健康小鼠上通过向腹侧基底丘脑(ventrobasal thalamus)注射病毒,激活丘脑星形胶质细胞。
他们发现,仅仅激活丘脑星形胶质细胞就足以引起与受伤后类似的大脑活动模式的改变,并使小鼠容易癫痫发作。
分析活化的星形胶质细胞的分子特性时,他们发现这些星形胶质细胞丢失了一种称为 GAT3 的GABA转运体。结果,抑制性神经递质无法被及时清除,进而作用于突触后神经元的突触外GABAA受体(图1),增加了强制性抑制(tonic inhibition);腹侧基底丘脑的神经元的低阈值T型钙通道开放,因而表现出更低的动作电位阈值,从而导致神经元过度兴奋,以及对癫痫发作的易感性提高。
如果丘脑星形胶质细胞中 GAT3 的缺失导致神经元功能障碍,那么增加GAT3的表达是否能够恢复神经元的功能?
为了回答这个问题,该团队与加州大学洛杉矶分校的 Baljit S. Khakh 博士团队合作,增加星形胶质细胞中的 GAT3的表达。值得注意的是,增加丘脑星形胶质细胞中特异性的 GAT3 水平足以降低活化的星形胶质细胞引起的神经元过度兴奋和癫痫发作的风险。
该团队接下对小鼠颅脑创伤模型进行了研究,结果发现这些小鼠丘脑星形胶质细胞中 GAT3 水平的增加也降低了癫痫发作的风险和死亡率。
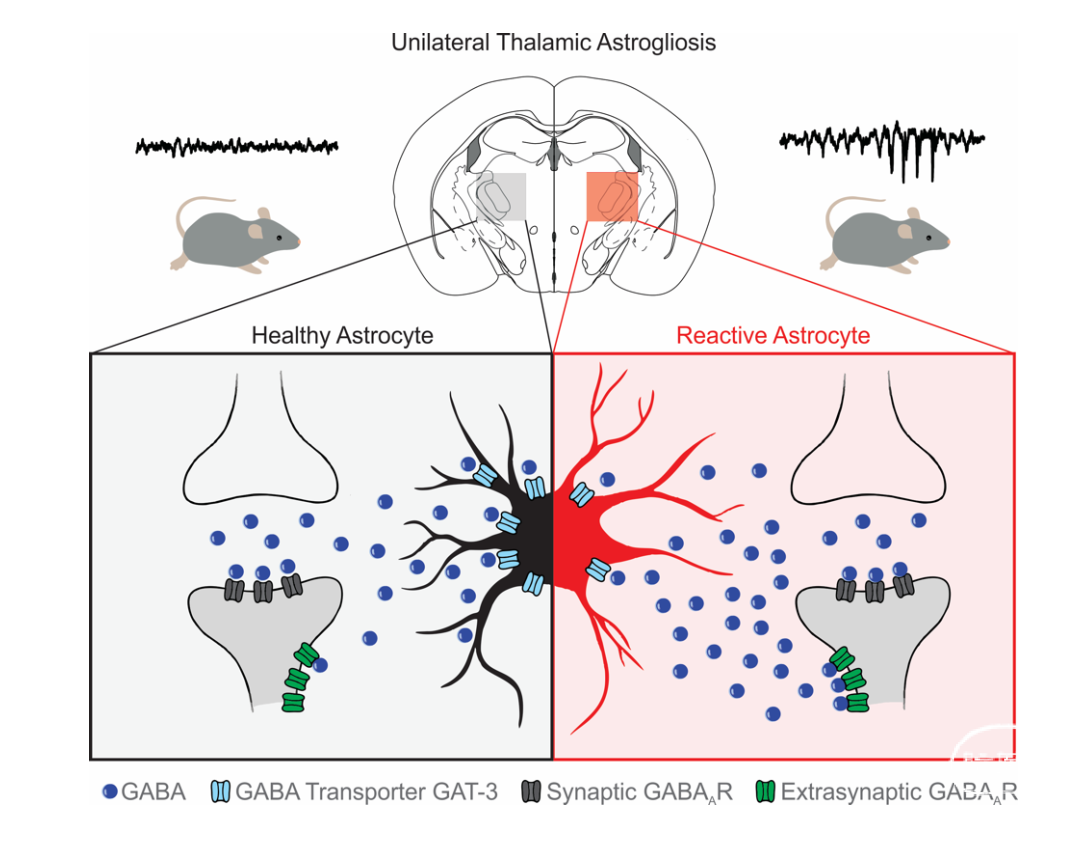
图1 GAT-3 作为底物来触发细胞过度兴奋和癫痫发作风险。左:丘脑中未受干扰的“健康”星形胶质细胞(黑色)示意图,GABA 转运蛋白 GAT-3(浅蓝色)正常表达,负责摄取 GABA(蓝色)。右:丘脑中反应性星形胶质细胞(红色)GAT-3 的表达降低。突触后神经元(灰色)的突触外区域中 GABA 浓度的增加导致了由突触外 GABAA 受体(绿色)介导的GABA 突触后电流增加三倍之多。而由突触中 GABAA 受体(深灰色)介导的抑制性突触后电流的频率和动力学没有改变。通过条件性的阻断突触外 GABAAR或增强形胶质细胞 GAT-3的表达,可预防星形胶质细胞活化引起的癫痫发作风险。
Jeanne Paz介绍,“与其他大脑区域相比,脑损伤后的丘脑研究相对较少,我希望这只是许多新研究的开始,进一步确定该区域如何帮助大脑抵御受伤后果方面的重要性。”
这项研究的第一作者Cho说,“星形胶质细胞对大脑非常重要,不能仅仅通过摆脱活化的胶质细胞来治疗疾病,我们需要确定是否可以将活化星形胶质细胞的破坏作用与其保护作用分开。活化的星形胶质细胞在很多方面都与未活化的星形胶质细胞完全不同,因此令人惊讶的是,我们可以针对GAT3的变化来预防脑损伤的后果。”
在对因中风和颅脑创伤去世患者的脑组织样本分析中有人发现,这些患者丘脑星形胶质细胞中的 GAT3 水平似乎较低。
研究人员希望随着对丘脑研究的更多关注,未来从尸检活检中收集到的丘脑样本数据更加丰富;希望继续收集小鼠和人类的长期数据,以研究脑损伤后丘脑中星形胶质细胞活化的时间过程。由于丘脑的这些变化发生在最初的脑损伤之后,临床医生可能会在这段时间内进行干预以阻止或逆转它们,防止癫痫的风险。


美国加利福尼亚大学Gladstone 研究所;
致力于研究动物疾病模型和新的治疗干预来改善癫痫患者的预后;
实验室的一个标志性方法是光遗传学,应用于破坏活体动物特定脑细胞的功能。使用该方法,团队确定了丘脑在各种形式癫痫中的作用,也是未来治疗的希望靶点;
目前的研究包括:
丘脑如何控制远隔大脑区域的癫痫发作,以及中风和创伤等脑损伤如何导致癫痫。
疾病领域:
阿尔茨海默氏病、自闭症、Dravet 综合征、癫痫、中风、创伤性脑损伤
专业特长:
脑电图、电生理学(体外和体内)、微型脑成像、光遗传学、癫痫发作预测
发表文章:
[1] Secondary thalamic neuroinflammation after focal cortical stroke and traumatic injury mirrors corticothalamic functional connectivity. Necula D, Cho FS, He A, Paz JT. J Comp Neurol. 2022 05; 530(7):998-1019.
[2] Complement factor C1q mediates sleep spindle loss and epileptic spikes after mild brain injury. Holden SS, Grandi FC, Aboubakr O, Higashikubo B, Cho FS, Chang AH, Forero AO, Morningstar AR, Mathur V, Kuhn LJ, Suri P, Sankaranarayanan S, Andrews-Zwilling Y, Tenner AJ, Luthi A, Aronica E, Corces MR, Yednock T, Paz JT. Science. 2021 Sep 10; 373(6560):eabj2685.
[3] Gamma rhythms and visual information in mouse V1 specifically modulated by somatostatin+ neurons in reticular thalamus. Hoseini MS, Higashikubo B, Cho FS, Chang AH, Clemente-Perez A, Lew I, Ciesielska A, Stryker MP, Paz JT. Elife. 2021 04 12; 10.
更多详情:
https://gladstone.org/people/jeanne-paz

✦往期精彩回顾✦


声明:脑医汇旗下神外资讯、神介资讯、脑医咨询、AiBrain所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享。