
今天刊登的是由中国医师协会神经外科分会神经重症专家委员会、北京医学会神经外科分会神经外科危重症学组、中国神经外科重症管理协作组在《中华神经医学杂志》2022年7月第21卷第7期专家共识上发表的“神经重症目标温度管理中国专家共识(2022版)”,执笔者:曲鑫、徐跃峤、胡锦、魏俊吉、王宁、周建新,通讯作者:王宁、周建新,欢迎阅读。
低温疗法作为人体疾病的一种治疗方法,已有长达几千年的历史,而人们认识到低温对神经系统损伤的保护作用也有着几百年的历史。既往大量动物实验表明,低温能降低神经细胞代谢率,减低脑组织对能量及氧的需求,降低脑损伤后的炎症反应,减轻脑水肿和降低颅内压,保护受损的神经元[1-2];一些临床研究也表明,治疗性低温(therapeutic hypotherma,TH)在某些疾病中能降低死亡率,改善患者的预后,但同时,TH也会影响人体各组织器官的代谢及功能,可能会产生较严重的并发症而影响治疗效果[3-4]。目前,随着神经重症医学理念及技术的飞速发展,TH方法的改进以及患者病理生理改变多模态监测水平的提高,TH对全身的不良反应已大大降低。然而,我们也应该认识到,TH的实施是一个复杂的过程,不仅要求实施团队具有深厚的医学基础和丰富的临床经验,更需要指南或共识来指导其具体的临床实施,从而减少不良反应发生,发挥出TH的最大效能。
2011年5个国际专业协会建议用“目标温度管理(targeted temperature management,TTM)”取代“TH”及“轻度低温”,以强调体温管理的范围及其重要性[5-6]。目前国际上TTM的应用正越来越多,已基本取代或涵盖了TH及轻度低温。
目前,我国医疗资源包括人员及设备的配置极不均衡,TTM治疗的依从性不高且缺乏公认有效的操作管理流程与管理规范。鉴于此,我们组织了国内神经内外科、重症医学科、急诊科以及专门从事神经重症、神经创伤基础研究的专家们,复习了近年来TTM在神经重症中的基础与临床研究进展以及最新的指南与共识,结合相关单位及各位专家的临床经验,就TTM的概念、适应证、实施方法、目标温度控制与监测及并发症的预防与管理等方面进行了阐述,总结归纳并制定了管理流程,以推动TTM的同质化管理和持续质量改进,从而方便相关医护人员规范、优化和个体化地应用TTM治疗神经重症患者,让患者受益并将风险降到最低。
TTM包括TH、正常体温控制和发热治疗[7]。正常体温控制是指核心温度控制为36.0~37.5℃[8];TH就是应用物理方法配合药物将体温快速降到既定目标水平(32.0℃≤核心温度<36.0℃),并维持在恒定的温度,一段时间后缓慢恢复至正常体温,并且避免体温反弹的过程[9]。(1)根据目标温度控制范围,分为正常体温(36.0℃≤核心温度≤37.5℃)、轻度低温(34.0℃≤核心温度<36.0℃)、中度低温(32.0℃≤核心温度<34.0℃)、中深度低温(30.0℃≤核心温度<32.0℃)和深度低温(核心温度<30℃)[10-11]。TH通常是指轻度及中度低温。
(2)根据TTM时程,分为短时程(≤72h)、中时程(72h~5d)、长时程(≥5d)[12-13]。
(3)TH根据降温范围,分为选择性局部低温和全身低温[14]。
(4)根据临床应用时间,TH分为“预防性”低温(急性颅脑损伤如脑外伤后或其他神经重症发病后2.5h之内,在继发性脑损伤发生之前如颅内压升高前应用)和“治疗性”低温(治疗顽固性颅内压升高)[7,15]。
TTM具有降低颅内压和神经保护作用[16]。其作用机制包括:
(1)降低脑代谢,温度每下降1℃,脑氧代谢率可下降6%~7%[17];
(2)调节脑血流量,预防再灌注相关的脑水肿或脑出血,减少氧自由基的产生;
(3)抑制细胞凋亡通路的激活;
(4)减少损伤后炎症反应;
(5)抑制基质金属蛋白酶活性,保护血脑屏障,以减少继发性脑水肿及颅内压升高等。
所有神经重症患者均适合于TTM,其中下列疾病适合于TH[18]:
(1)重型或特重型颅脑损伤[格拉斯哥昏迷量表(GCS)评分3~8分],伴顽固性颅内压升高(颅内压≥30mmHg,1mmHg=0.133kPa)[12-13]。有研究发现对GCS评分4~8分且颅内压≥30mmHg脑损伤患者实施长时程TH能获得较好预后[13]。
(2)其他神经疾病引起的常规处理无效的中枢性高热。
(3)心跳骤停复苏自主循环恢复后昏迷(成人)[19],新生儿缺血缺氧性脑病。
(4)大脑半球大面积(≥大脑中动脉供血区2/3面积)脑梗死[20-21]。有研究证实大面积脑梗死后去骨瓣减压术联合TH较单纯去骨瓣减压术有降低患者短期病死率的趋势[22]。
(5)HuntHess分级Ⅳ或Ⅴ级蛛网膜下腔出血[23-24]。
(6)幕上大容积脑出血[25]。
(7)难治性超难治性癫痫持续状态[26]。
(8)急性细菌性脑膜炎或脑膜脑炎伴颅内压升高[27]。
TH的绝对禁忌证包括[28]:
(1)伴严重复合多发伤或已处于全身衰竭期患者;
(2)合并低血压、休克尚未纠正患者;
(3)活动性出血,或怀疑有颅内血肿、正处于观察阶段患者;
(4)严重心肺功能不良患者;
(5)恶性心律失常未有效控制患者;
(6)脑死亡患者。TH的相对禁忌证包括[28-29]:
(1)GCS评分3分,双侧瞳孔散大,无自主呼吸;
(2)血小板减少(<50×1012/L);
(3)凝血功能障碍;
(4)长时间(>60min)心跳停止。
(一)常用方法
TTM的常用方法包括体表降温、药物降温和血管内降温技术[30-31],其中,体表降温技术又包括传统与新型体表降温技术。
1. 传统体表降温技术:冰袋、酒精擦浴、普通冰毯等是临床上最容易实施的降温方法,但其缺点是劳动强度相对大,不容易达标或出现过度降温,不能有效地维持目标温度,也不容易控制复温速度。
2. 新型体表降温技术:新型体表降温技术就是用包裹式冰毯、冰垫包裹患者身体,设备有温度自动反馈调控系统,通过循环冷水或冷空气而达到降温目的。其优点是临床上容易实施,且能快速启动TH,但缺点是费用较高,及容易造成患者皮肤冻伤。
3. 冰生理盐水输注降温技术:冰生理盐水能有效地诱导快速降温,但不能有效地长时间维持目标温度[32]。4℃冰生理盐水一般用于院前急救,用量为20~30mL/kg,总量不超过2000mL。其对温度调控的精确度较差,有时候容易降到目标温度以下,有引起肺水肿、心衰或自主循环恢复后再次心脏骤停的风险。目前临床研究表明,院外心脏骤停患者使用冰生理盐水静脉注射降温没有明显获益,且会增加并发症的发生率[33]。
4. 体内降温技术:体内降温技术即血管内降温技术。血管内降温设备通过置入下腔静脉的热交换导管来诱导低温[34]。这种设备能严密地控制核心温度的改变,包括快速降温速率、恒温期温度稳定及控制性复温,且温度变异度最小[35]。血管内降温技术的最快降温速度能达1.5~4.5℃/h,能快速达到目标温度[36]。其不利因素主要为置管时的侵入性操作及与导管相关的副作用,如血栓形成或血流相关感染等。建议优先选择具有温度反馈调控装置的新型体表降温技术或血管内降温技术进行TTM。如不具备条件,也可选择传统体表降温技术(普通冰毯、冰帽、冰袋)进行降温,但需更严密地监测核心温度。(二)实施前准备工作
在启动TH之前,需进行如下准备工作[28]:(1)稳定血流动力学,或给予小剂量血管活性药物维持血压。(2)镇痛镇静:建议深镇静,Richmond躁动-镇静评分达-4分为宜;建议保留患者的咳嗽及自主呼吸。(3)建立人工气道,并予机械辅助通气。(4)深静脉置管:建立有效的静脉通道,以保证镇痛镇静及血管活性药物等及时输入。若实施血管内降温技术治疗,一般不需重建深静脉通道。(5)置入鼻胃管或鼻肠管:因TH启动后,患者的胃肠功能明显被抑制,胃肠蠕动减弱,易出现胃潴留或返流误吸,所以需提前置入鼻胃管或鼻肠管。(6)持续脑温或核心温度监测(应用食管、膀胱或直肠探头)。(7)有创血压监测:因低温时镇痛镇静药物、利尿剂等作用的影响,患者易出现血压波动,建议进行有创血压监测。(8)备好降温设备:选择普通冰毯、包裹式冰毯或血管内热交换导管等。(9)团队建设:TH实施团队中需有一名副主任或以上职称医师负责整个过程,需有一名护师负责整个过程中护理相关内容。
(三)温度测量部位
脑温测量包括直接测量和间接测量2种方式。直接测量就是将温度探头或多参数监测探头置入脑实质、脑室或硬膜下测量温度[37]。考虑到颅内温度分布的不均一性,建议以侧脑室脑脊液温度为脑温的“金标准”[38]。拟进行正常体温控制的神经重症患者建议测量脑温,因为脑温是我们监测及干预的目标。不过,脑温测量为有创性操作,有出血或感染的发生风险。当缺少直接测量脑温的探头或设备时,建议采用接近脑温且相对稳定的核心温度来替代脑温。核心温度测量部位包括鼓室、颞动脉、直肠、膀胱、食道和肺动脉[37]。温度测量部位的顺序建议首选脑部,其次是食道、膀胱。因直肠温度反应较慢,不推荐用直肠探头来进行核心温度监测[39]。实施正常体温控制的患者也可用体表温度监测。
(四)启动时间
TTM启动越早、降温速度越快,其治疗效果越好[40]。心脏骤停患者建议尽可能在自主循环恢复后8h内开始TTM。急性颅脑损伤、缺血性脑卒中、出血性脑卒中患者也应尽早(6~72h)开始TTM治疗,或者根据继发性神经功能损伤程度确定TH的开始时间。
(五)持续时间
对于重型颅脑损伤伴颅内压≥30mmHg患者,因脑水肿高峰期多在颅脑损伤后3~5d,维持5d以上的长时程TTM,获益较明显[13]。欧洲复苏委员会和欧洲重症监护协会2021版复苏后指南建议:心肺复苏后自主循环恢复患者至少维持24h TTM(32~36℃),且昏迷患者为避免发热(>37.7℃)至少维持TTM 72h[19]。急性缺血性脑卒中患者的目标温度维持时间为24~72h,出血性脑卒中患者为3~5d,难治性癫痫持续状态患者为3~5d,热射病患者为24~72h,或者根据患者的病理生理监测及影像学检查结果来决定[27]。大面积脑梗死患者推荐目标温度为33~36℃,维持时间为24~72h[41]。
(六)实施阶段
TH分为4个阶段:诱导、维持、复温和正常体温控制阶段(图1)[42]。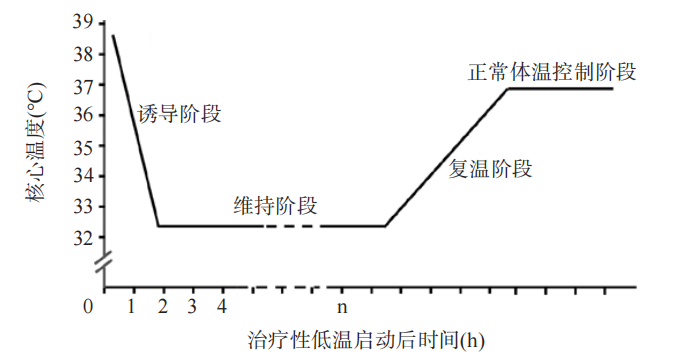
1. 诱导阶段:(1)原则:①尽快达到目标温度,但目前没有一个目标温度适用于所有的患者,应根据患者脑内病情进行设定及调整目标温度。②保持呼吸、循环、脑灌注压(60~80mmHg)、电解质水平等的稳定。③防治寒战、低血压等并发症。(2)操作及注意事项:①镇痛镇静:氯丙嗪100mg、异丙嗪100mg、哌替啶150mg加生理盐水39mL配成50mL,微量泵入(速率0.5~4mL/h);20g/L丙泊酚5~15mL/h速率微量泵入;咪达唑仑100mg加生理盐水30mL,3~10mL/h速率微量泵入,维持Richmond躁动-镇静评分为-4分,麻醉深度30~50;芬太尼(瑞芬太尼或舒太尼)微量泵入,以防治寒战,同时保留患者自主呼吸、咳嗽功能;不建议常规使用神经肌肉阻滞剂,但在TTM期间出现严重寒战时可考虑使用[19];建议在开始TTM之前就应用镇痛镇静药物预防寒战发生[43]。②目标核心温度设定:32~36℃;实施血管内降温技术时将降温速率设为最大(MAX模式);应用包裹式冰毯时将机器模式设为Cooling,然后启动机器运行,以尽快达到目标核心温度。③呼吸机模式设置为SPONT或SIMV。(3)监测指标:①实时监测生命体征(血压、呼吸、脉搏、血氧饱和度、心电等),测量中心静脉压、颅内压、脑灌注压、皮肤温度、核心温度(食道、膀胱或直肠),观察瞳孔变化。②每1~2小时监测血气分析,调控目标pH值为7.35~7.45、动脉血二氧化碳分压为35~40mmHg、动脉血氧分压为80~120mmHg、钾离子浓度为3.5~5.3mmol/L[7](因此阶段易出现低钾血症,所以尤应注意血钾浓度)。③4h后检测血常规、凝血功能。④血糖维持为7.8~10.0mmol/L(根据血糖水平调整血糖检测频率)。(4)诱导阶段达标时间取决于下列因素:起始核心温度、目标温度、患者体质量、降温设备、寒战控制程度等。
2. 维持阶段:达到目标温度后进入维持阶段,持续至少24h以上。(1)原则:①核心温度稳定,变异度小,维持目标温度的最大温度偏差在0.2~0.5℃内[18]。②防治肺炎、褥疮等并发症。③每日评估是否符合复温条件。(2)操作及注意事项:①血管内降温设备或包裹式冰毯运行程序如前所述,根据颅内压或复查CT结果调节目标温度。②药物治疗:根据患者躁动、寒战、Richmond躁动-镇静评分、麻醉深度、自主呼吸、咳嗽等情况,相应调整镇痛镇静药物剂量。③开始肠内营养:根据胃残留量及肠鸣音情况,从5~10mL/h逐渐加量。因肠道蠕动功能差,需给予促进胃肠蠕动的药物或灌肠,最好插入鼻肠管。④若痰液较多、黄变,氧合指数降低,或预计患者预后不良,及早行气管切开术。(3)监测指标:①实时监测生命体征(血压、呼吸、脉搏、血氧饱和度、心电等),测量中心静脉压、颅内压、脑灌注压(目标为60~80mmHg)、皮肤温度、核心温度(食道、膀胱或直肠)、瞳孔变化。②监测胃残留量及液体出入量。③每8~12小时监测血气分析,目标值同诱导阶段。④每24小时检测血常规、凝血功能、肝肾功能等,根据血糖水平调整血糖检测频率。⑤定期行痰涂片、细菌培养、药敏及炎性指标、神经损伤标志物如神经元特异性烯醇化酶等。⑥定期行颅脑CT、TCD、胸片、双下肢深静脉超声检查,实施血管内降温技术患者还需行下腔静脉超声检查。
3. 复温阶段:在维持阶段定期评估患者是否具备复温条件,若符合条件,及时进行复温。(1)条件:复温条件分为主动复温条件和被动复温条件。①颅内压<20mmHg。②影像学检查示脑水肿减轻,鞍上池、侧裂池、桥前池、脑沟等显示良好,中线无明显移位。③脑顺应性好,脑血管自动调节功能恢复。若出现下列情况,需进行被动复温:严重感染、腹腔高压、严重凝血功能障碍、严重血小板减少、严重的血流动力学不稳定、双侧瞳孔散大等。颅内高压时,应避免早期复温,因可能会导致反跳性颅内高压和不良的远期预后[12]。复温是TH最关键的阶段。(2)原则:①尽可能缓慢复温,速率为0.10~0.25℃/h,快速复温可能会导致全身血管扩张、低血压,从而降低脑血流,引起脑水肿及颅内压升高,从而抵消TH的益处。复温持续时间一般为24~48h[18]。②复温目标为正常核心温度(36.0~37.5℃)。若复温过程出现颅内压明显增高,则暂停复温,降温至先前设定的水平。(3)步骤:①应用血管内降温设备时,设置复温速率为0.10~0.25℃/h;应用包裹式冰毯时,可先设置比目标温度高0.5℃,在24~48h复温至36.0~37.5℃。②同时将冬眠合剂、咪达唑仑、镇痛药等逐渐减量,加用短效的丙泊酚或右美托咪啶。③先撤除血管内降温设备或体表降温装置(包裹式冰毯的模式设置为Normothermia),再停用冬眠合剂等药物,并予患者序贯应用普通冰毯。(4)监测指标:①实时监测生命体征(血压、呼吸、脉搏、血氧饱和度、心电等),测量中心静脉压、颅内压(复温阶段易出现颅内压升高,需注意)、脑灌注压、皮肤温度、核心温度(食道、膀胱或直肠)、瞳孔。②每8小时监测血气分析。因为此阶段易出现高血钾,注意复查血气。
4. 正常体温控制阶段:将核心温度控制为36.0~37.5℃,持续3~5d[44]。所有实施TTM的患者均应避免复温后发热,可予普通冰毯或降温药物预防[45];逐渐减停镇痛镇静药物(Richmond躁动-镇静评分达-2~0分),逐渐撤除有创颅内压、血压等监测。
(一)颅内病变状态的监测、评估
在TH期间,因患者处于深度镇静状态,且不宜中断镇静观察意识反应,所以需定期复查颅脑CT、TCD,定期进行神经系统体检。建议进行持续或间断脑电、脑氧及脑血流监测等。
(二)颅内压及脑灌注压监测
TH的重要目标之一是降低颅内压[46]。对有颅内压监测适应证的患者建议行颅内压监测,以指导TH的启动、目标温度确定、复温时机及复温速度,并及时预警颅内出现结构性变化。
(三)肠内外营养
早期以低喂养速度启动肠内营养(滋养性喂养),根据胃肠道功能恢复情况,调整喂养速度。如果患者不耐受肠内营养时,建议选择早期肠外营养。超过7d的肠内营养仍无法达标时(<60%能量目标),建议补充肠外营养。
TTM的常见不良反应及并发症包括寒战、循环系统受累、电解质紊乱、感染、胃肠功能障碍、凝血功能障碍、深静脉血栓形成等[24],临床医护人员需及早识别及处理这些可能发生的并发症,以降低由此导致的不良预后。
(一)寒战
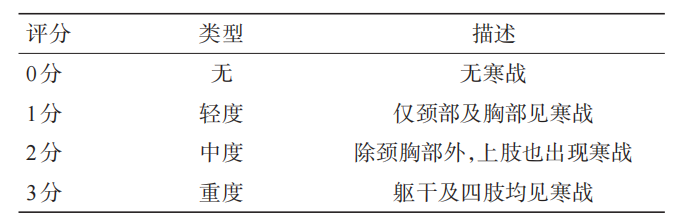
寒战是由于核心温度低于下丘脑体温调定点而引发的体温调节反射,是与TH相关的最常见的不良反应,会导致患者达到目标温度的速度减慢,氧和代谢的需求增加,引起脑缺氧和继发性脑损伤加重。TTM期间40%的患者会发生寒战[43]。肌电图可持续客观地监测寒战是否发生,临床上寒战程度的评估可采用寒战评估量表(表1)[47]。其处理措施包括物理及药物治疗。物理措施为皮肤保暖,此可更好地提高体表温度,降低寒战阈值,减少皮肤冷刺激等。在实施血管内降温技术时,体表保温可发挥最大作用;但在实施体表降温技术时,这一方法受限[18]。药物治疗包括解热剂、镇痛剂、镇静剂等。寒战干预应在寒战评估量表的帮助下确定,并可以逐步升级,平衡寒战治疗与镇静治疗,目标是用最少的镇静药物提供最大程度的寒战缓解,并将肌松药物保留到最后的一线治疗[43]。
表1 寒战评估量表细则[47]
(二)循环系统受累
低温可导致心动过缓、心肌收缩力降低、舒张末期容积增加及中心静脉血氧饱和度提高。TH时应用镇痛镇静药物可能会出现血管床扩张,另外,受脱水药物及冷利尿作用的影响,患者可出现血容量不足,血压下降。低温过程中尿量变化的原因是由于低温刺激血管收缩,增加静脉回流,从而促进心钠素的释放,降低了抗利尿激素水平[48]。
(三)电解质紊乱
低温会引起钾、镁和磷酸盐离子从细胞外向细胞内转移,从而导致低钾血症、低镁血症和低磷血症 。据文献报道 ,低钾血症的发率为13%~18%[7]。在复温过程中,当钾离子被移回细胞外时,易出现反跳性高钾血症。低温也能降低葡萄糖对胰岛素的敏感性以及减少胰腺分泌胰岛素的量,导致高血糖,故需监测血糖并予强化胰岛素治疗,目标血糖为7.8~10.0mmol/L。复温阶段由于胰岛素的敏感性恢复,易出现低血糖[48]。
(四)感染
TH 期间因镇痛镇静,抑制了患者咳嗽、气道保护能力,抑制了纤毛运动;因胃肠道功能障碍,可能出现返流误吸;低温引起的炎症抑制会影响患者对感染的反应,TH会增加感染性并发症的发生风险,最常见的感染类型是肺部感染,其次是血流感染。因TH期间患者体温被抑制,若发生感染,不能出现发热等表现,所以建议定期复查胸片、痰涂片及培养、检查血常规等感染指标。
(五)胃肠功能障碍
TH期间因镇痛镇静、冷刺激,患者会出现胃肠蠕动减慢、胃残留增多、腹胀等表现,所以实施TH前需置入鼻胃管或鼻肠管,予胃肠动力药、缓泻剂鼻饲或灌肠,也可腹部保温,必要时请康复科实施胃肠电刺激,可给予滋养型喂养。(六)凝血功能障碍
TH有可能导致患者凝血功能异常和血小板功能障碍,需定期复查凝血功能或血栓弹力图。(七)深静脉血栓形成
TH患者因进行镇痛镇静、长期卧床、高凝状态及有创操作如深静脉穿刺、血管内降温等,使血管内皮损伤,易发生静脉血栓形成[49]。所以要定期监测凝血功能,定期超声筛查四肢深静脉,TH期间予弹力袜、双下肢气压治疗等或早期床边康复以预防血栓形成,根据病情予预防性或治疗性抗凝治疗。
虽然目前研究认为TTM能有效控制和减轻神经重症患者继发性神经损伤,但在临床实践中,仍需结合其他治疗措施对患者进行综合治疗,仍需根据神经损伤类型、严重程度等制定个体化的TTM方案(神经重症TTM操作流程与管理框架见图2),实时全面地监测评估,及时识别并防治并发症。另外,需要指出的是,目前对TTM的最适目标温度、目标温度持续时间、复温速度等关键问题还存在争议,故仍需开展前瞻性、大规模随机对照试验研究以获得高等级证据来指导临床实践,从而进一步完善本共识。
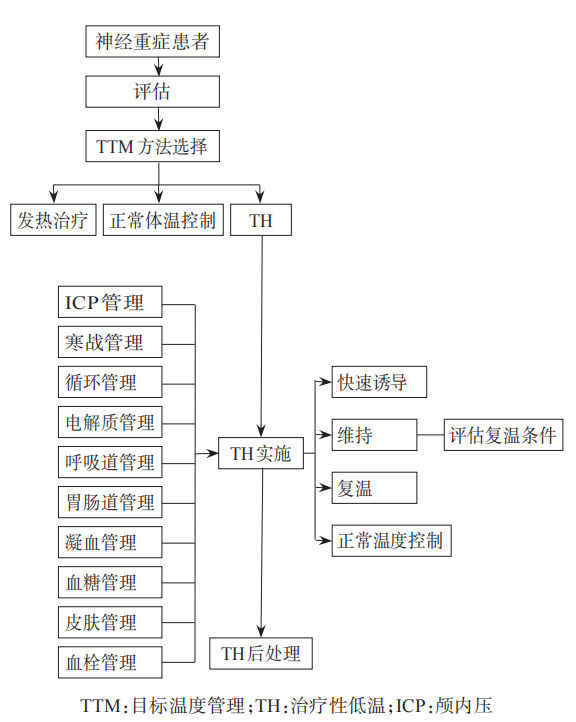
图2神经重症TTM操作流程与管理框架图
共识专家组成员(按姓氏汉语拼音排序):包义君(中国医科大学附属第四医院)、柴尔青(甘肃省人民医院)、程玮涛(首都医科大学宣武医院)、陈文劲(首都医科大学宣武医院)、冯光(河南省人民医院)、高国一(上海交通大学附属仁济医院)、高亮(同济医科大学附属上海第十人民医院)、胡锦(复旦大学附属华山医院)、黄齐兵(山东大学齐鲁医院)、黄贤键(深圳市第二人民医院)、关俊文(四川大学华西医院)、江荣才(天津医科大学总医院)、康德智(福建医科大学附属第一医院)、李立宏(空军军医大学唐都医院)、凌锋(首都医科大学宣武医院)、刘杰(烟台毓璜顶医院)、刘劲芳(中南大学湘雅医院)、刘志雄(中南大学湘雅医院)、卢林(山东第一医科大学附属省立医院)、钱涛(河北省人民医院)、邱炳辉(南方医科大学南方医院)、屈延(空军军医大学唐都医院)、曲鑫(首都医科大学宣武医院)、石广志(首都医科大学附属北京天坛医院)、田恒力(上海市第六人民医院)、汪永新(新疆医科大学第一附属医院)、王成伟(山东大学第二医院)、王国栋(山东第一医科大学附属省立医院)、王军(首都医科大学宣武医院)、汪立刚(哈尔滨医科大学附属第一医院)、王宁(首都医科大学宣武医院)、王向宇(暨南大学附属第一医院)、魏俊吉(中国医学科学院北京协和医学院北京协和医院)、谢筱琪(四川大学华西医院)、徐广明(山东第一医科大学附属省立医院)、徐跃峤(首都医科大学宣武医院)、杨朝华(四川大学华西医院)、杨军(北京大学第三医院)、张国斌(天津市环湖医院)、张鸿祺(首都医科大学宣武医院)、张剑宁(解放军总医院第一医学中心)、赵元立(首都医科大学附属北京天坛医院)、钟春龙(上海市东方医院)、钟书(广西壮族自治区人民医院)、周建新(首都医科大学附属北京天坛医院)、赵卫平(内蒙古自治区人民医院)、张艳(首都医科大学宣武医院)
秘书:赵浩(首都医科大学宣武医院)、尚峰(首都医科大学宣武医院)










声明:脑医汇旗下神外资讯、神介资讯、神内资讯、脑医咨询、AiBrain所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享。






















