瑞典皇家理工学院的Cecilia A. I. Åkerlund等假设在ICU中的TBI患者存在着不同内型,并通过机器学习算法揭示这些参数与疾病之间的潜在关系;结果发表在2022年7月《Critical Care》在线。
——摘自文章章节
【Ref: Åkerlund CAI, et al. Crit Care. 2022 Jul 27;26(1):228. doi: 10.1186/s13054-022-04079-w.】
创伤性脑损伤(traumatic brain injury,TBI)是多种损伤机制和组织病理改变的异质性疾病。有研究表明创伤性脑损伤患者诊疗存在较大差异,但预后不随诊疗差异改变。其中可能的原因是疾病的亚组异质性掩盖治疗效果。因此根据临床、生物标志物、病理生理学特征将患者进行区分以便提出个体化治疗策略。然而,这种个体化治疗策略的实施依赖于对疾病相关内型的识别。基于患者意识状态的格拉斯哥昏迷评分(Glasgow coma scale,GCS)可将脑外伤简单分类为轻度、中度和重度,但不利于对患者进行个性化诊疗。瑞典皇家理工学院的Cecilia A. I. Åkerlund等假设在ICU中的TBI患者存在着不同内型,并通过机器学习算法揭示这些参数与疾病之间的潜在关系;结果发表在2022年7月《Critical Care》在线。
研究回顾2014至2018年CENTER-TBI数据库中ICU治疗的2006例患者临床资料,包括2000多项参数。选取其中35个早期特征,囊括TBI核心IMPACT预测模型中的特征。采用扩展版格拉斯哥结果量表(Extended Glasgow Outcome Scale,GOS-E)对预后评分,其中1分为死亡,8分为完全恢复。混合概率图模型处理具有离散和连续混合变量的无监督分类器。将所有特征性的单变量概率分布建模输出模型,并为每对强相关特征考虑补偿因子。使用R语言corrplot包绘制相关图。对强相关特征,如pH和碱剩余、pH和动脉血二氧化碳分压(PaCO2)、GCS运动评分和总评分、鹿特丹CT评分和中线偏移、鹿特丹CT评分和Fisher分级、GCS运动评分和瞳孔对光反应、年龄和ASA分级、年龄和基线抗凝药物使用等建模为双变量联合高斯分布。同时以期望最大(expectation maximisation,EM)算法估计混合图模型参数和聚类概率。
作者通过聚类稳定性决定最优聚类数目。选取3到15个聚类数目,然后设定随机种子值创建10个不同的模型,计算各模型的对数似然值,选取对数似然最高模型,过程重复20次。计算所有模型的聚类相似性指数(cluster similarity index,CSI)、中位数和四分位差(IQR)。当聚类数目小于患者数量时,聚类数量越少,CSI值越高。最优聚类指具有最高中位CSI聚类数,即代表最稳定的聚类数目。为研究每个特征对模型的重要性,计算每个特征与聚类标签之间的相互信息(mutual information,MI)。如果MI>0.1,则认为特征具有价值。利用这些特征对聚类进行描述性分析。采用单变量逻辑回归分析确定聚类标记与预后之间的伪解释方差,并采用多元回归分析研究添加聚类标签后是否能改善IMPACT模型中变量的预测结果。将所有聚类中观察到的死亡率和不良预后(指GOS-E<5)概率与IMPACT预测结果进行比较。
作者通过聚类稳定性决定最优聚类数目。选取3到15个聚类数目,然后设定随机种子值创建10个不同的模型,计算各模型的对数似然值,选取对数似然最高模型,过程重复20次。计算所有模型的聚类相似性指数(cluster similarity index,CSI)、中位数和四分位差(IQR)。当聚类数目小于患者数量时,聚类数量越少,CSI值越高。最优聚类指具有最高中位CSI聚类数,即代表最稳定的聚类数目。为研究每个特征对模型的重要性,计算每个特征与聚类标签之间的相互信息(mutual information,MI)。如果MI>0.1,则认为特征具有价值。利用这些特征对聚类进行描述性分析。采用单变量逻辑回归分析确定聚类标记与预后之间的伪解释方差,并采用多元回归分析研究添加聚类标签后是否能改善IMPACT模型中变量的预测结果。将所有聚类中观察到的死亡率和不良预后(指GOS-E<5)概率与IMPACT预测结果进行比较。
该研究最终纳入1728例患者。平均年龄50.4±19.3岁,其中男性1269例(73.4%);造成损伤最常见的原因为道路交通事故(46.5%)和跌倒(43.7%);总死亡率为22%,受伤后6个月,45%患者预后不良(GOS-E评为中重度残疾)。基于IMPACT核心模型预测该研究队列的死亡率为31%,预后不良率为51%。当中位CSI中引入惩罚项后,聚类数目为6、中位CSI达到峰值时,显示6个簇(病人数分别为48例、262例、360例、343例、218例和497例)在20个随机生成模型中的簇分配。模型中GCS运动评分、GCS总评分、乳酸、氧饱和度(SpO2)、肌酐、葡萄糖、碱剩余、pH、PaCO2和体温,代表MI最重要的特征。6个聚类通常可以结合GCS评分和代谢紊乱的程度式来描述(图1)。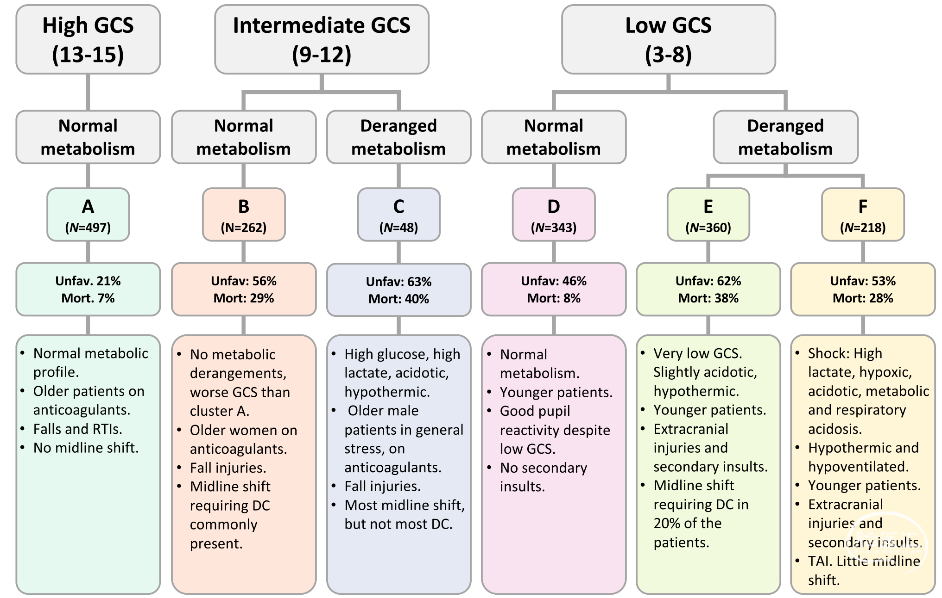
预后信息不包括在聚类过程中。在除B和C簇外的所有簇中,IMPACT模型高估死亡率(4-7%),低估4个簇的功能预后(−2-−15%)。在给IMPACT扩展模型变量(年龄、GCS运动评分、瞳孔对光反应、鹿特丹CT评分、创伤性蛛网膜下腔出血、脑室出血、硬膜外血肿、低氧状态和低血压)加入簇标签后,死亡率和不良结局的预测均略有改善,死亡率和不良结果的伪决定系数分别从0.42增加到0.44(p=0.001)、0.36增加到0.38(p=2.9×10–5)。解释方差的改善与在原始的IMPACT死亡率预测模型中增加实验室值所取得的改善相当(伪决定系数从0.42增加至0.44,p=3.6×10–5),预测不良结局的伪决定系数从0.36增加至0.37(p=2.1×10–4)。因此,这些簇群似乎代表预后与当前预测模型在两个方向上不同的群体。
作者认为,GCS评分是TBI较强的预后预测指标,但入院代谢概况如低体温、乳酸血症、血糖、SpO2、PaCO2、pH值、碱剩余和肌酐水平可以对需要ICU监护的TBI患者进行全面的评估。使用无监督聚类方法综合这些数据,可以将TBI患者分为六个不同的内型。针对不同的TBI内型可以制定治疗策略从而改善预后。

声明:脑医汇旗下神外资讯、神介资讯、神内资讯、脑医咨询、AiBrain所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享。







