| AiBrain内容团队编辑
突触前神经递质释放受到多种信号通路的调控,并影响神经环路功能和行为。来自美国国家酒精滥用和酒精成瘾研究院综合神经科学实验室的高级研究员David Lovinger等人于2022年4月在《Nature Reviews Neuroscience》上发表文章,详细解析了多种突触前受体介导的局部神经调控如何改变神经递质传递和行为的机制,总结了在体监测和操控轴突释放和功能的新技术发展,为下一步研究提出亟需解决的问题和方向。

中央神经系统的神经元通信包括两种模式,由配体门控离子通道(LGIC)受体介导的快速突触传递和G蛋白偶联受体(GPCRs)介导的慢速神经调制。这两类受体能影响多种神经元功能,包括突触前神经递质释放。局部释放的神经递质激活突触前LGIC和GPCR,通过改变胞体动作电位的功效来影响神经元通信。虽然突触前受体及其作用机制已经清楚,但它们何时何地改变神经递质释放,特别是在体条件下,还知之甚少。本篇综述着重介绍这些起重要作用的局部突触前受体的功能,并提出未来研究方向。
中枢神经系统(CNS)通过上十亿神经元和胶质细胞来控制思想,感受和行动。细胞间通信通过缝隙连接、黏连分子、突触、并列分泌、邻分泌和内分泌来实现。破解这些复杂通信网络对于理解CNS的功能和功能失调,以及修正功能失调置关重要。
将CNS活动与行为相关联的一个常用手段是记录人类或动物在执行任务时的神经元电信号,包括胞体动作电位发放频率、模式和相关性的变化,为揭示不同行为下特定神经元和脑区的作用提供证据。同时,利用药理学、化学遗传学和光遗传学等方法操控神经元活动,改变行为,来验证这些结论。
CNS包含复杂的神经环路,其中的各种细胞必须协同工作,产生正确的神经输出来驱动行为。因此一个关键问题是,环路中胞体产生的动作电位会以何种程度的保真度将信息传递给其它神经元。利用简化的神经元制备样本,实验发现胞体动作电位和神经递质释放之间并不匹配,原因是其受到突触前配体门控离子通道(LGIC)和G蛋白偶联受体(GPCRs)的调控。
而且,神经递质释放的动力学会随着胞体发放频率的变化而有很大不同。另外,人们也逐渐发现神经递质通信会直接作用于轴突末梢影响释放,并改变胞体动作电位的功效。这些近期的研究表明,行为执行中胞体和轴突末梢通信存在偏差,这使得研究神经递质释放与胞体动作电位发放之间的关系成为神经科学领域的前沿。本篇综述中,作者将着眼于并列分泌的神经递质释放如何产生局部突触前效应,来补充甚至凌驾于胞体发放的功效。
在本文中,作者将简要讨论LGICs和GPCRs改变神经递质释放的机制;接着以基底神经节环路为实例,回顾突触前作用如何影响在体突触通信,进而改变行为;最后讨论一下近期发展的用于在体评估和调控轴突功能和突触释放的技术,强调研究局部突触前神经调控对于理解行为相关的CNS功能的重要性。
快速神经传递和神经调制
神经元之间的突触通信包括快速传递(毫秒级兴奋性和抑制性突触后电位),慢速传递(百毫秒级兴奋性和抑制性突触后电位)和更慢速的神经调制(秒到分钟级)。快速传递涉及囊泡神经递质释放和LGIC型受体活化,来产生神经兴奋(阳离子通道)或抑制,以及/或者分流(阴离子/氯离子通道)。这样产生的突触后响应是短时程的,其幅度根据被激活的LGIC数量而异。
慢速的突触电位和神经调制需要GPCRs的活化。神经调制分子不仅能从囊泡释放,还能从磷脂双分子层(比如脂肪酸)或通过反向运输来释放。GPCR激动剂广泛存在,包括光子、小分子、脂肪酸、多肽和小蛋白分子。美国食物和药物管理局(FDA)批准的药物中,约34%都是作用于GPCRs,由此可见这些受体的重要性。
GPCR信号通路涉及异源三聚体G蛋白的相互作用,不同GPCR组分或促进或限制G蛋白分解成Gα和Gβγ亚基。神经调制分子与特定GPCR结合促进G蛋白分解,形成的游离亚基作用于细胞内效应分子,从而改变细胞生理、代谢和基因表达。
GPCR信号通路包括快速机制(几十毫秒的响应,持续几秒钟),比如Gβγ亚基与离子通道直接结合,以及慢速机制,比如腺苷酸环化酶(AC)的活化,需要几十毫秒到几秒的积蓄,并持续几百秒。与快速突触传递相比,慢速神经调制对突触功能具有更精细的作用。
另外须注意的是,胶质细胞也能释放神经递质,被称为胶质传递,能够通过突触前受体影响神经递质的释放。
G蛋白亚型
异源三聚体G蛋白包含α、β和γ亚基,一般来说,它们根据Gα亚基来分类,因为Gα决定了偶联的效应分子,即使是Gβγ亚基激活的信号通路。Gαs关联受体通过直接结合Gαs或Gαolf亚基来激活AC,提高细胞内环腺苷单磷酸(cAMP)的水平。
相对地,Gαi/o家族的GPCRs活化会抑制AC。Gαq、Gαq11和Gαq14-16关联的GPCRs会激活磷酸脂酶(PLC),催化包含磷脂酰肌醇的磷脂水解,从而产生第二信使甘油二脂(DAG)和三磷酸肌醇(IP3)。
游离的Gβγ亚基与效应分子相互作用,会抑制电压门控型钙离子通道(VGCCs),激活内向整流型钾离子通道和PLCβ。目前尚不清楚Gβγ亚基是否与特定的效应分子作用,不过,VGCC的抑制和钾通道的活化主要是通过Gαi/o偶联的GPCRs来介导的。
突触前LGIC和GPCR的作用
在CNS,LGICs和GPCRs位于神经元和胶质细胞的多个亚细胞组分的细胞膜上,它们最广为人知的功能是在神经元胞体、树突和树突棘上,对附近突触前囊泡释放的神经递质作出突触后响应。
不同LGIC和GPCR亚型也大量存在于轴突末梢上,能够刺激或抑制神经递质释放(图1)。阳离子型LGICs可去极化轴突及其末梢,产生动作电位和/或钙内流,从而刺激神经递质释放;也有证据表明突触前Gαq偶联的GPCRs可能通过IP3介导的末梢内钙释放来刺激神经递质释放。
神经递质释放的抑制可通过阴离子型LGICs对轴突或末梢兴奋的分流来实现,但起最显著作用的是Gαi/o偶联的GPCRs。这些GPCRs活化后释放的Gβγ亚基能抑制突触前VGCCs,还能更直接地抑制囊泡融合。几乎所有Gαi/o偶联的GPCRs都有这个功能,其中代谢型谷氨酸受体2(mGlu2)和大麻素受体1(CB1)基本上只通过突触前机制起作用。
以前的综述已经讨论过异源GPCRs调控行为中的神经递质释放,本文将不再赘述。接下来作者将根据近期研究成果,重点介绍LGICs和GPCRs对神经递质释放的促进和抑制作用,及其生理功能,并以皮层-基底神经节环路的突触前调制为例,概述多种在行为中发挥功能的神经递质相互作用(图1)。
应注意,作者即将讨论的多种受体在突触前和突触后都存在,即使是在同一CNS区域,但突触前受体是介导许多机制之所在。
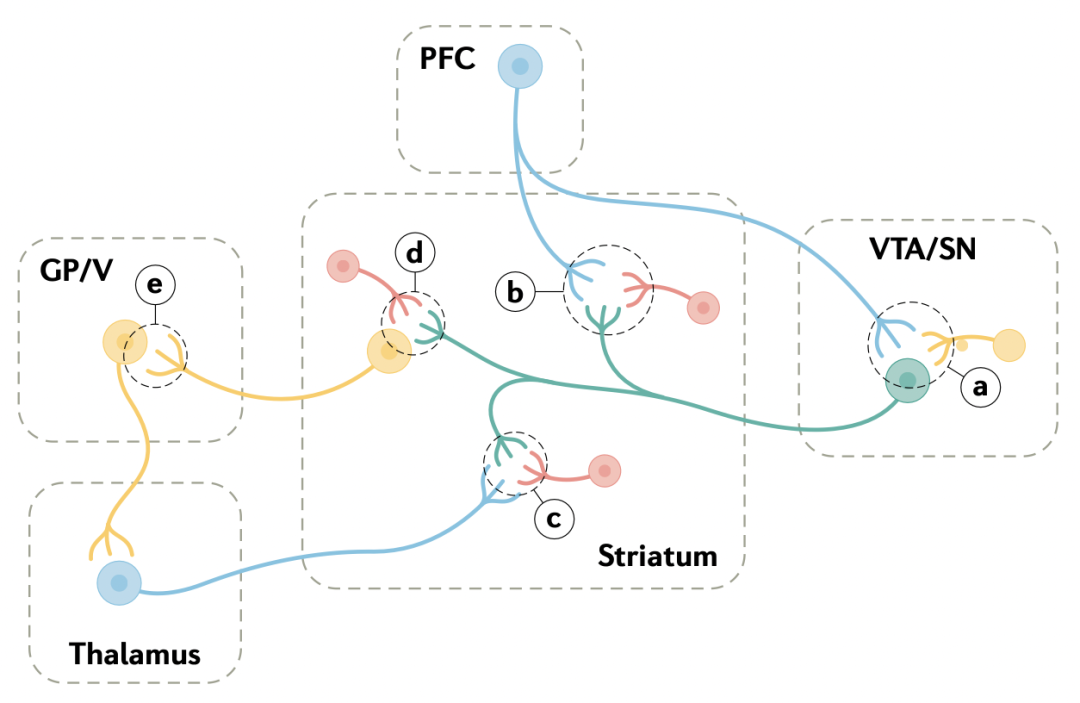
上下滑动查看↓
突触前LGIC刺激释放
烟碱型乙酰胆碱受体(nAChRs)和离子型谷氨酸受体(iGlus)在CNS中广泛存在,参与突触可塑性和神经网络整合等多种功能,在很多行为和认知功能中起作用。
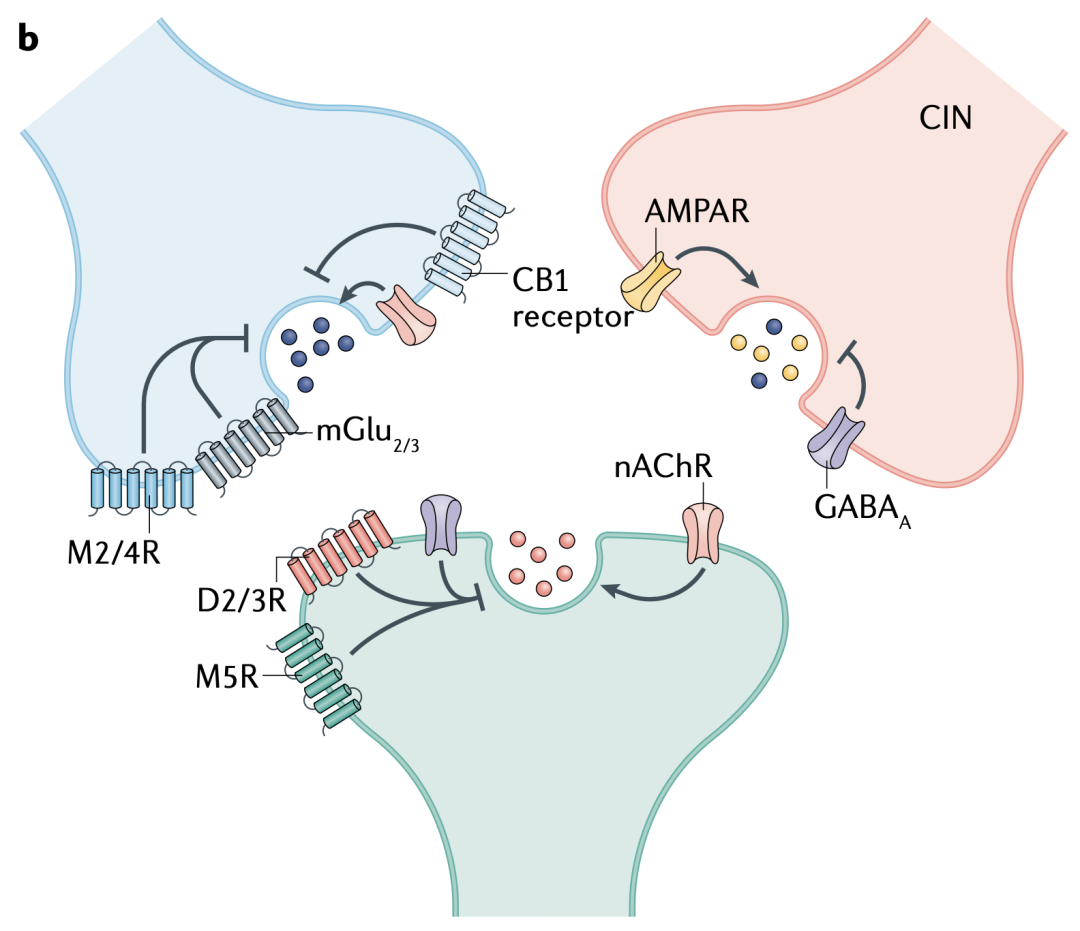
在一些脑区,离子型血清素受体5-HT3表达在GABA能突触的突触前末梢,参与酒精对CNS的作用。在纹状体,nAChRs表达在多巴胺能神经元上,被乙酰胆碱(Ach)激活后,直接去极化突触前末梢,产生动作电位,促进多巴胺(DA)释放(图1b和c)。
大量研究在纹状体突触小体和脑片上,深入探讨了nAChRs对DA释放的作用。药理学和伏安法实验表明,nAChRs对DA释放的影响甚至不依赖胞体动作电位。在纹状体的不同亚区,不同的nAChR亚型参与不同的生理过程。尾状核-核壳的α4α5β2亚型和伏核(NAc)的α4α6β2β3亚型会刺激DA释放。这种促进作用可被单个电刺激或内源性大麻素依赖的皮层-纹状体长时程抑制(LTD)激活,从而减少动作学习中纹状体的输出。
相对地,如果nAChRs依赖的和DA神经元动作电位依赖的DA释放在动作电位连发中同时发生,nAChRs则会抑制DA释放。nAChRs的这种“低通滤波”功能可能会在DA神经元阶段性发放时限制D1受体活化,产生的环路净效应可调节纹状体-黑质“直接”通路的过度兴奋,及其介导的动作起始。
在提示信号诱发的行为中,阻断含有β2的nAChRs能够增强提示信号引起的奖赏寻求行为,说明nAChRs在多巴胺能神经传递中的过滤作用能在体调制目标导向的行为。这些LGIC介导的机制为DA这一重要的神经调制分子的释放,提供了重要的局部调控。
上下滑动查看↓
纹状体突触前的nAChRs还能调节谷氨酸释放(图1b)。在皮层-纹状体末梢,含有α7的nAChRs很可能通过突触前去极化来激活VGCC和钙依赖的释放,从而刺激谷氨酸释放,另外它们介导的钙内流也能直接刺激囊泡融合。
这种受体不表达在DA末梢,但可通过谷氨酸依赖的机制间接刺激DA释放。一个最新研究表明,含有α5β2的nAChRs在丘脑-纹状体突触具有类似的突触前调节功能,并在帕金森小鼠模型的动作学习缺陷中发挥作用。然而,这些nAChRs增强谷氨酸释放的结果还需进一步的在体实验验证。
谷氨酸能的突触前作用涉及iGlus刺激ACh和DA释放,特别是在纹状体中,多巴胺能末梢上的AMPA受体可能通过去极化末梢来实现无动作电位情况下的DA释放(图1c)。虽然人们已经清楚AMPA受体与DA释放有关,但光遗传学刺激胆碱能中间神经元(CINs)引起的谷氨酸释放是否招募AMPA受体还不确定,有可能在纹状体不同区域的DA末梢上,AMPA受体的功能各异。
通过胆碱能和多巴胺能传递,皮层-纹状体的谷氨酸能传入端会被特异性激活,即形成颅内自刺激,这是局部的突触前相互作用影响行为的一个通路。
最后,也有证据表明离子型受体特别是iGlus和激酶受体,可通过胞内信号通路等代谢型途径,来影响神经递质释放。
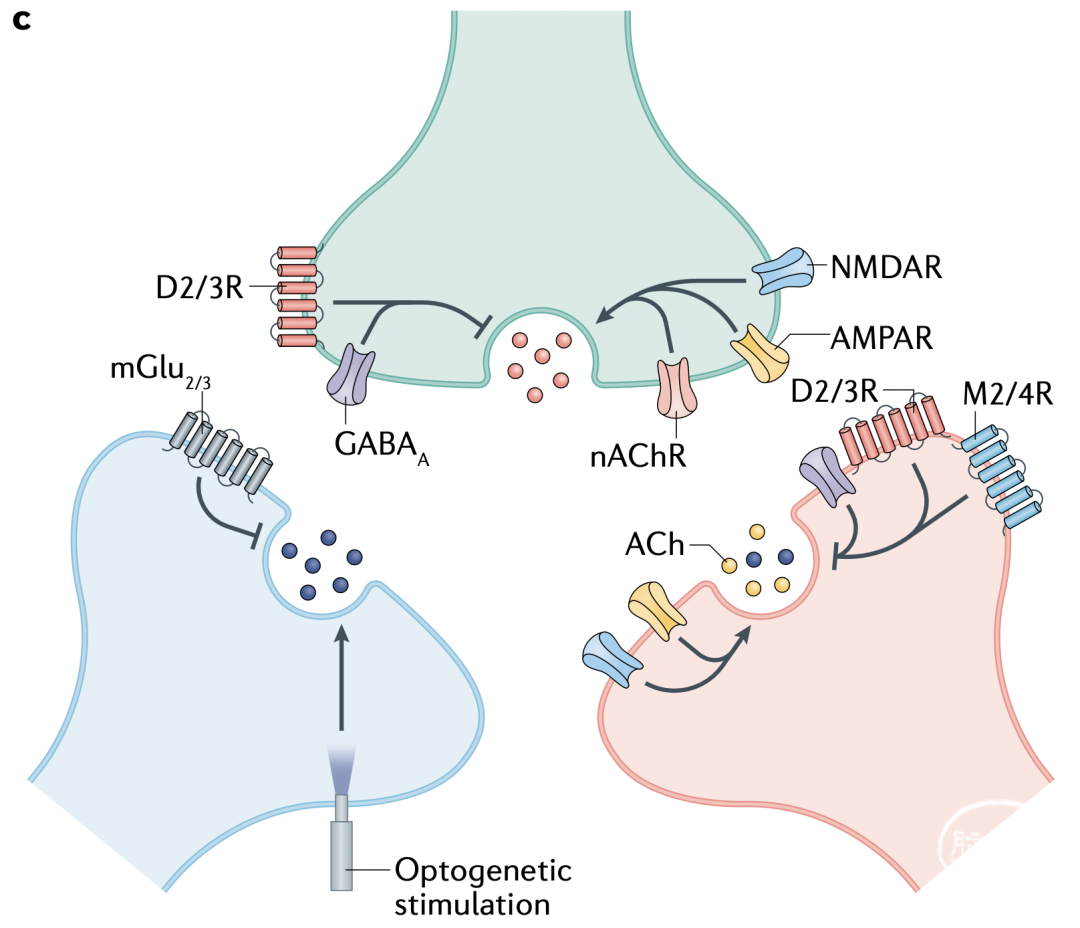
图1c 在纹状体,来自丘脑的谷氨酸能输入刺激乙酰胆碱(ACh)释放,反过来增强多巴胺(DA)释放。突触前ACh、DA和谷氨酸受体,以及GABAA受体参与其中。
GPCR抑制神经递质释放
CNS中突触前GPCRs调控神经递质释放。Gαi/o偶联的GPCRs引起短时程突触抑制,以及远超过受体活化的持续性神经递质抑制即LTD。被所在末梢释放的神经递质激活的受体,被称为自受体。
很多自受体就是Gαi/o偶联的GPCRs,在神经元强烈发放时提供负反馈,抑制释放。这可能是证明动作电位发放和神经递质释放之间存在非线性的最有名的证据,起到低频滤波的作用,限制下游环路的活化。
异源受体,正如其名,是被非本突触释放的神经递质激活的受体。例如,Gαi/o偶联的1型腺苷受体(A1Rs)多位于谷氨酸能突触前末梢,抑制释放。异源受体介导的神经递质释放抑制能够为过兴奋或过抑制提供刹车,降低细胞发放带来的影响。
多巴胺自受体
GPCR介导的对DA释放的局部抑制是突触前调制的典型案例。多种神经递质、自受体和异源受体参与其中,并有大量证据证明其在环路功能和行为中的作用。Gαi/o偶联的D2和D3型自受体位于纹状体的多巴胺能轴突末梢(图1b和c)。
在啮齿类大脑中,这些神经元的胞体位于中脑,与末梢相隔2-3 mm。2型多巴胺受体(D2Rs)和某种程度上的D3Rs,都抑制DA释放。多巴胺能神经元短促的动作电位爆发能引起充分的DA聚集,激活这些受体。
D2自受体活化能减少作用于纹状体神经元的DA量,对于多棘投射神经元(SPNs)来说,这会减少D1和D2受体的激活,并分别起到抑制直接通路的SPN和增加间接通路的SPN功能的作用,达到的净效应是削弱动作起始的环路驱动。D2自受体的缺失会引起纹状体DA水平上升、过兴奋、动机变化,以及增加对DA靶向药物包括可卡因的敏感度,这主要是由于纹状体内末梢的DA释放缺少刹车,虽然中脑的神经元发放可能也有贡献。
因此,纹状体内DA释放与中脑神经元胞体的动作电位发放之间存在非线性关系,特别是在神经元短促发放的情况下,很明显自受体能限制中脑输入对纹状体输出的影响和行为的产生,为有害的过兴奋提供适应性保护。
虽然当前还缺少证据显示D2自受体缺失时过量DA在细胞水平的影响,但一个可能性是通过直接通路的D1Rs过度活化增加纹状体输出,可能还同时通过SPN的D2Rs过度活化抑制间接通路输出。这些输出的变化可能会在自闭症和药物成瘾中引起过度兴奋和不适宜的动作选择。
突触前毒蕈碱型异源受体
Gαi/o偶联的M2和M4毒蕈碱乙酰胆碱受体(mAChRs)位于纹状体CINs的突触前,抑制ACh释放和ACh介导的DA释放(图1c和d)。值得注意的是,mAChR的调制在纹状体不同亚区有所差异。在背侧纹状体,M2和M4受体限制ACh驱动的DA释放,而在NAc只有M4发挥作用。光遗传学刺激CINs能引起DA释放,但如果CINs上同时表达mAChRs,则会抑制ACh释放及其引起的DA释放。不过这个过程中除了mAChRs,nAChRs也参与其中,如前文讨论的,在输入端短促爆发动作电位时,nAChRs会起到低通滤波作用。因此,ACh调控DA释放是一个复杂过程,mAChR活化减少轴突末梢的ACh释放,伴随含有β2的nAChR脱敏效应,间接性传递一个自抑制信号。
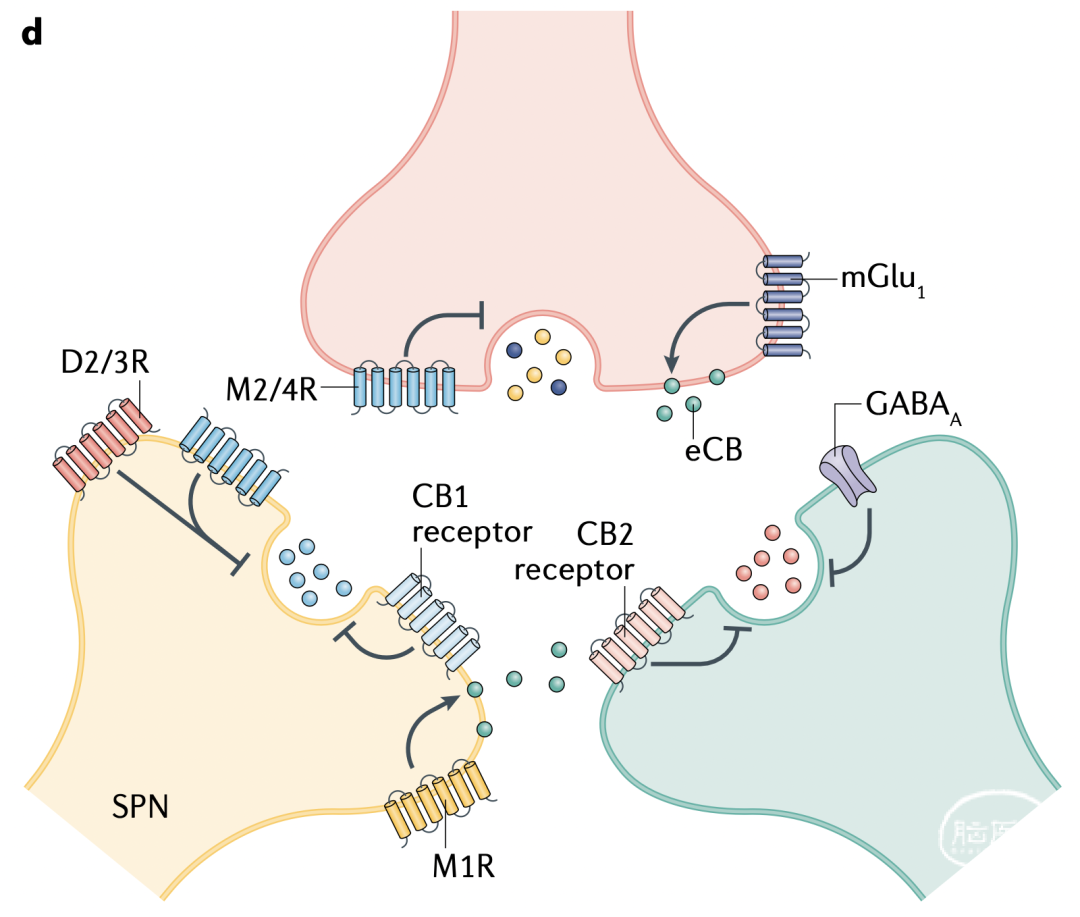
图1d 纹状体不同突触上的GPCR之间相互调控ACh、DA和GABA(来自SPNs)释放。SPNs释放的内源性大麻素(eCBs)分别通过CB1自受体调控GABA释放、通过CB2异源受体调控DA释放。
在体mAChRs对DA释放的调控能改变机体对精神类药物的反应。例如,全身性施用mAChR拮抗剂能浓度依赖地降低诱导的可卡因寻求行为,而不影响诱导的蔗糖寻求增强。NAc内注射拮抗剂也会降低诱导的可卡因复原。
有意思的是,在NAc核区而非壳区注射拮抗剂则能降低蔗糖复原。这些说明mAChRs对自然和非自然的奖赏有不同功能,在核心区域可能对驱动性行为起主要作用。
最新研究表明,NAc内注射mAChR拮抗剂能消除光遗传学激活表达D2的SPN对动机的增强效应,这表明对自然奖赏的动机增强依赖纹状体的胆碱能信号,而在纹状体不同亚区,mAChR与DA的相互作用可能在与享乐价值有关的驱动性行为中发挥不同作用。
谷氨酸自受体
Gαi/o偶联的mGlus如mGlu2在谷氨酸能突触上起自受体作用,介导短时程调制和LTD。近期研究表明,在纹状体用光遗传学手段选择性调制来自皮层或丘脑的输入时,mGlu2活化会抑制皮层-纹状体和丘脑-纹状体的神经传递,并反过来抑制丘脑激活CINs引起的DA释放(图1c),这很可能主要是通过抑制末梢的VGCC起作用。
几个研究表明,mGlu2可调节纹状体依赖的行为。例如,激活mGlu2能降低对精神类药物的自施用和寻求,包括甲基苯丙胺(冰毒)、尼古丁和酒精。另外,激活mGlu2还能降低对精神刺激的行动反应,微透析实验表明这与抑制药物引发的DA释放有关。
相反地,激活mGlu2不能降低刺激黑质致密区引起的行动响应或DA释放,这说明mGlu2调控局部机制诱导的DA释放具有特异性。最近的快扫描循环伏安法实验也证明了这一点,在纹状体脑片上,mGlu2活化选择性抑制烟碱型受体依赖的DA释放。
相应地,光遗传学刺激纹状体中来自丘脑的末梢能诱导操作性行为,而这会被mGlu2的活化抑制。这些行为上的改变是否与短时程抑制或LTD有关还需进一步实验确定。
内源性大麻素异源受体
内源性大麻素(eCBs)是一类脂代谢物,能激活CB1和CB2两种Gαi/o偶联的GPCRs。eCBs参与一种独特形式的并列分泌调制,响应基于受体和基于钙的信号分子,由脂分解代谢产生,以非囊泡方式释放。
在多数突触上,eCB产生和释放于突触后,以“逆行”方式跨过突触间隙,激活特异表达在突触前末梢上的CB1受体,抑制神经递质释放。eCBs的产生和释放依赖强烈的突触后兴奋,以及/或者Gαq偶联的GPCR活化,产生DAG,再通过DAG脂酶的催化生成eCB花生四烯酸酰甘油(2-AG)。
在大脑中,CB1受体主要表达在GABA能和谷氨酸能突触的突触前末梢,在其它类型的末梢也有表达。在纹状体,eCBs和CB1能抑制皮层-纹状体末梢的谷氨酸释放,以及到SPNs的GABA释放(图1b和e),参与GABA和谷氨酸的短时程调制和LTD。在眼窝前额皮层到背中侧纹状体的谷氨酸能突触上,eCB和CB1介导突触抑制,参与工具性动作由目标导向向习惯性控制的转变。
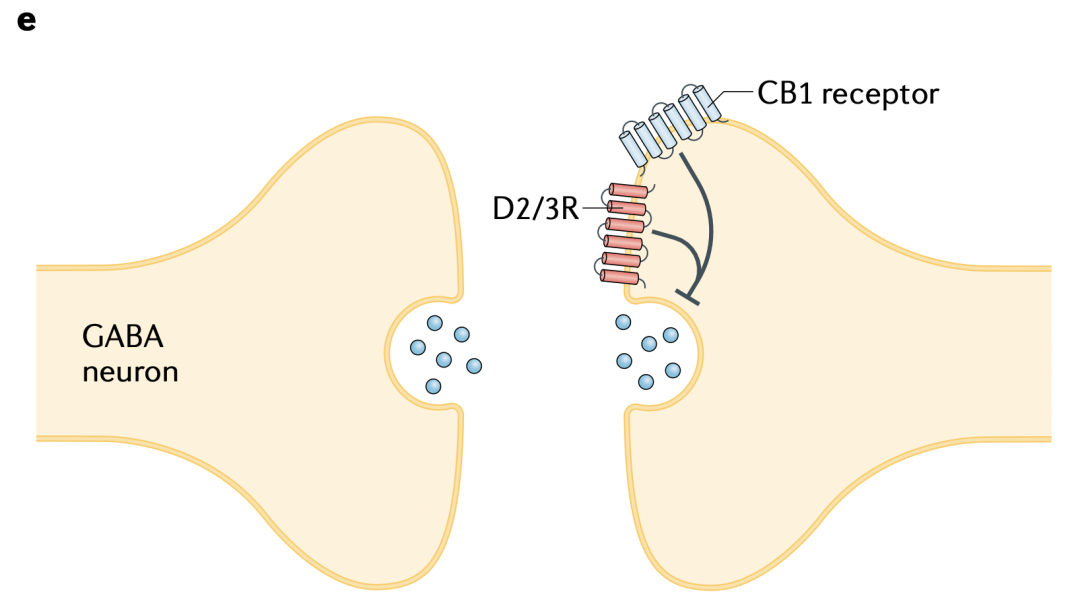
图1e 在苍白球,DA和eCBs分别通过D2/3Rs和CB1受体抑制来自纹状体SPN的GABA释放。
很重要的是,eCBs还能间接调节DA释放,虽然多巴胺能神经元一般不表达CB1受体。在中脑的腹侧顶盖区(VTA)和黑质致密区,GABA能突触上的CB1受体被DA神经元释放的eCB激活,介导去抑制作用(图1a)。另外,eCBs还能抑制到VTA和黑质致密区的谷氨酸释放。eCB的去抑制作用会被四氢大麻酚(THC)和其它精神类药物激活,可能引起VTA多巴胺能神经元活动增加,在NAc释放更多的DA。
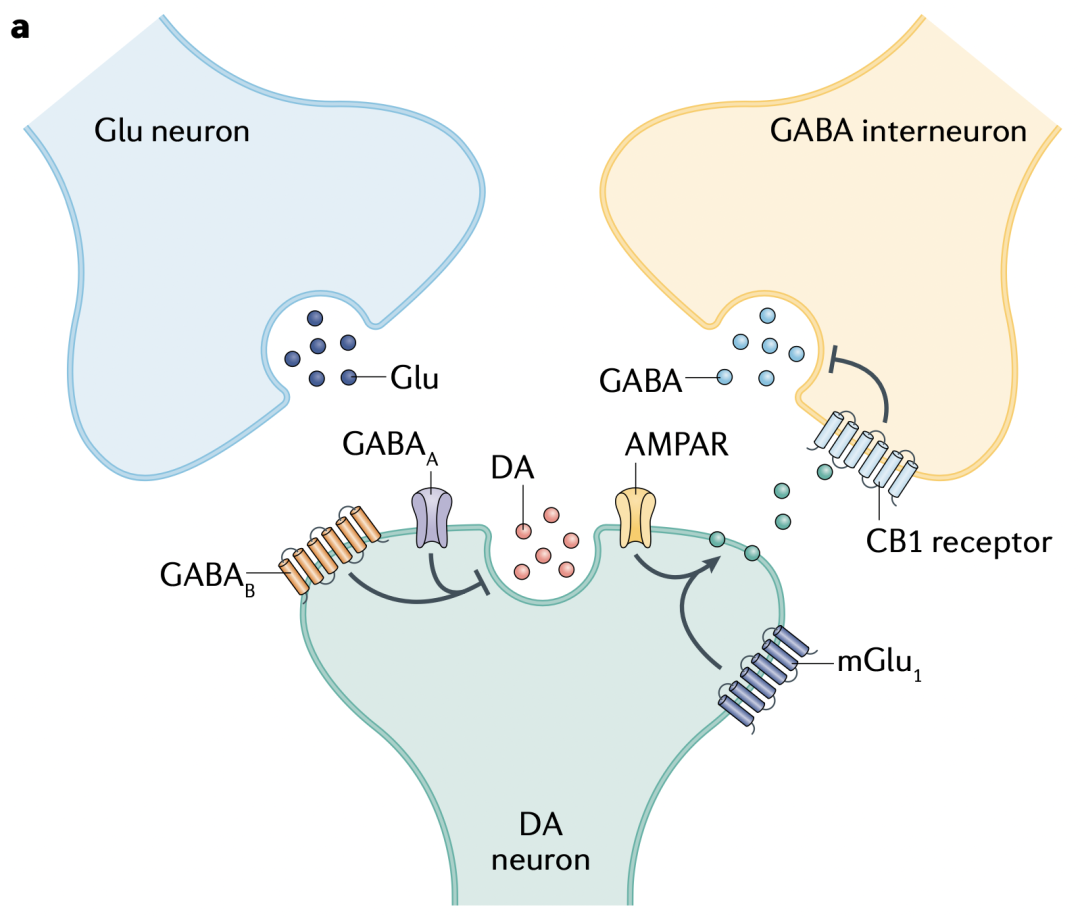
图1a 在VTA,内源性大麻素(eCBs)通过突触前CB1受体调控到多巴胺能神经元的GABA释放,从而增强谷氨酸能突触的兴奋性。
与在中脑的功能相对地,eCBs在纹状体通过局部效用抑制DA释放。光刺激CINs或中央前额叶皮层(mPFC)到纹状体的谷氨酸能输入能诱导DA释放,但这会被CB1受体的活化抑制,这一调控依赖mPFC神经元表达的CB1受体(图1b)。
刺激来自mPFC的传入可增加DA释放,这至少部分是通过谷氨酸能突触兴奋CINs实现的,如前文所述,后者能激活多巴胺能末梢上的nAChRs。直接光刺激CINs就能诱发nAChRs驱动的DA释放,同时也会激活mPFC末梢上含有a7的nAChRs来促进DA释放。
光刺激CINs还能产生eCB来抑制DA释放,而SPNs上Gαq偶联的M1受体可能介导了ACh依赖的eCB释放,从而以负反馈方式调控纹状体内DA释放。另外在NAc,eCB对DA释放的局部调控还会削弱mPFC驱动的奖赏寻求行为,这可能起到维持稳态的作用,比如防止强迫动作的形成。
eCB的局部调制在大脑中广泛存在。在基底外侧杏仁核(BLA)和海马CA1区,表达胆囊收缩素的篮状细胞(CCKBCs)到谷氨酸能投射神经元的GABA能突触是eCB逆向信号通路的主要发生位点。在这两个脑区,Gαq偶联的mGlu5受体激活后能在投射神经元中刺激eCB产生,从而起始其逆向信号通路。
在BLA,CCKBCs能被外源和来自被其抑制的投射神经元的谷氨酸能输入激活,分别产生前馈和反馈抑制,从而在投射神经元被外源谷氨酸能输入强烈激活时提供天然刹车。每个CCKBC会与投射神经元的胞体和树突形成多个突触,这些GABA能输入能为投射神经元在响应兴奋性突触和发放时提供强有力的调控。
因此,如果降低CCKBCs的GABA释放,会对网络形成去抑制效果,特别是在存在强烈谷氨酸能驱动的情况下。
BLA是根据输出效价指导学习和记忆的关键神经环路。大量文献证明,厌恶性学习依赖BLA功能。在巴甫洛夫恐惧条件反射任务中,动物经过学习会对与足部电击相关联的刺激作出冻结反应;而当两者去关联后,动物的冻结反应也随之消失。
正如Marsicano等人的早期研究证明,在到BLA投射神经元的GABA能突触上,eCB依赖的LTD在这一消退学习过程中发挥作用。阻断或基因敲除CB1受体能阻止反应消退,而BLA的eCB水平会在消退训练中升高。与消退相伴的是,到投射神经元的GABA能突触LTD减弱,而谷氨酸能突触长时程增强得到提升。
因此,eCB水平上升使得重建冻结反应所需的BLA输出产生去抑制,这可能是反应消退的关键步骤。之后的研究进一步拓展了我们对于eCB在BLA参与恐惧消退和其它厌恶性记忆的理解。抑制脂肪酸氨化物水解催化酶来提升胞外eCB花生四烯酸酰乙醇胺水平,能够增强消退反应。
eCBs还可能参与血清素重吸收抑制剂等抗抑郁药物引起的恐惧消退反应。还有证据表明,大麻素类药物可作为治疗创伤后应激综合症和其它基于厌恶性记忆的精神紊乱疾病的自用药,另外,THC能在遭受创伤的病人中降低对诱导恐惧的刺激的反应。
我们希望,针对eCB信号通路的治疗方案能在这些疾病中起效,而不会像THC那样产生对认知功能的副作用,这也提示,抑制突触GABA释放能在不影响GABA能神经元动作电位发放编码的情况下对临床相关行为产生显著效用。
Gαs/olf偶联的GPCRs增强释放
轴突及其末梢还表达起兴奋作用的异源受体,在某些突触上,Gαs/olf偶联的GPCRs就具有此功能。如上文所述,Gαs偶联的GPCRs会提高胞内AC活力和cAMP水平。在很多CNS突触上,AC的活化会增强突触传递,而且大量证据表明,这是通过促进神经递质释放实现的。
最新的研究中,在嗅觉系统的上皮细胞,Gαolf偶联的气味分子受体介导了局部调制,参与嗅觉感知。虽然该机制不是突触前的,但这个有力证据说明GPCRs对神经元活动的调制非常复杂(Box1)。
Box1 GPCRs影响气味经验的形成
最新的工作中,基于Gαolf偶联的GPCRs和cAMP信号通路的突触调控能影响感觉信息如何传到大脑。在嗅上皮,气味分子与嗅觉受体神经元(ORNs)树突节上的GPCRs结合,是气味感应和感知的第一步。
每个ORN仅表达一种嗅觉GPCR,哺乳动物中约有1000种响应气味的GPCRs被识别,使其能通过单个受体或受体组合的激活来感应多种空气传播的化学分子。另外,单个气味分子会激活多个受体,从而影响多个ORNs形成组合效应。
这些受体与Gαs偶联,通过AC和cAMP信号通路激活相关离子通道的开放,去极化ORN并产生动作电位。在Xu等人的一篇最新研究中,他们对上千个ORNs进行大尺度成像,检测其对不同气味分子组合的响应。
结果发现,一种气味分子引起的胞内钙升高能被其它气味分子增强或抑制,在某些情况下,这些有增强或抑制效应的气味分子本身并不会引起细胞响应,说明它们对气味敏感的GPCRs具有重要的变构效应。
这些重大发现表明GPCR介导的神经调制能在初级感受器官上影响气味感知,决定传递到大脑的嗅觉信息。

Xu, L. et al.
Science 368, eaaz5390 (2020).

Buck, L. & Axel, R.
Cell 65, 175–187 (1991).

Chess,A.,Simon, I.,Cedar, H.&Axel, R.
Cell 78, 823–834 (1994).

Zheng, J. & Zagotta, W. N.
Neuron 42, 411–421 (2004).
D1Rs激活Gαs,越来越多的证据表明这能刺激突触前神经递质释放。在培养的皮层神经元中,D1Rs促进谷氨酸释放。表达D1的直接通路SPNs可形成从纹状体到黑质的投射,其在中脑的轴突末梢也表达D1,并可能被中脑神经元胞体-树突释放的DA激活,促进GABA释放。
在腹侧苍白球,D1受体活化增加谷氨酸释放。在传入NAc的突触前,D1Rs也能促进谷氨酸释放,当来自皮层和中脑的传入同时兴奋时,能增强对纹状体神经元的兴奋性驱动,这也有可能是在不依赖皮层神经元发放的情况下增强了SPN兴奋性。在哺乳动物视网膜,突触前D1Rs还参与光适应过程,这一机制可能发生在几个细胞位点,包括ON型双极细胞或无长突细胞的末梢。
有趣的是,在无长突细胞的突触上,D1Rs能抑制GABA释放,改变视杆细胞相对视锥细胞介导的视觉适应。突触前D1受体在其它环路或行为中如何发挥作用,还需进一步研究。
Gαs偶联的GPCR和cAMP调控神经递质释放的机制目前尚不清楚。一般来说,蛋白激酶A(PKA)磷酸化囊泡蛋白会增加胞吐作用。超极化激活的Ih阳离子通道对胞内cAMP水平敏感,可能通过去极化末梢来参与cAMP介导的神经递质增强。
cAMP直接激活的交换蛋白(EPAC)也能调控胞吐作用,EPAC与囊泡关联蛋白如Rim1的直接相互作用能调节囊泡融合,而它对离子通道的影响也可能参与其中。后文作者还会讨论到,研究Gαs偶联的GPCR增强突触传递所需的工具和时机都已成熟。
Gαq偶联的GPCR刺激神经递质释放
Gαq偶联的GPCR能通过多种机制促进神经递质释放,包括对离子通道的调节和蛋白激酶C依赖的对胞吐作用相关突触蛋白的调制。几个重要的实例都发生在mPFC第5层,激活Gαq偶联的GPCRs,包括5-HT2A,α1肾上腺素能受体,下丘脑分泌素受体2和mGlu5等,能强烈增加锥体神经元的自发兴奋性突触后电流(sEPSCs)的频率。
大多数情况下,Gαq偶联的受体对神经递质释放的促进作用是利用电生理或电化学记录得到的,很少伴有令人信服的解剖学证据或是对突触前效应的直接测量。然而一个最新研究提供了新的直接证据。在中脑DA神经元上选择性表达Gαq偶联的被设计药物特异激活的设计受体(DREADD)hM3Dq后,在NAc冠状切片上,激活hM3Dq能增强DA释放。
这个结果证明Gαq偶联的GPCR的活化能调控末梢的突触传递。而直接向末梢灌注DREADD激动剂氯氮平-N-氧化物(CNO)能增强提示的可卡因寻求行为恢复,这也证明Gαq偶联的GPCR促进神经递质释放与行为相关联。
对突触前调制来说,很值得探讨的一点是,自发的、非动作电位传播依赖的神经递质释放取决于独特的钙调控和囊泡相关蛋白机制,因此,与动作电位传播驱动的释放相比,其受到GPCRs的调控会不同。
例如,Rim1α蛋白参与的GPCR调控和LTD可能只适用于动作电位/钙依赖的兴奋-分泌偶联。在斜方体内侧核的calyx of Held神经末梢,I型mGlu受体对神经递质释放的调控在不同结点有所差异。这些受体能增强sEPSC频率,并被河豚毒素(TTX)阻断。
对calyx of Held突触前末梢做电生理记录发现,mGlu1/5的活化可引起阈下去极化,增强TTX敏感的持续性钠电流,从而很可能通过增加VGCCs的随机开放概率,促进非动作电位依赖的神经递质谷氨酸的释放。
这个释放增强只适用于自发模式,因为突触后mGlu1/5活化及其引起的逆向eCB信号通路能阻断这个功能。持续性钠电流的活化也可能在其它突触上由Gαq偶联受体引起的TTX依赖的神经递质释放增强中发挥作用。
Gαq偶联的GPCRs调控突触前神经递质释放还有一个途径是与Gαi/o偶联的GPCRs发生相互作用(Box2)。例如,在mPFC,II型mGlu受体能抑制5-HT介导的自发谷氨酸释放增强,类似拮抗作用也会发生在其它Gαq和Gαi/o偶联的GPCR之间,如下丘分泌素2受体和µ-阿片类受体。
因此,轴突末梢不同的GPCRs组合可诱导复杂的调控效果。在mPFC第5层的锥体神经元上,与5-HT类似,具有致幻作用的5-HT2A激动剂(比如2,5-二甲氧基-4-碘苯丙胺,DOI)能增加sEPSCs频率,并能被mGlu2活化所抑制。
与之相应地,mGlu2活化后能降低DOI引起的头部痉挛反应。这些结果表明,GPCR之间的相互作用能切实影响啮齿动物对经典致幻药物的行为反应,能为开发治疗精神疾病的新药物提供新方案。
Box2 下丘脑突触前GABA-谷氨酸相互作用
在下丘脑室旁核(PVH),GABA能突触的短时程抑制会被局部谷氨酸传递所调节。表达促皮质激素释放激素(CRF)的PVH小细胞神经元去极化后能激活逆向的eCB信号通路,从而抑制GABA释放(*译者注:对网络来说形成去抑制效应)。
当GABA能突触同时被谷氨酸能突触激活时,这个抑制效应持续时间较短;但是当Gαq偶联的mGlu5被阻断时,抑制效应持续时间增长。当GABA能突触在没有谷氨酸传递的情况下被激活时,类似的去极化诱导的长时程抑制效应也被观察到,而使用mGlu5激动剂会缩短其持续时间。
另外的证据表明mGlu5的这一作用是通过突触前Gαq信号通路实现的。这个机制提供了对局部突触抑制的可转化性调控,可能在强烈的谷氨酸能活动时凌驾去抑制效应。还需要进一步研究确认突触前末梢上Gαq抑制Gαi/o信号通路的机制,以及该机制是否在其它脑区的突触上存在。

Colmers, P. L. W. & Bains, J. S.
J. Neurosci. 38, 10444–10453 (2018).
在体评估突触前功能
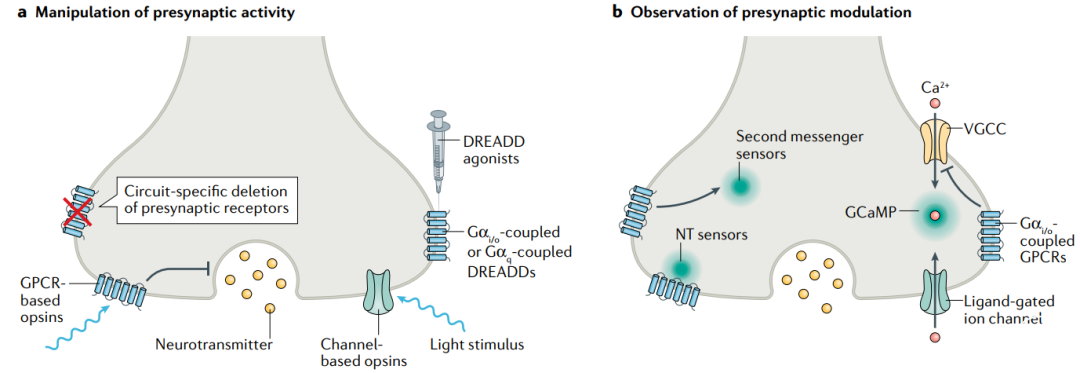
已经确定的是,对轴突末梢的局部调控能改变神经元信号传递、神经递质释放和胞体动作电位的功效;然而,这些作用如何影响环路功能和行为还知之甚少。幸运的是,最新发展的多种神经科学研究工具会带来显著进展(图2)。
利用病毒或转基因手段选择性消除成年小鼠神经元上的特定分子能提示局部调控中受体起到的作用(图2a)。例如,在有条件敲除的小鼠模型上,利用病毒性Cre的表达敲除额叶皮层神经元的CB1受体,能够消除对纹状体末梢的谷氨酸释放的调控。
由于CB1受体只特异性表达在这些神经元的突触前,该敲除只会影响纹状体的局部调控。如上文讨论的,这个结果说明CB1受体及其同源的eCB配体在习惯性学习和奖赏驱动的行为中发挥作用。
上下滑动查看↓
另外一个例子是突触前µ-阿片类受体在奖赏相关的行为中的功能,详见Box3。
Box3 综合各种现代技术来确认突触前GPCRs在特定环路的功能
Castro等人的最新工作将药理学、基因操控和光遗传学等技术合理结合,研究了一种突触前GPCR促进奖赏相关行为。
作者识别了一群表达前脑啡呔原的背缝核(DRN)神经元,可投射到NAc壳区,并表达Gαi/o偶联的µ-阿片类受体(MOR),这个受体已知与奖赏和镇静相关。他们发现在小鼠NAc壳区局部阻断MORs或者全局性地敲除MORs,都能抑制奖赏性消耗行为。
由于在NAc壳区MORs同时表达在轴突末梢和胞体上,作者利用局部或逆向追踪技术来局部或只在NAc传入端选择性敲除MORs,从而确定投射到NAc壳区的神经元特异性介导了MOR对奖赏性消耗的促进作用。
在全局性敲除MORs的小鼠上,选择性恢复投射到NAc壳区的DRN神经元上的MOR表达,可恢复奖赏性消耗。对这群神经元用GCaMP6s监测突触前钙浓度发现,在发生奖赏性消耗行为时这个通路被抑制,而这个抑制作用能被全身性施用MOR拮抗剂纳洛酮所阻断。
为特异性模拟突触前MOR活化对奖赏性消耗行为的作用,作者在NAc投射型DRN神经元上表达光敏感的嵌合型光MOR受体,用光刺激NAc壳区后能抑制这个通路,并增强奖赏性消耗。以上这些结果都证明,MOR介导的对DRN到NAc壳区投射的内源性抑制能促进奖赏性消耗行为。
最后作者发现,上述通路的MORs并不具有镇静作用,说明利用互补性的环路特异性手段有助于识别广泛表达的GPCRs对行为的不同影响。

Castro, D. C. et al.
Nature 598, 646–651 (2021).
化学遗传学和光遗传学手段都被用来改变神经元活动,包括对轴突和轴突末梢的特异性操控(图2a)。这些技术已经成熟,本文将不再讨论。值得注意的是,G蛋白偶联的DREADDs就是用来模拟GPCR对神经递质释放的影响,已经得到一定的应用,未来它们及其它化学遗传学工具对评估GPCR的局部效用和在环路功能和行为中的作用非常重要。
Mahler等人利用局部CNO灌注抑制腹侧苍白球到VTA的GABA能输入,就是一个完整的突触前DREADD研究,在行为和生理功能水平上都验证了GPCRs的效能。类似实验需要推广到对整个大脑的研究。
研究者还发展了光活化的GPCRs,设计了含有视紫红质部分结构的嵌合受体(图2a),这个方法有时也被称为OptoX,可以在空间和时间上对胞内信号通路做精确激活或抑制。另外人们还发展了光激活的基因表达和基因抑制技术,能够以更高空间和时间精度调控突触前受体和信号因子的表达。
以A2A腺苷酸GPCR为基础发展的OptoX受体在海马中被激活后能削弱记忆,而另一种基于µ-阿片类受体的OptoX表达在相关脑区能改变位置偏好或厌恶行为。现在还不清楚OptoXRs对行为的影响是不是通过突触前活化介导的,但最新发展的Gαi/o偶联的载体有希望帮助回答这个问题。
在神经递质探测方面,最新的技术革新是基因编码的神经递质指示剂(GENS)(图2b),这是一种神经递质结合蛋白和循环排列的荧光蛋白(cpFP)杂合的分子。GENS分为两大类,一类用GPCRs作为结合蛋白,另一类用细菌周质结合蛋白(PBPs)来结合神经递质。
无论是哪种分子骨架,神经递质与同源位点结合后引起构象变化,增强cpFP的荧光发射。目前已有多种GENS来探测不同神经递质和神经调制分子。这些指示剂可通过病毒注射表达在特定脑区或神经元,通过基于Cre-loxP的表达手段还能进一步提高特异性。
这个技术使得神经科学家可利用光度计和成像手段,在脑片和在体情况下评估胞外神经递质浓度变化的幅度和时程。虽然之前已有可用的探测胞外神经递质的技术,但GENS既有伏安法和安培法的高时间分辨率,又有微透析和高通量液相色谱术(HPLC)的分子特异性,使得我们能实时监测大脑内神经递质的动力学(例如新皮层的DA水平),这在此前是无法办到的。
实际上,一篇最新文章利用GENS提示,中脑DA神经元发放和纹状体的DA释放并不匹配,虽然这个问题还存在一定争议。
利用这些新的强大的工具,我们能够进一步探究局部神经递质的作用如何改变神经元之间的信号传递,并最终影响核团的输出和行为。在行为进行中实时测量胞外神经调制分子的波动,会提示它们在什么情况下发挥局部作用,在什么情况下产生长期变化。
这个方法与多色成像和荧光光度计技术结合,可同时检测神经递质和神经元活动,从而计量不同神经调制分子水平对生理功能的影响。基因编码的电压指示剂能更好地测量神经元活动,有助于跟神经调制分子水平直接作比较,决定在体条件下是否确实存在神经元发放和神经传递之间的不一致。
利用以上技术操控神经元活动、神经递质分泌、特定受体和信号通路分子,能够帮助我们评估局部调控的分子和细胞靶标的特定功能,对于神经科学家们来说,当下正是探索局部调控的多样化功能的好时机。
神经调制分子大多是通过胞内信号分子发挥功能,而在体测量和操控这些信号通路对于确定局部调控在亚细胞水平的影响置关重要。现有基因手段可改变胞内信号通路中多种蛋白的表达(例如AC、PLC和蛋白激酶),不过更有利的技术是,在亚细胞组分特别是突触前末梢精确干扰信号通路,那些从整个神经元中消除某种蛋白的基因技术,还做不到这一点。
不过,针对蛋白敲除后如何影响神经调制分子释放的技术一直在发展:有束缚的抑制剂或其它将抑制剂靶向投递到亚细胞组分的技术;将基因操控与小分子结合来改变胞内信号通路;利用光学手段快速合成胞内信号分子等等。
另外,越来越多的证据表明突触前末梢存在局部mRNA翻译,因此,降低末梢RNA水平也可能在局部合成位点消除亚细胞的关键蛋白。然而,操控胞内信号通路的一个主要障碍是,我们并不清楚某个特定蛋白位于哪个亚细胞组分。
例如,人们识别了10种AC亚型,每个亚型的mRNA可表达在某个脑区。但是由于没有特异性抗体,不同AC蛋白的具体亚细胞定位无法确定,给操控亚细胞AC表达带来困难。既然免疫技术有困难,我们可能必须利用蛋白组学并结合分离神经元不同亚细胞组分的技术来解决这一问题,同时还可能需要绘制其它信号通路调节蛋白的亚细胞表达图谱。
评估胞内信号通路的一个显著进展是实时监测信号分子(图2b)。如前文所述,利用基因编码的钙指示剂如GCaMP,可对特定神经元和亚细胞组分做钙测量。对cAMP、DAG和PKA磷酸化和/或活化的基因编码指示剂也得到最新的发展,并开始用于脑片和在体实验。
在神经元的不同亚细胞组分监测这些胞内信号通路能帮助我们理解神经调制分子如何实时发挥作用。本文所述的所有技术将有助于精细分析神经调制及其如何改变胞体动作电位功效,来调控跨神经元的通信。
结语与建议
胞体动作电位长期以来是在体监测神经元活动和通信的标准对象,然而现已清楚神经递质在突触前末梢及其它神经元亚细胞组分的局部调控能影响神经元活动和突触传递,改变动作电位的功效,在某些情况下甚至是非动作电位依赖的,而且越来越多的文章表明这些局部信号的改变会对多种行为产生影响。因此,胞体动作电位和神经递质释放之间的非线性已经非常清楚。
然而,在体评估局部信号对CNS神经生理学影响的方法滞后于行为学实验。随着新技术发展,实时监测神经递质和胞内信号通路,并结合一系列操控方法,人们开始积累对复杂的细胞间通信的新认识,有助于完整理解CNS功能。
利用本文所述的所有技术,作者提出一个在体“调制计”方法,以图完整弄清这一课题。前文提到很多未来研究的方法,但还没有讨论优先顺序。作者认为,当前最紧迫的需求是确认在哪些在体情况下,神经递质释放与胞体发放不匹配。这需要多学科的在体实验,将电生理,神经化学和基因手段与行为相结合。
同样重要的是,在不同行为中,确认哪个特定脑区的特定轴突末梢上,何种突触前受体和相关信号分子参与其中。这需要前段提到的精巧的基因技术,结合生理测试,分析提升或降低受体功能如何影响相应脑区的突触传递。
另外一个紧急需求是,识别哪些突触受到何种突触前受体的影响。实际上,我们对部分突触前受体的工作还相对较少,特别是Gαq和Gαs/olf偶联的GPCRs。这需要结合脑片电生理实验,在体神经递质释放和受体定位分析,以及药理学和基因手段。从这个角度讲,新工具研发,并用其确定哪种分子在哪种末梢中发挥作用置关重要。除了免疫学手段和高分辨率/超分辨率显微技术,对分离的末梢做蛋白组学分析也会很有价值。
我们正处于理解突触前调制和功能会取得重要突破的隘口,接下来还有很多工作等待人们开展。
AiBrain内容团队为大家整理了文章的pdf,如有需要,请公众号后台留言“pdf”或扫码添加AiBrain助手微信获取。
✦往期精彩回顾✦


声明:脑医汇旗下神外资讯、神介资讯、脑医咨询、AiBrain所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享。







