| 编辑:AiBrain内容团队
| 编译作者:刘玉娥 同济大学
肿瘤转移是一个复杂的生物学过程,循环肿瘤细胞(CTCs)介导肿瘤转移,是肿瘤转移及预后的重要标志1-3。CTCs在早期乳腺癌转移以及术后复发中起重要作用,乳腺癌也是CTCs研究最为广泛的肿瘤类型3-5。一般认为,CTCs源自于原发性肿瘤或转移后肿瘤的肿瘤组织以及由手术等导致的创伤性组织1,6,7。但影响其转移能力的决定性因素仍不清楚。揭示CTCs的生成动力学有望为肿瘤治疗提供新策略。
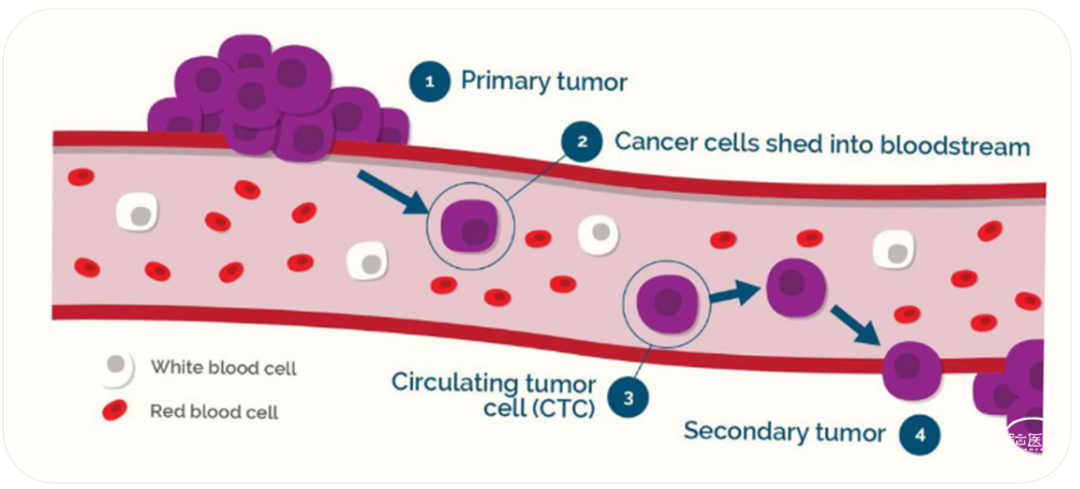
图一、循环肿瘤细胞 (CTC) 源自于原发性肿瘤及转移后的肿瘤
(图片源自:https://debuglies.com/?s=circulating+tumor+cells)
2022年6月22日,《Nature》杂志以长文形式报道了来自瑞士苏黎世联邦理工学院分子健康科学研究所Nicola Aceto教授团队的最新研究发现:乳腺癌的转移扩散在睡眠中加速。


Nicola Aceto 博士
苏黎世联邦理工学院分子肿瘤学副教授
博士毕业于瑞士巴塞尔弗里德里希·米谢尔研究所(FMI)。
Aceto曾在哈佛医学院哈伯实验室和美国马萨诸塞州波士顿总医院癌症中心担任博士后研究员,在那里他将循环肿瘤细胞簇确定为转移前体细胞。
曾任瑞士国家科学基金会巴塞尔大学肿瘤学助理教授。
Aceto 教授致力于循环肿瘤细胞及乳腺癌转移的研究,部分研究成果已进行临床试验。由于他在循环肿瘤细胞方面的杰出成绩,他获得了多个大奖,包括享有盛誉的瑞士开创性癌症研究科学奖Latsis(2021)和生物化学杰出成就奖Friedrich Miescher(2020)。
本文发现了循环肿瘤细胞在休息期分裂增殖加速,解析了循环肿瘤细胞生长及调控的新机制,揭示了循环肿瘤细胞生长与昼夜节律的关系,为治疗具有转移倾向的癌症提供了理论基础。
为了检测CTCs在乳腺癌病人中的丰度,研究团队首先找到了30名乳腺癌患者,其中21名是未发生转移的早期患者,9名是已经转移的IV期患者。研究人员分别在早上10:00(活动期)与凌晨4点(休息期)采集所有患者的血液样本,通过微流体技术捕获CTCs,检测发现:78.3%的CTCs来自于夜间收集的样本。
为了检测昼夜节律与CTCs丰度之间的关系,研究人员建立了多种乳腺癌小鼠模型,体内实验证实了大部分CTCs源自夜间收集的乳腺癌小鼠。研究人员通过调整光线明暗度以及注射褪黑素(一种调节睡眠周期的关键激素)干扰荷瘤小鼠的昼夜节律(小鼠作息与人类相反,他们白天睡觉,夜里活动),发现时差诱导以及褪黑素处理后小鼠肿瘤中的CTCs数量发生了显著变化而肿瘤体积并无显著变化。
进一步研究发现,乳腺癌患者和小鼠模型中的肿瘤细胞在肿瘤进展中不会持续脱落进入血管,但是在睡眠过程中,CTCs数量显著增加,表明昼夜节律与CTCs丰度密切相关。
那么这些睡眠期间增加的CTCs与肿瘤转移是否直接相关呢?
在昼夜节律的不同时间产生的CTCs转移能力是否相同呢?
研究人员首先通过微流控技术分离出CTCs,建立异种移植瘤小鼠模型,在昼夜节律的不同时间节点检测他们的肿瘤转移能力,通过体内生物发光成像追踪发现,注射休息期采样的CTCs的小鼠肿瘤负荷最高,并且其转移能力远高于活动期采样的CTCs肿瘤。
说明乳腺癌的转移扩散可能来自于这些增加的CTCs细胞及细胞簇,在休息期,CTCs不仅增强了肿瘤细胞的血管内渗,而且增强了肿瘤的转移能力。
到底是什么机制使这些CTCs在休息期和活动期的转移能力不同呢?为了揭开CTCs工作的神秘面纱,研究人员通过给小鼠脂肪垫注射休息期和活动期采样的乳腺癌细胞,建立小鼠原位移植瘤模型,分离肿瘤中自发产生的CTCs,进行单细胞RNA测序。
对测序结果进行主成分分析发现,两类CTCs基因表达最大的不同来自于采样的不同时间点。在休息期采样的CTCs高表达细胞分裂以及有丝分裂的基因,而在活动期采样的CTCs高表达核糖体合成相关基因。
因此,处于休息期的CTCs增殖能力更强。这一结果也在乳腺癌病人样本中得到了证实。这种细胞增殖能力随时间而变化的情况不仅存在于CTCs中,而且存在于原发肿瘤中,说明这是乳腺癌细胞在疾病进展中的一种普遍现象。
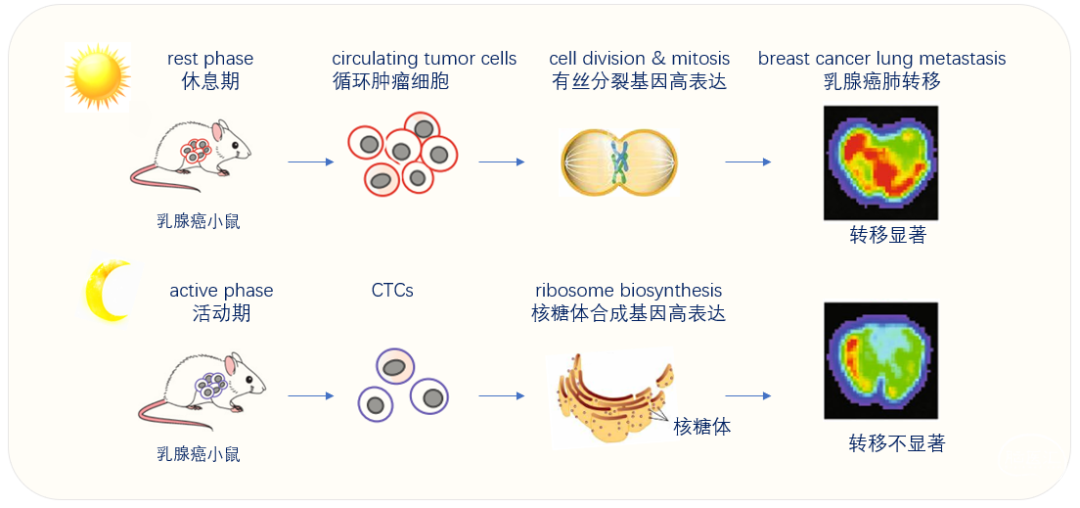
图二、休息期小鼠的CTCs与活动期小鼠的CTCs基因表达分布显著不同,转移能力不同。
(图片来源:解读者根据原文内容绘制)
为了确定昼夜节律驱动的CTCs生成和增殖的主要调节器,研究人员做了几种尝试:首先检测了两类细胞中与节律相关的基因表达,发现没有显著区别。接着检测了两类细胞在不同时间节点的组织间隙流动液压、与免疫细胞互作以及不同溶血率造成的损伤等,发现YAP和TAZ的表达以及定位(组织间隙压力的感受器)都没有变化。
最后,研究团队再次分析了异种移植肿瘤以及病人的RNA测序结果,统计了昼夜节律调节受体以及生长因子受体的表达,发现糖皮质激素受体,雄激素受体以及胰岛素受体在CTCs中高表达,表明他们的配体参与了时间节点诱导的CTCs生成及增值。
使用糖皮质激素受体的配体地塞米松或雄激素受体的配体睾酮处理荷瘤小鼠,发现在休息期植入睾酮颗粒,CTCs数量降低,肿瘤转移能力降低。在休息期对小鼠肿瘤进行胰岛素处理发现,CTCs的血管渗透力在休息期增加而在活动期降低。以上两种配体以及胰岛素的处理都不会影响小鼠肿瘤的体积。
综上所述,研究人员通过对乳腺癌病人以及乳腺癌小鼠模型的研究,发现CTCs在休息期比在活动期的分裂增殖能力、血管渗透能力及转移能力更强。同时发现昼夜节律相关的激素如褪黑素、睾酮和糖皮质激素等决定了CTCs的生成,而胰岛素以一种时间依赖的方式促进了体内肿瘤细胞的增殖。
以往研究证实了昼夜节律与肿瘤发生密切相关,本文首次发现了昼夜节律与肿瘤转移进展的关系,提示我们需要用时间控制的方法来治疗乳腺癌,比如高度控制时间点收集临床样本以减少差异,利用肿瘤治疗在夜间最为有效的理论调整治疗时间和治疗方式等。
AiBrain内容团队为大家整理了文章的pdf,如有需要,请公众号后台留言“pdf”或于文末添加AiBrain助手微信获取。
参考文献(上下滑动查看):
✦往期精彩回顾✦


声明:脑医汇旗下神外资讯、神介资讯、脑医咨询、AiBrain所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享。








