英国伦敦癌症研究所分子病理学部的Diana M. Carvalho等发现VEGFR/RET/EGFR抑制剂凡德他尼在体外靶向ACVR1降低DIPG细胞活力,但穿过血脑屏障的能力有限。除mTOR外,依维莫司在体外与凡德他尼联合时可抑制ABCG2和ABCB1转运蛋白,并在DIPG细胞中具有协同作用。在原位ACVR1突变患者来源的DIPG异种移植模型中,该联合用药在体内耐受性良好,显著延长生存期并降低肿瘤负荷。同时,该研究报道4例ACVR1突变的DIPG患者接受凡德他尼加mTOR抑制剂治疗的结果,以及联合治疗的剂量和毒性特征。结果发表于2022年2月《Cancer Discovery》杂志。
——摘自文章章节
【Ref: Carvalho DM, et al. Cancer Discov. 2022 Feb;12(2):416-431. doi: 10.1158/2159-8290.CD-20-1201. Epub 2021 Sep 22.】
弥漫性内生性桥脑胶质瘤(diffuse intrinsic pontine glioma,DIPG)是好发于儿童脑干的浸润性胶质瘤,中位生存时间仅9-12个月。DIPG常伴随H3.1K27M突变,其中约25%是ACVR1的体细胞突变,但目前还没有ACVR1抑制剂获批用于该疾病。既往研究利用基于人工智能的平台寻找ACVR1突变型DIPG的获批化合物,凡德他尼和依维莫司的联合用药确定为一种可能的治疗方法。英国伦敦癌症研究所分子病理学部的Diana M. Carvalho等发现VEGFR/RET/EGFR抑制剂凡德他尼在体外靶向ACVR1(Kd=150nmol/L)降低DIPG细胞活力,但穿过血脑屏障的能力有限。除mTOR外,依维莫司在体外与凡德他尼联合时可抑制ABCG2(BCRP)和ABCB1(P-gp)转运蛋白,并在DIPG细胞中具有协同作用。在原位ACVR1突变患者来源的DIPG异种移植模型中,该联合用药在体内耐受性良好,显著延长生存期并降低肿瘤负荷。同时,该研究报道4例ACVR1突变的DIPG患者接受凡德他尼加mTOR抑制剂治疗的结果,以及联合治疗的剂量和毒性特征(图1-5)。结果发表于2022年2月《Cancer Discovery》杂志。
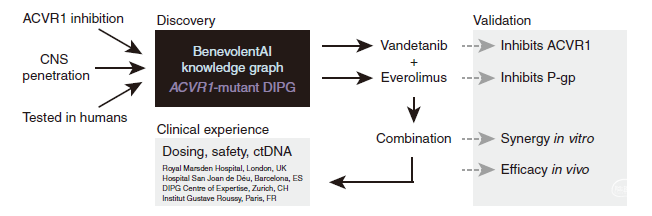
图1. 基于AI检测ACVR1-突变体DIPG利用药物组合策略的示意图。BenevolentAI知识图用于确定对ACVR1具有潜在效力和充分CNS渗透的获批药物,以作为DIPG儿童的合理治疗。经验证凡德他尼和依维莫司分别抑制ACVR1和P-gp,体外研究发现联合用药具有协同作用,体内研究发现可延长生存期,因此该联合用药在欧洲的4家儿科神经肿瘤专家中心得到临床应用。ctDNA:循环肿瘤DNA。
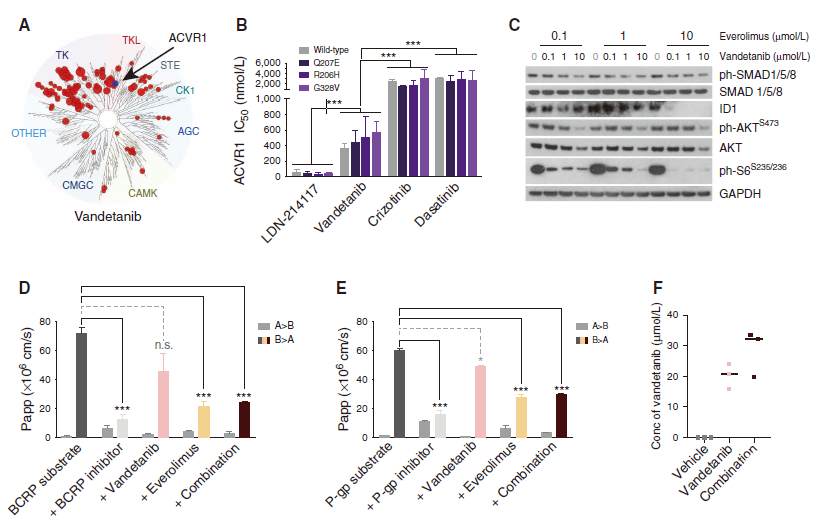
图2. 研究验证凡德他尼作为ACVR1抑制剂和依维莫司作为P-gp抑制剂。A.10μmol/L凡德他尼的激酶组选择性图,红色圆圈表示抑制>65%的激酶。标记ACVR1。圆圈的直径与存在抑制剂时剩余的激酶活性百分比成反比。B. 条形图显示各种化合物对野生型(灰色)和突变型ACVR1的IC50:Q207E、R206H和G328V(紫色阴影)。C. 在0.1μmol/L、1.0μmol/L或10μmol/L依维莫司存在下,用浓度递增的凡德他尼处理的ACVR1R206H HSJD-DIPG-007细胞的免疫印迹。GAPDH为上样对照品。D. 条形图显示在存在各种抑制剂的情况下,BCRP底物跨双向细胞单层(a-B和B-a)的表观渗透性(Papp)。E. 条形图显示在存在各种抑制剂的情况下,P-gp底物跨双向细胞单层(a–B和B–a)的表观渗透性(Papp)。凡德他尼,粉色;依维莫司,浅橙色;复方制剂,深红色。误差线代表平均值的SD。***,P<0.0001,方差分析,不显著。F. 通过质谱法评估溶剂对照(灰色)、凡德他尼(粉色)或联合给药(暗红色)处理的正常小鼠大脑中凡德他尼浓度(Conc)的点图。黑色水平线代表中位数。
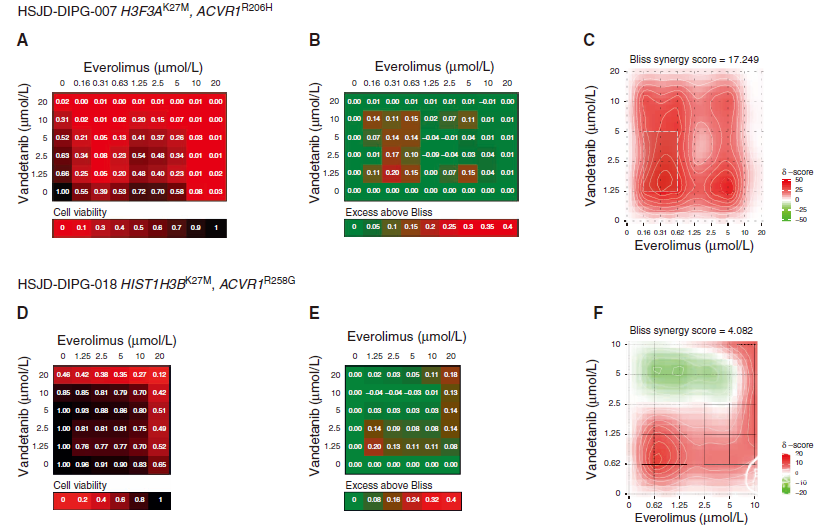
图3. 体外凡德他尼和依维莫司联合用药的协同作用。A. 用不同的凡德他尼(y轴)和依维莫司(x轴)组合(范围为0-20μmol/L)处理的ACVR1R206HHSJD-DIPG-007细胞的细胞活力基质。B. 用不同的凡德他尼(y轴)和依维莫司(x轴)组合(范围为0-20μmol/L)处理的ACVR1R206HHSJD-DIPG-007细胞的Bliss基质过量。C. 用范围为0-10μmol/L的凡德他尼(y轴)和依维莫司(x轴)不同组合处理的ACVR1R206HHSJD-DIPG-007细胞的Bliss协同图。根据提供的关键词着色的热图。D. 用不同的凡德他尼(y轴)和依维莫司(x轴)组合(范围为0-20μmol/L)处理的ACVR1R258GHSJD-DIPG-018细胞的细胞活力基质。E. 用不同的凡德他尼(y轴)和依维莫司(x轴)组合(范围为0-20μmol/L)处理的ACVR1R258GHSJD-DIPG-018细胞的Bliss基质过量。F. 用范围为0-10μmol/L的凡德他尼(y轴)和依维莫司(x轴)不同组合处理的ACVR1R258GHSJD-DIPG-018细胞的Bliss协同图。根据提供的关键词着色的热图。
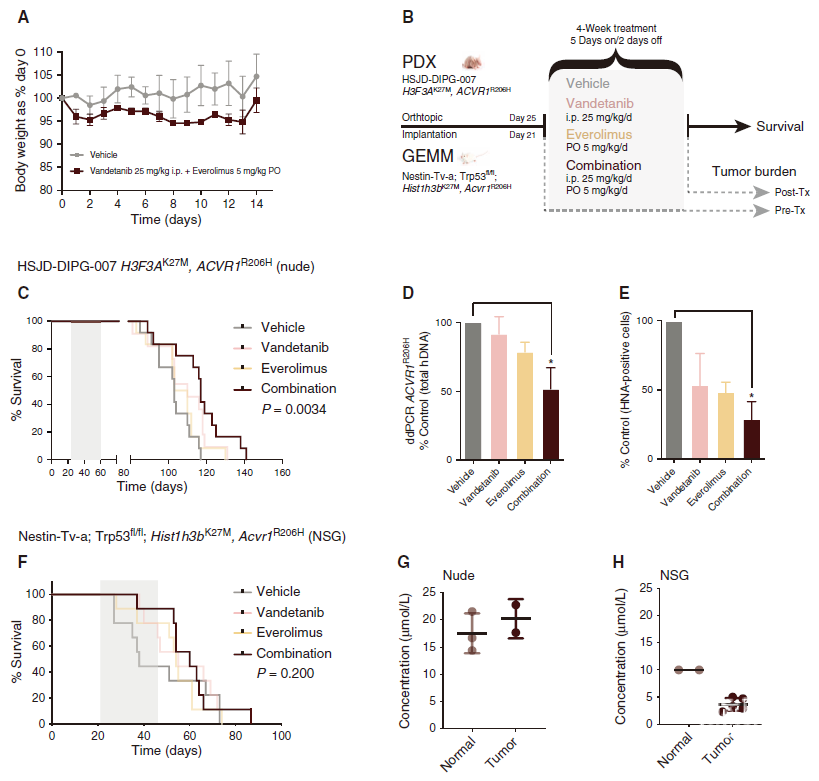
图4. 凡德他尼联合依维莫司的体内疗效。A. 通过相对于第0天的体重评估,每日经口给予凡德他尼和依维莫司联合用药14天的NOD.SCID小鼠的耐受性,绘制每组3只小鼠的平均值和SD图。PO:口服给药。B. 突变型ACVR1驱动的DIPG的原位PDX和GEMM同种异体移植物的体内疗效(生存期)和肿瘤负荷实验示意图。Tx:治疗。C. 接受凡德他尼(粉色)、依维莫司(浅橙色)或联合给药(深红色)的HSJD-DIPG-007原位异种移植物小鼠(n=16–22只/组)与接受溶剂的对照(灰色)相比的生存曲线。D. 用凡德他尼(粉色)、依维莫司(浅橙色)或联合用药(深红色)处理的小鼠中ACVR1R206H通过ddPCR评估定量肿瘤负荷的条形图,表示为溶剂处理对照的百分比(灰色)。E. 用凡德他尼(粉色)、依维莫司(浅橙色)或组合(深红色)处理的小鼠中通过人核抗原(HNA)阳性细胞定量细胞构成的条形图,表示为溶剂对照(灰色)的百分比。平均值和SD图。*,P<0.05,调整t检验。F. 使用凡德他尼(粉色)、依维莫司(浅橙色)或联合用药(深红色)处理的原位同种异体移植物的小鼠(n=16–22只/组)与溶剂处理的对照(灰色)相比的生存曲线。G. 通过质谱法评估接受凡德他尼和依维莫司联合治疗的裸鼠正常大脑和植入肿瘤中凡德他尼浓度的点图。黑色水平线代表中位数。H.通过质谱法评估接受凡德他尼和依维莫司联合治疗的NSG小鼠正常大脑和植入肿瘤中凡德他尼浓度的点图。黑色水平线代表中位数。
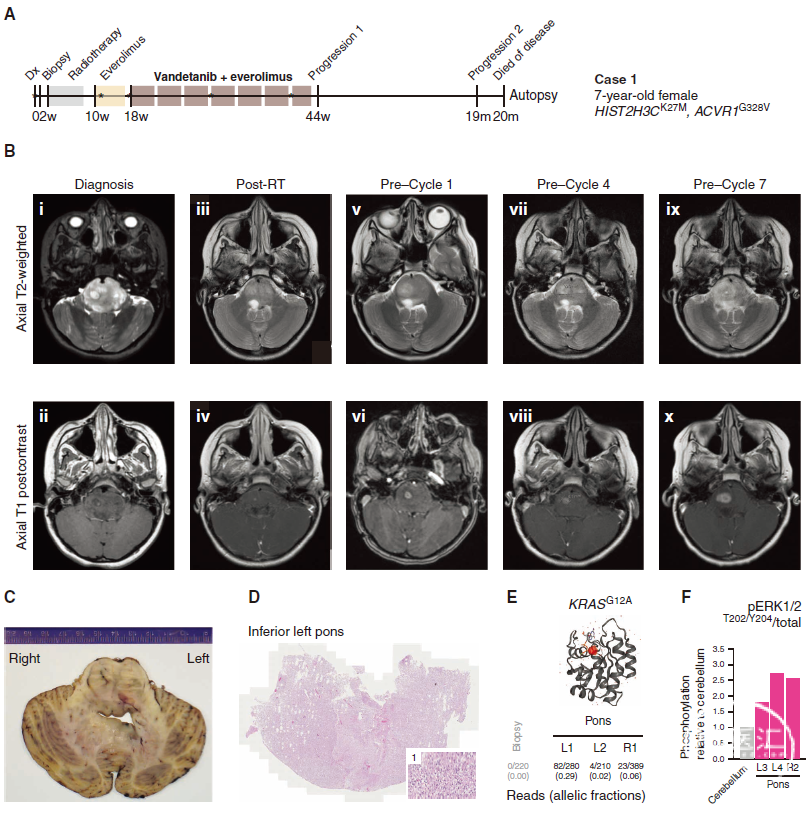
图5. 1例7岁ACVR1突变DIPG女孩接受凡德他尼和依维莫司联合治疗的临床经验。A. 在英国伦敦皇家马斯登医院治疗的临床病史的时间表。B. 连续头部MRI扫描:MRI显示弥漫性异质性肿瘤浸润桥脑并使之扭曲变形,包括基底动脉部分内陷,右侧脑桥中央单灶性瘤内强化;放疗(RT)后6周的MRI扫描显示肿瘤浸润性体积显著减少,右侧脑桥T2上持续存在小灶性增强;3个周期依维莫司单药治疗后的MRI扫描,也是开始凡德他尼/依维莫司治疗前的基线扫描,显示右侧脑桥T2信号异常增加伴局灶性增强轻度增加;凡德他尼/依维莫司治疗3个周期和6个周期后的MRI扫描显示右侧脑桥中度扩大和进行性浸润伴随相关局灶性强化增加,但外观相对稳定/其它部位无进展。该患儿开始接受第7周期凡德他尼/依维莫司治疗,但随后出现症状恶化(言语不清、共济失调),并在初次诊断后11个月永久停止治疗。未给予进一步全身治疗或再照射。患儿可完全停用类固醇,其平衡和活动水平明显改善。停用凡德他尼/依维莫司8个月后,患者发生进一步的临床和放射学进展(局部和转移性),并在1个月后死亡(OS,20个月)。C. 病例1脑尸检标本脑桥和小脑的大体标本横截面。D. 漫性浸润。E. KRAS的蛋白结构表示显示突变型G12A残基(红色阴影),在COSMIC-3D中生成。提供等位基因部分用于尸检时在脑桥不同区域识别的突变读数。F. 通过定量毛细管电泳测定磷酸化ERK1/2T202/Y204在不同尸检区域的MAPK通路活化,绘制为各自磷酸化/总蛋白与正常小脑的比值。
作者认为,凡德他尼和依维莫司联合用药是儿童ACVR1突变型DIPG试验性治疗的可行组合,应进一步强调要求纳入立体定向或液体活检方法进行分子分析,以指导生物学驱动的分层试验。通过获取连续液体活检或分子谱分析诱导的变化后,将有助于提高对克隆进化和对此类方法耐药机制的理解。作者提出,将来开展具有标准化安全性和疗效监测的早期临床试验对于确定该方法用于儿童DIPG的临床疗效至关重要。

声明:脑医汇旗下神外资讯、神介资讯、神内资讯、脑医咨询、AiBrain所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享。












