| AiBrain内容团队编辑
急性中枢神经系统(CNS)损伤是45岁以下人群死亡或(和)残疾的主要原因,虽然引起创伤的诱因很多,但其后果类似,主要是创伤区域有大量的神经元损伤和死亡,这也是患者认知、感觉、运动功能等障碍的神经生物学基础[1]。由于神经元的再生能力有限,目前基于神经元的药物治疗方法还未看到明显的临床效果[2]。CNS损伤会引起多种细胞产生反应,其中包小胶质细胞和星型胶质细胞在此过程中都会被激活,并且由于血脑屏障被破坏,外周免疫细胞也会浸润至CNS[3]。研究表明,在损伤初期被激活的免疫系统起保护作用,但长时间的激活会产生神经毒性。因此对免疫系统的调节对CNS损伤后神经炎症的修复非常重要[3-4]。如何实现对CNS免疫系统的调控也是科学家们一直在关注的问题。
近日,比利时VIB-KU Leuven中心Adrian Liston实验室在Nature Immunology上发表了题为“Astrocyte-targeted gene delivery of interleukin 2 specifically increases brain-resident regulatory T cell numbers and protects against pathological neuroinflammation”的文章,作者开发了一种基于星型胶质细胞的白细胞介素2(IL-2)基因传送方法,可通过小分子开关调控反应性星型胶质细胞的数量,并在脑损伤、中风、多发硬化症等疾病模型小鼠中验证了这种基因方法对神经炎症病理改善的有效性[5]。


Adrian Liston
就职于英国剑桥Babraham Institute和比利时VIB-KU Leuven中心。实验室主要关注调节性T细胞。随着年龄的增长,血液中这些细胞的数量会增加,可能导致老年人的免疫抑制状态。Liston主要应用临床样本和小鼠模型,研究如何通过调节T细胞微调免疫系统,从而实现健康衰老。近年来工作发表于 Nature Immunology,Science 以及Nature Genetics等。
调节性T细胞(简称Treg细胞)在血液和次级淋巴系统中有强大的免疫调节能力,也已有研究证明IL-2可通过对Treg细胞的调控抑制神经炎症,但由于健康的CNS中Treg细胞的数量很少并且涉及到对外周系统的影响,IL-2在临床上的应用存在一定的限制[6]。
研究者们首先测试了基于αCamkII过表达的IL-2对Treg细胞的影响。对过表达IL-2小鼠进行创伤性脑损伤 (TBI)造模后发现,过表达IL-2使得TBI损伤区变小(图1),但IL-2并不影响TBI组Treg细胞的数目,而未进行TBI造模的过表达IL-2小鼠脑内Treg细胞数量增加,这说明Treg细胞的浸润发生在损伤前(图2),且IL-2的确有利于CNS损伤修复。
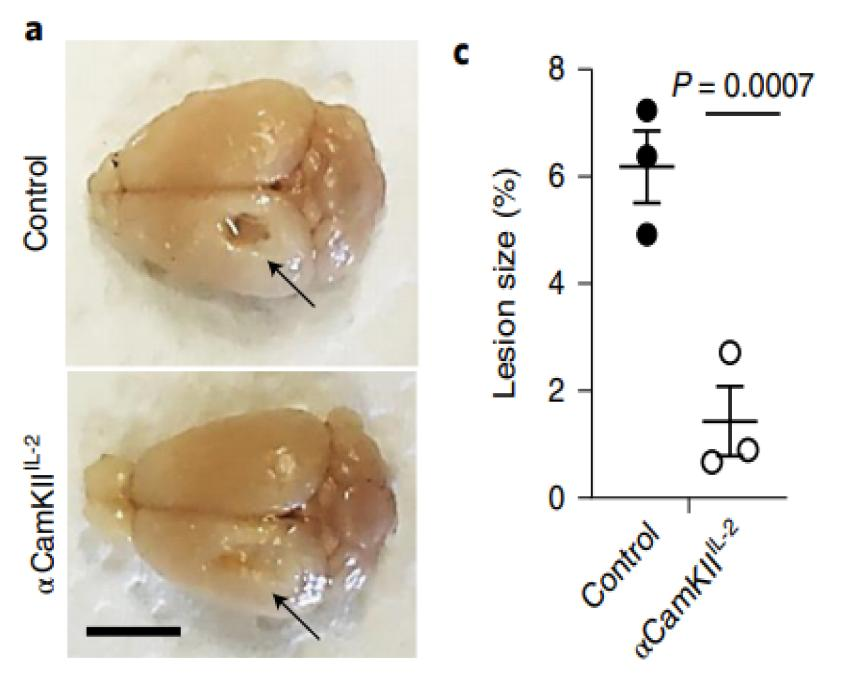
图1 过表达IL-2组损伤区变小
(图源:Yshii et al., Nat Immunol, 2022)
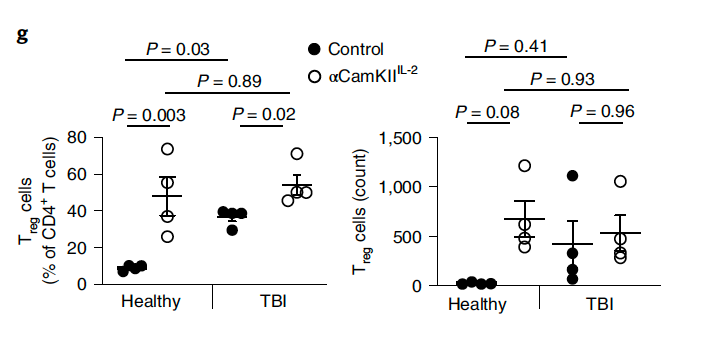
图2 Treg细胞浸润早于TBI
(图源:Yshii et al., Nat Immunol, 2022)
由于星型胶质细胞在脑内广泛分布且可分泌多种物质,并且损伤区常常伴有大量的星型胶质细胞增殖,因此研究者们选择了星型胶质细胞作为表达IL-2的载体。在注射PHP.GFAP-IL-2后,脑内IL-2的含量逐渐增加(图3a,b),且Treg细胞的数目也逐渐增多(图3c)。在TBI小鼠模型中,以星型胶质细胞为载体的IL-2系统使得损伤组损伤区域明显变小(图4),这说明该基因表达系统可以有效的抑制TBI引起的中枢神经系统受损。
此外,研究者们还对过表达IL-2后小胶质细胞的转录组学表型进行了分析。结果显示,无论是对照组还是TBI组,在星型胶质细胞过表达IL-2之后,都观察到MHCII high小胶质细胞数目增多(图5c)。而MHCII high小胶质细胞经常分布于损伤的边缘区域,这种类型的小胶质细胞可能是神经毒性炎症的缓冲。
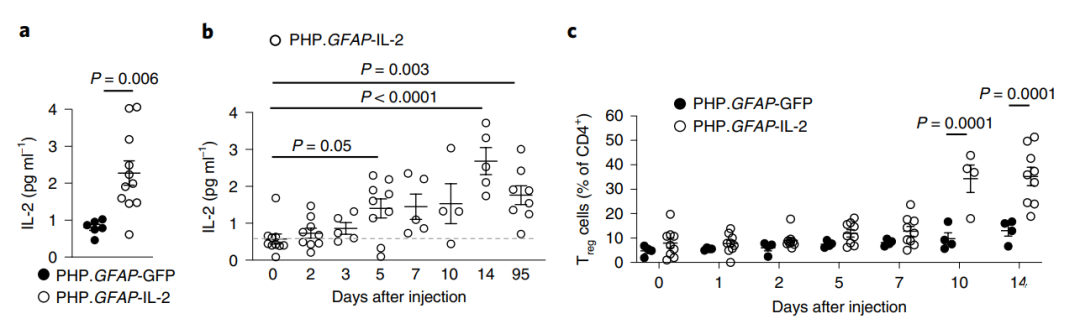
图3 星型胶质细胞表达IL-2使得脑内Treg细胞数量增多
(图源:Yshii et al., Nat Immunol, 2022)
图4 星型胶质细胞表达IL-2可有效抑制TBI引起的损伤
(图源:Yshii et al., Nat Immunol, 2022)
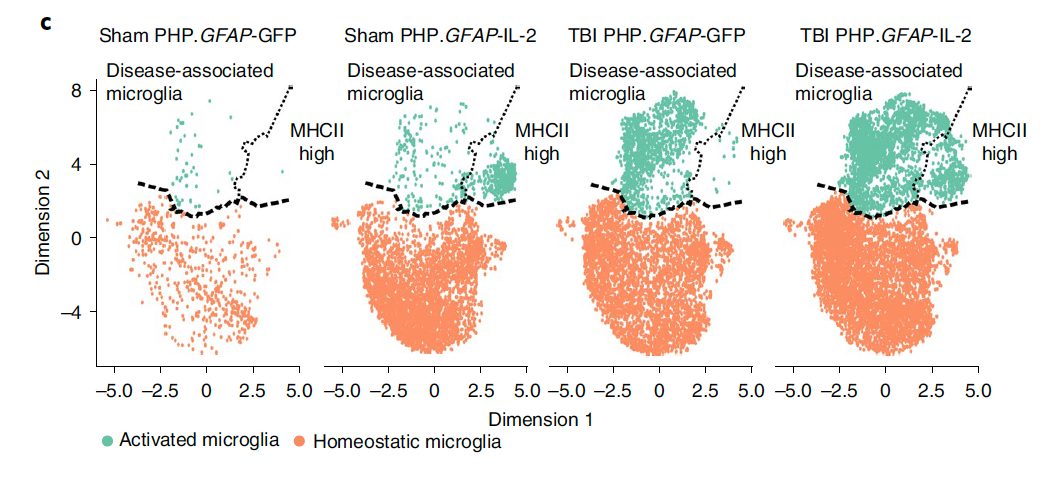
图5 星型胶质细胞表达IL-2引起MHCII high小胶质细胞数目增多
(图源:Yshii et al., Nat Immunol, 2022)
除了TBI模型,研究者们还在大脑中动脉闭塞(MCAO)(图6)和实验性自身免疫性脑脊髓炎(EAE)(图7)两种炎症病理模型中观察了星型胶质细胞-IL2系统的有效性。星型胶质细胞—IL2系统在这两种疾病中也都起到了一定程度的神经保护作用(图6-7)。
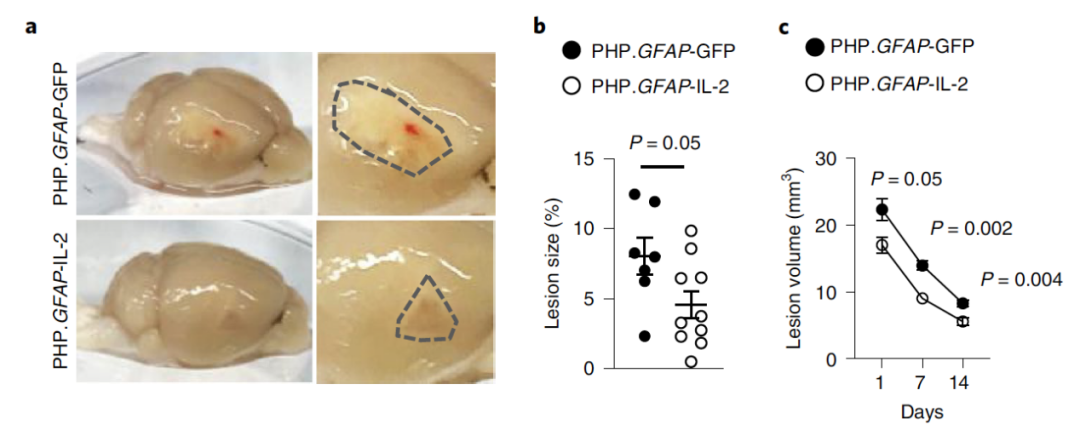
图6 星型胶质细胞-IL2系统对MCAO模型有神经保护作用
(图源:Yshii et al., Nat Immunol, 2022)
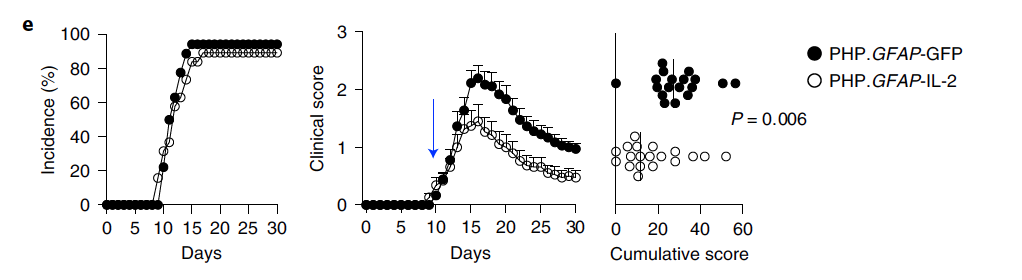
图7 星型胶质细胞-IL2系统对EAE模型有神经保护作用
(图源:Yshii et al., Nat Immunol, 2022)
文章结论与讨论,启发与展望
总之,这项工作确定了白细胞介素2(IL-2)对脑内调节性T细胞(Treg细胞)的调控作用,并提出了一种基于星型胶质细胞的基因传递系统,该系统可透过血脑屏障,增强反应性星型胶质细胞IL-2分泌量,并在创伤性脑损伤、中风和多发性硬化症模型小鼠中都观察到了对神经系统的保护作用,这也为该技术向临床转化提供了坚实的理论和实验基础。
虽然这项工作提出了一个非常有效的可调控神经免疫的模型,但该工作也存在一些不足。医学领域从动物实验向临床的转化是十分漫长并严谨的,这项工作虽然在不同动物模型中都观察到了对神经炎症的有效控制,但这仅限于分子层面。这个系统对小鼠的行为学是否也有改善还有待进一步研究。
相关论文信息:
https://doi.org/10.1038/s41590-022-01208-z
参考文献 :


声明:脑医汇旗下神外资讯、神介资讯、脑医咨询、AiBrain所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享


