其他作者:李卓,胡文洁,周汉,高靖辰,崔玉,栗世方,万芪作者单位:青岛大学附属医院神经外科,#青岛大学基础医学院生理学与病理生理学系
[REF: Chen B, Kong X, Li Z, et al. Downregulation of NF-κB by Shp-1 alleviates cerebral venous sinus thrombosis-induced brain edema via suppression of AQP4 [published online ahead of print, 2022 May 25]. J Stroke Cerebrovasc Dis. 2022;31(8):106570. doi:10.1016/j.jstrokecerebrovasdis.2022.106570] PMID: 35636226
水通道蛋白4(Aquaporin 4,AQP4)是一种水通道蛋白,在动脉卒中诱导的脑水肿中有很好的研究。然而,AQP4在脑静脉窦血栓形成(CVST)中的作用尚未见报道。在本研究中,我们发现AQP4在大鼠CVST模型中表达增加,而抑制AQP4可以减少脑水肿。随后的实验表明,CVST后,Shp-1(Src同源性2-含磷酸酶-1)的表达以及NF-κB磷酸化水平上调。我们发现,抑制Shp-1后,NF-κB活化增强,AQP4表达增加,并伴有脑水肿加重。我们进一步的实验发现,抑制NF-κB可导致AQP4表达降低,随后脑水肿减轻,但对Shp-1表达无显著影响。这些结果提供了第一个证据,表明Shp-1下调NF-κB并通过抑制AQP4减轻CVST诱导的脑水肿。关键词:cerebral venous sinus thrombosis,brain edema,AQP4,Shp-1,NF-κB
脑静脉窦血栓形成(CVST)是一种罕见的中风,通常影响年轻人,约占所有中风的0.5%-3%。[1-3]虽然CVST的发生率很低,但它是一个潜在的致命威胁,由于影像学和治疗的进步,CVST相关的死亡率从最初的30%-50%下降到大约6.8%-11%。[2-5]CVST引起静脉充血,导致颅内压升高、缺氧、缺血和梗死,血脑屏障通透性增加。[6,7]在动脉性卒中时,缺氧会导致一系列事件,包括细胞因子、趋化因子、自由基、活性氧(ROS)和兴奋性毒性的产生。[8,9]CVST中也发现了类似的病理机制。多项研究表明,大鼠上矢状窦阻塞后,ROS和代谢物(如谷氨酸)的水平显著升高,额叶皮层抗氧化系统的活性降低。[6,10]
脑水肿参与许多脑部疾病(如炎症、肿瘤、创伤性脑损伤)的病理过程,由于脑内渗透平衡机制失衡,导致脑肿胀、脑灌注减少、继发性损伤增加。[11]脑水肿是影响CVST患者预后的重要原因[3,12],同时,细胞毒性脑水肿主要出现在CVST早期待。[13-15]Tsai等人在核磁共振(MRI)上观察到CVST患者脑实质的变化,这些变化根据脑静脉窦内压力的改变可分为5个阶段。这些阶段包括:1.无实质改变阶段;2.脑肿胀,但无信号改变阶段;3.实质信号改变阶段;4.重度水肿伴或不伴少量出血阶段;5.严重水肿和/或出血阶段。[16]对CVST所引发脑水肿的干预可能阻止其进入下一阶段。
AQP4是大脑中最丰富的水通道蛋白。它负责细胞内的水转运,参与脑缺血、炎症、脑外伤、脑肿瘤、癫痫、代谢紊乱等疾病的病理过程。[17,18]AQP4促进水跨细胞膜双向流动。[19]CNS(中枢神经系统)损伤早期,水通过AQP4驱动细胞毒性水肿,但随后清除血管源性水肿。[20]CNS水肿与AQP4表达增加密切相关,细胞毒性水肿和血管源性水肿是CNS水肿主要并且相互依赖的组成部分,细胞毒性水肿延长可导致血管源性水肿,反之亦如此。[21]AQP4在动脉性卒中以及其他脑损伤疾病引起的脑水肿中的作用已被很好地描述;[22,23]但与CVST引发的脑水肿是否有关及可能的机制尚未见报道。在小鼠中,AQP4缺陷与水中毒和中风引发的脑水肿的显著减轻以及生存率的增加、神经功能缺损的显著改善有关。[24]这些研究使得我们推测AQP4参与了CVST引发的脑水肿。NF-κB(nuclear factor-kappa B)信号通路参与多种细胞功能,包括造血、炎症、凋亡和免疫应答。[25]p65是NF-κB的一个亚基,磷酸化的p65(p-p65)是NF-κB活化的标志,NF-κB信号是经典的炎症信号。[26]CVST后脑组织出现缺氧、自由基和炎症因子的释放。[6,10,27]炎症与CVST诱导的脑水肿之间的关系已被多项研究证实:抑制炎症因子的释放和表达可减轻CVST大鼠脑损伤和脑水肿。[3,7,27]既往的文献报道表明,在多种脑损伤疾病中,抑制NF-κB炎症信号通路可降低AQP4表达,减轻脑水肿。[28-30]因此,我们推测,与其他疾病类似,CVST中NF-κB磷酸化的激活可能会导致AQP4的表达变化,从而影响脑水肿。
Shp-1(Src同源2-含磷酸酶-1)是一种强大的抗炎因子,来自Shp-1基因缺陷小鼠大脑的星形胶质细胞在IFN-γ和LPS刺激下表现出更强的炎症反应。[31]在大脑中动脉闭塞(MCAO)动物模型中,Shp-1在大脑皮层表达增加,发挥抗炎作用[32,33]抑制Shp-1或Shp-1缺乏可增加NF-κB活化,加重炎症反应,从而加重缺氧诱导的损伤。[31,33-35]由此我们推测,抑制CVST大鼠Shp-1可能会增强NF-κB信号通路,进而调控AQP4的表达,参与CVST导致的脑水肿的病理过程。 因此,我们推测AQP4参与了CVST引发的脑水肿,Shp-1在CVST后通过NF-κB介导的信号通路调控AQP4的表达。我们进行这项研究是为了验证我们的假设。我们首次发现CVST后AQP4、Shp-1表达及NF-κB激活增加,其脑水肿与AQP4表达有关。此外,我们的研究还表明,Shp-1可能通过NF-κB信号通路调控AQP4的表达,并参与了CVST后脑水肿的发生。这一发现可能成为治疗和改善CVST患者预后的潜在靶点。
成年雄性SD(Sprague-Dawley)大鼠,体重250280g,购买自济南朋悦实验动物繁育有限公司。按照Tiwari等人和Srivastava等人报道的方法制作大鼠CVST模型。[6,36]TGN-020:AQP4的选择性抑制剂,用法:腹腔注射,100mg/kg;[37]TPI-1:Shp-1的特异性抑制剂,腹腔注射1mg/kg;[33]JSH-23:NF-κB的选择性抑制剂,腹腔注射,5mg/kg。[38]参照Gu等人的方法测定脑含水量。[3]参照Xu等人的方法进行脑组织TTC染色。[9]按Tiwari等人的方法分离了额叶皮层并制备了蛋白质样本进行了Western Blot实验。[6]免疫荧光实验参照Xu等人的方法。[9]
所有数据均表示为平均标准误差,使用GraphPad Prism软件进行统计分析。采用单因素方差分析(ANOVA)和Tukey检验进行统计学比较。这里,p<0.05表示具有统计学意义。
如前所述,我们用氯化铁建立了大鼠CVST模型。[6,36]为了验证模型,我们采用TTC染色技术观察CVST后24h大鼠的脑梗死情况(图1A),结果与Mu等人和Gu等报道的结果相同(图1A)。[3,27]然后,我们进一步解剖了CVST大鼠的上矢状窦,可见明确的血栓形成。这些数据充分证明了我们的模型是成功的。
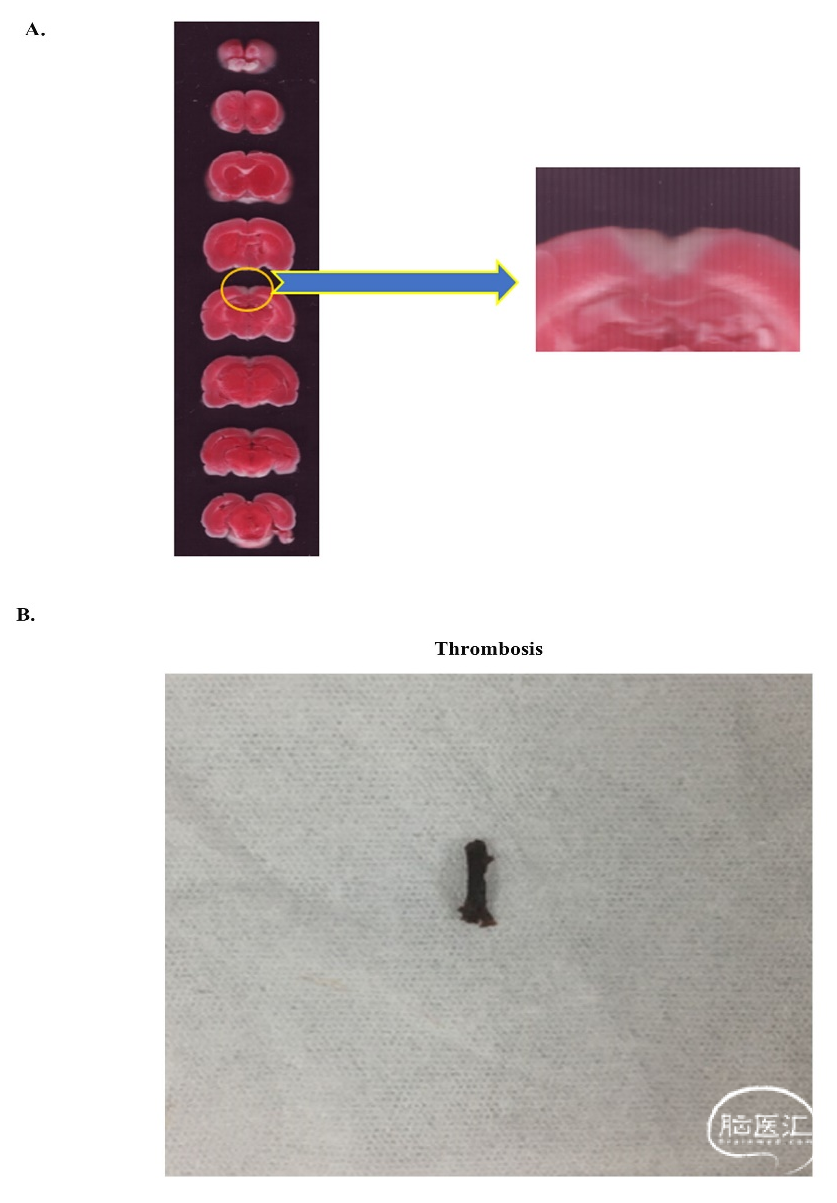
图1. 验证CVST建模。(A)TTC染色验证了CVST模型的成功;(B)CVST后从上矢状窦解剖出的血栓。
将12只大鼠分为对照组、假手术组和CVST组,每组4只。我们用干湿比重法测量了各组大鼠24h后的脑水含量,发现CVST组大鼠脑含水量明显高于Sham组(图2A)。动脉性卒中后大鼠脑内AQP4表达水平升高,[39,40]我们推测在CVST后大鼠脑内AQP4的表达可能也升高。因此,我们将其余16只大鼠分为Control组、Sham组、CVST 6h组和CVST 24h组。在CVST模型建立后,我们检测了AQP4的表达。Western blot结果显示,CVST后6h,AQP4即升高,24h后显著升高(图2B-C)。随后,另取8只大鼠分为Sham组和CVST组。我们使用免疫荧光技术发现,AQP4在CVST大鼠大脑皮层的表达高于Sham组(图2D)。上述结果提示CVST引起脑水肿,并且AQP4的表达增加。
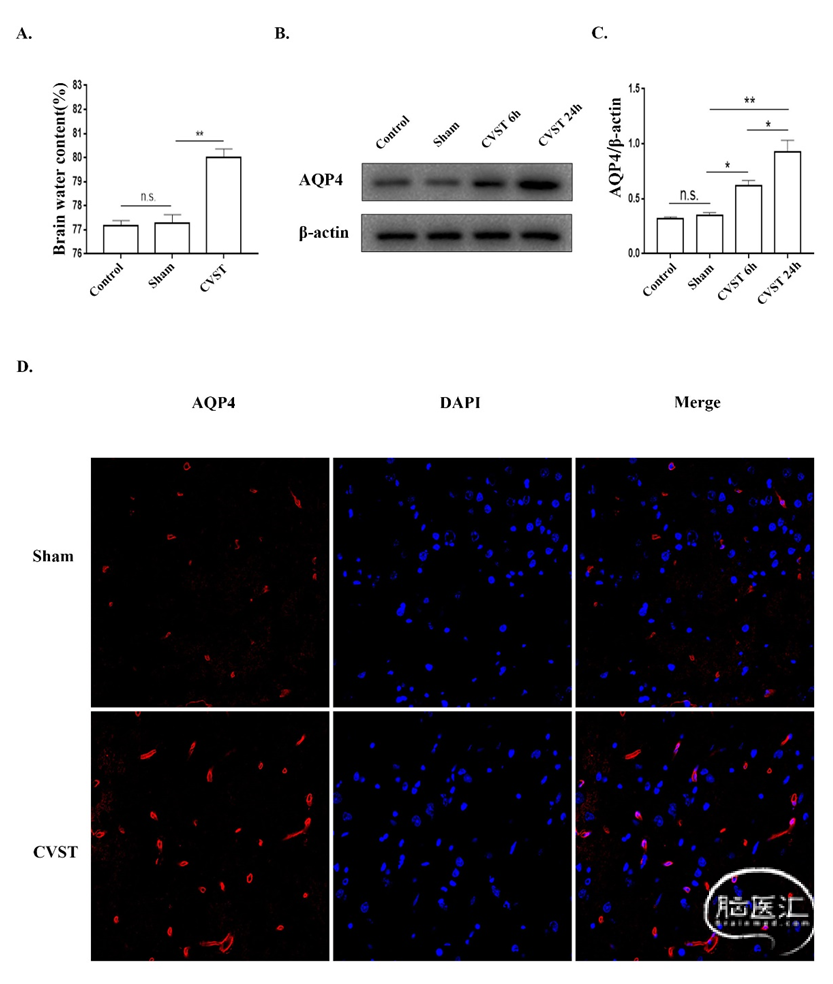
图2. CVST后,AQP4表达上调,脑含水量增加。(A)Control组、Sham组和CVST组脑含水量测定。(B)和(C)Western blot检测AQP4在Control、Sham、CVST 6h和CVST 24h组的表达。(D)免疫荧光染色检测AQP4在CVST后大脑皮层的表达。用共聚焦显微镜观察AQP4表达,红色荧光表示AQP4,DAPI染色细胞核。*P<0.05;**P<0.01;n.s.,无统计学意义。将16只大鼠分为Sham组、CVST组、CVST+vehicle组和CVST+TGN-020(AQP4选择性抑制剂)组,每组4只,用于研究抑制AQP4表达对脑水含量的影响。与CVST+vehicle组相比,CVST组无显著差异;与CVST+vehicle组相比,CVST+TGN-020组脑水含量显著降低(图3A)。接下来,我们用同样的方法将其他16只大鼠分组,通过Western blot检测各组AQP4的表达。结果显示,TGN-020组AQP4表达明显低于CVST+vehicle组(图3B-C)。在后续的实验中,我们将12只大鼠分为Sham组、CVST组、CVST+TGN-020组,对其脑组织进行免疫荧光染色。与Western blot结果相似,与CVST组相比,CVST+TGN-020组AQP4表达降低(图3D)。上述结果表明,抑制AQP4表达可导致CVST后脑水肿减少。这一发现证实了我们的假设,即CVST诱导的脑水肿与AQP4表达增加相关。
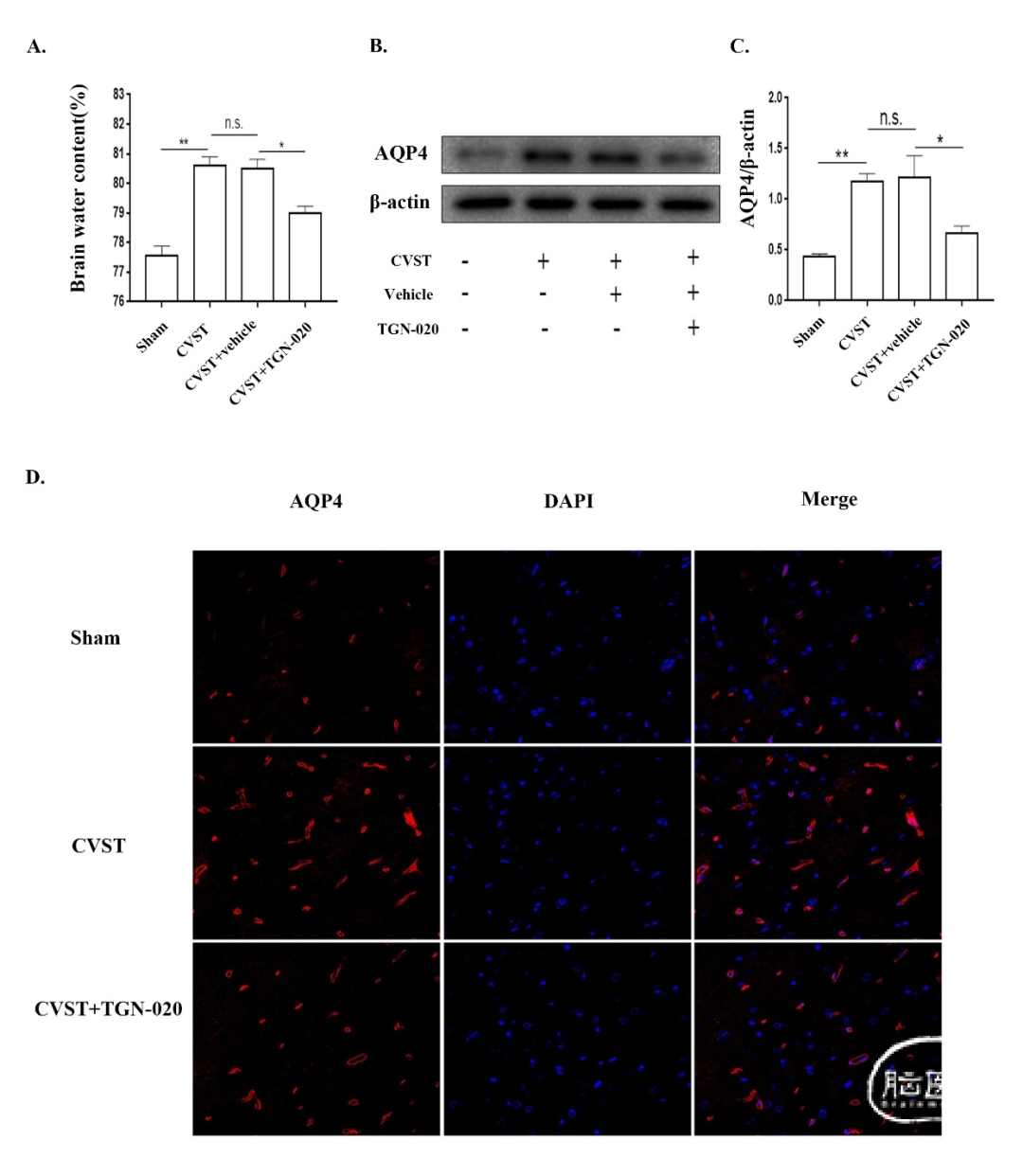
图3. 抑制AQP4减轻CVST后24小时脑水肿。(A)Sham组、CVST组、CVST+vehicle组和CVST+TGN-020(AQP4选择性抑制剂)组脑含水量测定。(B)和(C)Western blot检测Sham、CVST、CVST+vehicle和CVST+TGN-020组AQP4。(D)采用免疫荧光染色检测使用TGN-020后CVST大鼠大脑皮层AQP4表达的变化。用共聚焦显微镜观察AQP4表达,红色荧光表示AQP4,DAPI染色细胞核。*P<0.05;**P<0.01;n.s.,无统计学意义。
在大鼠CVST模型中,Shp-1表达增加并调节NF-κB活性和AQP4表达
为了验证我们关于Shp-1参与CVST后脑水肿的假设,我们首先将12只大鼠分为Sham组、CVST组和CVST+TPI-1(一种Shp-1特异性抑制剂)组。我们测量了CVST后24小时大鼠的脑水含量(图4A),结果显示,与CVST组相比,CVST+TPI-1组大鼠的脑水含量增加。随后,将另外16只大鼠分为Sham组、CVST组、CVST+vehicle组和CVST+TPI-1组。在给予相关处理后,我们取大脑皮层,检测Shp-1、NF-κB和AQP4的表达(图4B-E)。结果表明,CVST后Shp-1、AQP4和NF-κB磷酸化表达增加,且表达与动脉卒中模型相似。[33,41,42]此外,NF-κB磷酸化和AQP4表达在CVST+TPI-1组显著高于CVST+vehicle组。这些结果表明,CVST后Shp-1的变化可触发NF-κB磷酸化和AQP4表达的变化。接下来,我们再用12只大鼠,将其分为Sham组、CVST组和CVST+TPI-1组。免疫荧光染色检测各组AQP4表达情况(图4F)。结果显示,与Sham组相比,CVST组AQP4表达显著升高,而CVST+TPI-1组AQP4表达显著高于CVST组。提示在CVST大鼠模型中,Shp-1可能调节NF-κB磷酸化的激活和AQP4的表达,这说明Shp-1参与了CVST诱导的脑水肿。
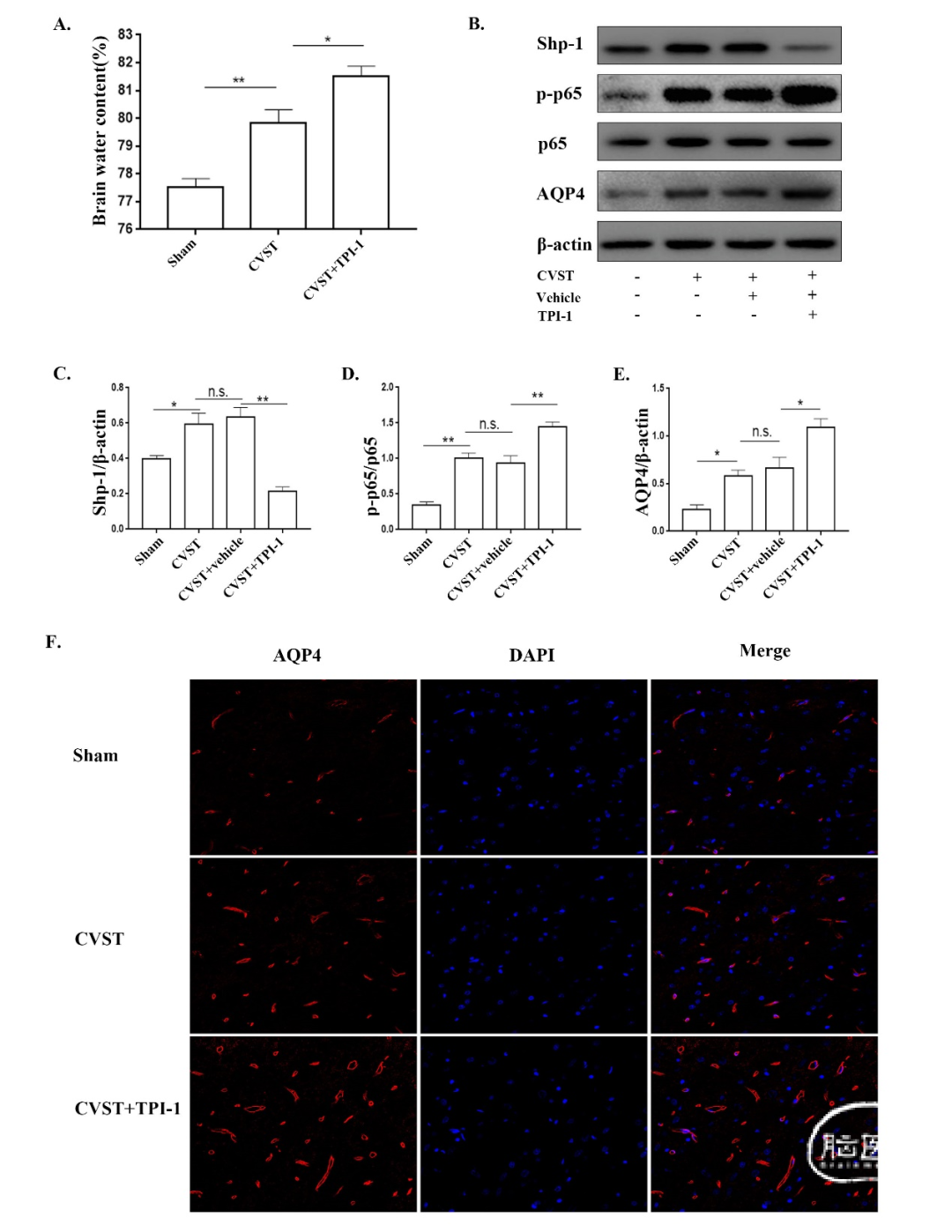
图4. CVST后24h,抑制Shp-1引起NF-κB磷酸化和AQP4表达增加,脑水肿加重。(A)Sham组、CVST组、CVST+TPI-1(Shp-1特异性抑制剂)组脑水含量测定。(B)-(E)Western blot检测Sham、CVST、CVST+vehicle和CVST+TPI-1组中Shp-1、p65、p-p65和AQP4。(D)应用免疫荧光染色方法检测TPI-1对CVST大鼠大脑皮层AQP4表达的影响。用共聚焦显微镜观察AQP4表达,红色荧光表示AQP4,DAPI染色细胞核。*P<0.05;**P<0.01;n.s.,无统计学意义。
Shp-1通过NF-κB调控CVST后AQP4的表达
为了探讨NF-κB与AQP4的关系,我们将12只大鼠分为Sham组、CVST组和NF-κB选择性抑制剂CVST+JSH-23组,检测NF-κB抑制后脑水含量的变化。数据显示,使用JSH-23后,脑含水量下降(图5A)。随后,将另外16只大鼠分为Sham组、CVST组、CVST+vehicle组和CVST+JSH-23组,检测相关蛋白的表达情况(图5B-E)。我们的结果显示使用JSH-23后p65磷酸化水平降低,这与之前的研究一致。[43-45]我们发现NF-κB活性的降低导致了AQP4的下调,但是Shp-1的表达没有显著变化。最后,我们将另外12只大鼠分为Sham组、CVST组和CVST+JSH-23组,免疫荧光染色其脑组织。结果显示,使用JSH-23后,AQP4表达降低(图5F)。这些发现表明NF-κB活性可调控CVST后AQP4的表达。我们的研究与NF-κB抑制可减弱AQP4在脑出血后的表达这一报道类似。[28]
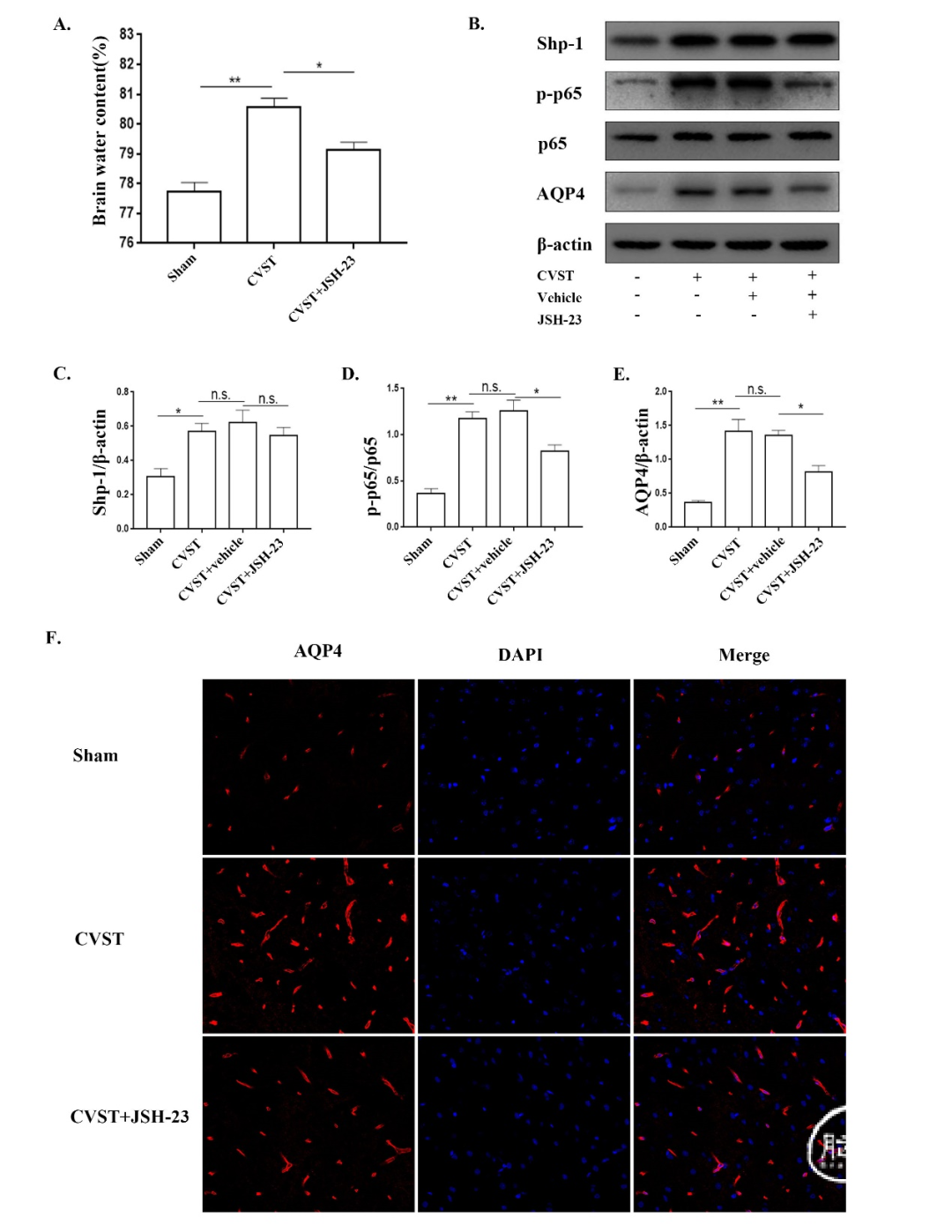
图5. CVST后24h,抑制NF-κB可降低AQP4表达,减轻脑水肿,但不影响Shp-1表达。(A)Sham组、CVST组、CVST+JSH-23(NF-κB选择性抑制剂)组脑含水量测定。(B)-(E)Western blot检测Sham、CVST、CVST+vehicle和CVST+JSH-23组中Shp-1、p65、p-p65和AQP4。(D)采用免疫荧光染色方法观察使用JSH-23后CVST大鼠大脑皮层AQP4表达的变化。用共聚焦显微镜观察AQP4表达,红色荧光表示AQP4,DAPI染色细胞核。*P<0.05;**P<0.01;n.s.,无统计学意义。
我们的研究发现,Shp-1可以影响CVST后NF-κB活性和AQP4的表达(图4)。然后,抑制NF-κB导致AQP4表达显著降低(图5B,图5E),但不影响Shp-1的表达(图5B-c)。因此,可以推断Shp-1可能通过NF-κB调节AQP4的表达参与了CVST诱导的脑水肿。
我们的研究发现,脑梗死后AQP4、Shp-1表达水平和NF-κB信号活性升高,并共同参与了CVST诱导的脑水肿。此外,我们的研究表明,在大脑中可能存在一个通路,Shp-1通过NF-κB介导的AQP4表达参与脑水肿。
CVST后24h,大鼠额叶皮层Mn-超氧化物歧化酶(Mn-SOD)、谷胱甘肽过氧化物酶、过氧化氢酶活性和GSH水平降低,脂质过氧化升高,提示抗氧化系统受到影响,氧化应激升高。[6]另一项研究显示CVST后第1天脑皮层ROS水平显著升高。[10]这一发现与动脉性卒中后的表现相似,[46,47]这提示CVST与动脉性卒中可能存在相似的病理改变。众所周知,脑水肿会导致组织死亡,并可能导致颅内压升高和致命的脑疝,随后导致死亡。[11,48]在广泛和快速形成的CVST中,离子泵的失效可能部分类似于动脉性卒中的病理改变,以较快的速度进行,[15]这可能促进了CVST后早期细胞毒性脑水肿的形成。作为脑内最丰富的水通道蛋白,AQP4在动脉卒中脑水肿中起关键作用。[39,49,50]这一观点与我们的研究结果一致,即AQP4在CVST导致的脑水肿中也具有重要作用,在早期表达增加,抑制AQP4可减轻脑水肿。一项对160例CVST患者的临床研究显示,上矢状窦血栓形成后,脑实质病变最常见的部位是额叶和颞叶,这与上矢状窦闭塞后引流不良有关。[2]Uszman等人认为,颅内静脉闭塞并不一定会导致颅内出血或梗死,但广泛的脑水肿可能是上矢状窦闭塞的常见后果。[12]因此,早期抑制AQP4可以减轻CVST引起的水肿,这可能为未来CVST患者的临床治疗提供新的思路。
NF-κB是一个重要的炎症调节因子,促进炎症细胞因子的产生。[51]Shi等人报道,抑制NF-κB可降低MCAO早期TNF-α、IL-6、IL-1β的表达,从而保护大脑。[52]我们观察到CVST后大脑皮层NF-κB的活性增强。这可能是CVST大鼠模型中炎症因子TNF-α、IL-6、IL-1β表达增加的原因。[3]Wang等人发现,Fe2+处理星形胶质细胞后,其内的NF-κB磷酸化增强;抑制NF-κB磷酸化可导致脑出血动物模型中AQP4表达减少,脑水肿减少。[28]此前的另外两篇报道也证实了同样的发现:NF-κB在急性缺氧脑损伤疾病中调节AQP4的表达。[29,30]这一发现与我们检测到NF-κB调控CVST后AQP4表达的结果一致,也提示了CVST虽然不同于动脉卒中,但可能存在类似的病理改变。这些信息可能代表了一个有趣的方向,值得在未来进一步研究。
Shp-1是一种强大的抗炎因子,其缺乏会导致小鼠自发炎症和自身免疫。[53,54]与CVST后的观察结果一致,MCAO后小鼠大脑皮质中Shp-1表达升高。[32]Shp-1基因缺陷小鼠脑星形胶质细胞炎症反应增强。[31]最近的一项研究表明,MCAO大鼠腹腔注射TPI-1后,损伤脑组织中Shp-1蛋白表达水平下降,损伤组织表现出更强烈的炎症反应。这与我们的结果相似。[33]NF-κB—炎症信号,与Shp-1-st2(生长抑素受体亚型2)依赖的NF-κB激活的关键介质,之间的相互作用已被反复报道。[55]Shp-1缺乏导致MS(多发性硬化症)患者外周血单核细胞和巨噬细胞中炎症基因表达增加,并增强转录因子STAT6、STAT1和NF-κB的活化。[56,57]另一项研究表明,Shp-1和TRAF6结合导致TRAF6去泛素化,并抑制RANKL(核因子-κB配体受体激活剂)激活的骨髓基质细胞中NF-κB的活性。[34]这些信息验证了我们的发现,抑制Shp-1会增加CVST后NF-κB磷酸化。我们的结果得到了其他研究更直接的支持。例如,在中枢神经系统中,Shp-1抑制或缺乏Shp-1的星形胶质细胞NF-κB活性增强。[31]大鼠MCAO后,Shp-1通过抑制NF-κB活性发挥抗炎作用。[33]这一发现提示Shp-1可能通过NF-κB磷酸化在CVST和MCAO模型中发挥类似的抗炎作用,并影响下游炎症因子的释放。最近的研究表明,抑制NF-κB可降低MCAO后TNF-α、IL-6和IL-1β的表达,[52]而抑制炎症因子TNF-α、IL-6和IL-1β的释放可减轻CVST诱发的脑水肿。[3]这一发现为CVST引发NF-κB的改变调控AQP4表达并参与脑水肿提供了证据。因此,我们认为CVST后,Shp-1可能通过NF-κB调节AQP4的表达,参与了脑水肿的病理过程。鉴于CVST和MCAO模型中可能存在类似的病理反应,MCAO模型中也可能存在类似的通路,这也许将是未来值得研究的方向。
我们的研究也有局限性。我们只研究了AQP4在CVST 6h和24h的表达变化,以及Shp-1和NF-κB在24h的变化,可能需要更详细的研究来评估早期和后期的变化以及它们的变化机制。同时,我们对Shp-1、NF-κB和AQP4之间关系的研究还不够深入。我们将在未来进一步研究它们之间的相互关系。
总之,我们的研究为AQP4在CVST诱导的脑水肿中发挥重要作用提供了证据,并首次揭示了AQP4、Shp-1表达和NF-κB磷酸化共同参与了CVST后脑水肿的发生。此外,我们发现Shp-1可能通过NF-κB调控AQP4的表达,从而影响脑水肿的病理过程。该机制可能是一种潜在的治疗CVST和改善预后的方法。
1.Al Hashmi, K., Al Wahaibi, K., Al-Khabori, M. & Al Lamki, S. Characteristics and Outcomes of Patients with Cerebral Venous Sinus Thrombosis. Oman Med J 34, 434-437 (2019).
2.Kalita, J., Singh, V.K., Jain, N., Misra, U.K. & Kumar, S. Cerebral Venous Sinus Thrombosis Score and its Correlation with Clinical and MRI Findings. J Stroke Cerebrovasc Dis 28, 104324 (2019).3.Gu, J.J., Chen, J.B., Zhang, J.H., Zhang, H. & Wang, S.S. Recombinant human soluble thrombomodulin protects against brain injury in a CVST rat model, via downregulation of the HMGB1-RAGE axis. Mol Med Rep 14, 5217-5222 (2016).4.Borhani Haghighi, A., et al. Mortality of cerebral venous-sinus thrombosis in a large national sample. Stroke 43, 262-264 (2012).5.Ferro, J.M., et al. Cerebral vein and dural sinus thrombosis in Portugal: 1980-1998. Cerebrovasc Dis 11, 177-182 (2001).6.Tiwari, H.S., Misra, U.K., Kalita, J., Mishra, A. & Shukla, S. Oxidative stress and glutamate excitotoxicity contribute to apoptosis in cerebral venous sinus thrombosis. Neurochem Int 100, 91-96 (2016).7.Nagai, M., et al. Roles of inflammation and the activated protein C pathway in the brain edema associated with cerebral venous sinus thrombosis. Stroke 41, 147-152 (2010).8.Clarkson, A.N., Sutherland, B.A. & Appleton, I. The biology and pathology of hypoxia-ischemia: an update. Arch Immunol Ther Exp (Warsz) 53, 213-225 (2005).9.Xu, X., et al. SETD3 Downregulation Mediates PTEN Upregulation-Induced Ischemic Neuronal Death Through Suppression of Actin Polymerization and Mitochondrial Function. Mol Neurobiol 58, 4906-4920 (2021).10.Srivastava, A.K., Kalita, J., Dohare, P., Ray, M. & Misra, U.K. Studies of free radical generation by neurons in a rat model of cerebral venous sinus thrombosis. Neurosci Lett 450, 127-131 (2009).11.Hirt, L., et al. Improved long-term outcome after transient cerebral ischemia in aquaporin-4 knockout mice. J Cereb Blood Flow Metab 37, 277-290 (2017).12.Usman, U. & Wasay, M. Mechanism of neuronal injury in cerebral venous thrombosis. J Pak Med Assoc 56, 509-512 (2006).13.Frerichs, K.U., et al. Cerebral sinus and venous thrombosis in rats induces long-term deficits in brain function and morphology--evidence for a cytotoxic genesis. J Cereb Blood Flow Metab 14, 289-300 (1994).14.Forbes, K.P., Pipe, J.G. & Heiserman, J.E. Evidence for cytotoxic edema in the pathogenesis of cerebral venous infarction. AJNR Am J Neuroradiol 22, 450-455 (2001).15.Srivastava, A.K., Kalita, J., Haris, M., Gupta, R.K. & Misra, U.K. Radiological and histological changes following cerebral venous sinus thrombosis in a rat model. Neurosci Res 65, 343-346 (2009).16.Tsai, F.Y., et al. MR staging of acute dural sinus thrombosis: correlation with venous pressure measurements and implications for treatment and prognosis. AJNR Am J Neuroradiol 16, 1021-1029 (1995).17.Rosu, G.C., et al. Expression patterns of aquaporins 1 and 4 in stroke. Rom J Morphol Embryol 60, 823-830 (2019).18.Zador, Z., Stiver, S., Wang, V. & Manley, G.T. Role of aquaporin-4 in cerebral edema and stroke. Handb Exp Pharmacol, 159-170 (2009).19.Papadopoulos, M.C. & Verkman, A.S. Aquaporin water channels in the nervous system. Nat Rev Neurosci 14, 265-277 (2013).20.Verkman, A.S., Smith, A.J., Phuan, P.W., Tradtrantip, L. & Anderson, M.O. The aquaporin-4 water channel as a potential drug target in neurological disorders. Expert Opin Ther Targets 21, 1161-1170 (2017).21.Kitchen, P., et al. Targeting Aquaporin-4 Subcellular Localization to Treat Central Nervous System Edema. Cell 181, 784-799 e719 (2020).22.Mestre, H., et al. Cerebrospinal fluid influx drives acute ischemic tissue swelling. Science 367(2020).23.Badaut, J., Ashwal, S. & Obenaus, A. Aquaporins in cerebrovascular disease: a target for treatment of brain edema? Cerebrovasc Dis 31, 521-531 (2011).24.Manley, G.T., et al. Aquaporin-4 deletion in mice reduces brain edema after acute water intoxication and ischemic stroke. Nat Med 6, 159-163 (2000).25.Zhu, J.R., et al. Berberine attenuates ischemia-reperfusion injury through inhibiting HMGB1 release and NF-kappaB nuclear translocation. Acta Pharmacol Sin 39, 1706-1715 (2018).26.Bai, C., et al. Anti-proliferative effect of RCE-4 from Reineckia carnea on human cervical cancer HeLa cells by inhibiting the PI3K/Akt/mTOR signaling pathway and NF-kappaB activation. Naunyn Schmiedebergs Arch Pharmacol 389, 573-584 (2016).27.Mu, S.W., et al. Effect of HMGB1 and RAGE on brain injury and the protective mechanism of glycyrrhizin in intracranialsinus occlusion followed by mechanical thrombectomy recanalization. Int J Mol Med 44, 813-822 (2019).28.Wang, B.F., et al. Curcumin attenuates brain edema in mice with intracerebral hemorrhage through inhibition of AQP4 and AQP9 expression. Acta Pharmacol Sin 36, 939-948 (2015).29.Wang, C., et al. Protective effects of puerarin on acute lung and cerebrum injury induced by hypobaric hypoxia via the regulation of aquaporin (AQP) via NF-kappaB signaling pathway. Int Immunopharmacol 40, 300-309 (2016).30.Song, T.T., et al. Systemic pro-inflammatory response facilitates the development of cerebral edema during short hypoxia. J Neuroinflammation 13, 63 (2016).31.Massa, P.T. & Wu, C. Increased inducible activation of NF-kappaB and responsive genes in astrocytes deficient in the protein tyrosine phosphatase SHP-1. J Interferon Cytokine Res 18, 499-507 (1998).32.Wishcamper, C.A., Brooks, D.M., Douglas Coffin, J. & Lurie, D.I. Focal cerebral ischemia upregulates SHP-1 in reactive astrocytes in juvenile mice. Brain Res 974, 88-98 (2003).33.Peng, L., et al. DJ-1 exerts anti-inflammatory effects and regulates NLRX1-TRAF6 via SHP-1 in stroke. J Neuroinflammation 17, 81 (2020).34.Zhang, Z., Jimi, E. & Bothwell, A.L. Receptor activator of NF-kappa B ligand stimulates recruitment of SHP-1 to the complex containing TNFR-associated factor 6 that regulates osteoclastogenesis. J Immunol 171, 3620-3626 (2003).35.Speranza, L., et al. Astaxanthin treatment reduced oxidative induced pro-inflammatory cytokines secretion in U937: SHP-1 as a novel biological target. Mar Drugs 10, 890-899 (2012).36.Srivastava, A.K., et al. Cerebral venous sinus thrombosis: developing an experimental model. J Neurosci Methods 161, 220-222 (2007).37.Li, J., et al. TGN-020 alleviates edema and inhibits astrocyte activation and glial scar formation after spinal cord compression injury in rats. Life Sci 222, 148-157 (2019).38.Dai, M., Chen, B., Wang, X., Gao, C. & Yu, H. Icariin enhance mild hypothermia-induced neuroprotection via inhibiting the activation of NF-kappaB in experimental ischemic stroke. Metab Brain Dis 36, 1779-1790 (2021).39.Ribeiro Mde, C., Hirt, L., Bogousslavsky, J., Regli, L. & Badaut, J. Time course of aquaporin expression after transient focal cerebral ischemia in mice. J Neurosci Res 83, 1231-1240 (2006).40.Sylvain, N.J., et al. The effects of trifluoperazine on brain edema, aquaporin-4 expression and metabolic markers during the acute phase of stroke using photothrombotic mouse model. Biochim Biophys Acta Biomembr 1863, 183573 (2021).41.Dong, X., et al. Physcion Protects Rats Against Cerebral Ischemia-Reperfusion Injury via Inhibition of TLR4/NF-kB Signaling Pathway. Drug Des Devel Ther 15, 277-287 (2021).42.Lu, H., Hu, H. & He, Z.P. Reperfusion of the rat brain tissues following acute ischemia: the correlation among diffusion-weighted imaging, histopathology, and aquaporin-4 expression. Chin Med J (Engl) 124, 3148-3153 (2011).43.Bai, X., Zhang, Y.L. & Liu, L.N. Inhibition of TRIM8 restrains ischaemia-reperfusion-mediated cerebral injury by regulation of NF-kappaB activation associated inflammation and apoptosis. Exp Cell Res 388, 111818 (2020).44.Zhang, D.D., et al. A novel IL-1RA-PEP fusion protein with enhanced brain penetration ameliorates cerebral ischemia-reperfusion injury by inhibition of oxidative stress and neuroinflammation. Exp Neurol 297, 1-13 (2017).45.Liang, W., et al. Interleukin-5 deletion promotes sepsis-induced M1 macrophage differentiation, deteriorates cardiac dysfunction, and exacerbates cardiac injury via the NF-kappaB p65 pathway in mice. Biofactors 46, 1006-1017 (2020).46.Jung, C.S., Lange, B., Zimmermann, M. & Seifert, V. CSF and Serum Biomarkers Focusing on Cerebral Vasospasm and Ischemia after Subarachnoid Hemorrhage. Stroke Res Treat 2013, 560305 (2013).47.Zhao, X., et al. DCA Protects against Oxidation Injury Attributed to Cerebral Ischemia-Reperfusion by Regulating Glycolysis through PDK2-PDH-Nrf2 Axis. Oxid Med Cell Longev 2021, 5173035 (2021).48.Walberer, M., et al. Aggravation of infarct formation by brain swelling in a large territorial stroke: a target for neuroprotection? J Neurosurg 109, 287-293 (2008).49.Li, Y., et al. Combined Use of Emodin and Ginsenoside Rb1 Exerts Synergistic Neuroprotection in Cerebral Ischemia/Reperfusion Rats. Front Pharmacol 9, 943 (2018).50.Aoki, K., et al. Enhanced expression of aquaporin 4 in human brain with infarction. Acta Neuropathol 106, 121-124 (2003).51.Chen, T., et al. The protective effect of CDDO-Me on lipopolysaccharide-induced acute lung injury in mice. Int Immunopharmacol 25, 55-64 (2015).52.Shi, Y., et al. C5aR1 Mediates the Progression of Inflammatory Responses in the Brain of Rats in the Early Stage after Ischemia and Reperfusion. ACS Chem Neurosci 12, 3994-4006 (2021).53.Tsui, H.W., Hasselblatt, K., Martin, A., Mok, S.C. & Tsui, F.W. Molecular mechanisms underlying SHP-1 gene expression. Eur J Biochem 269, 3057-3064 (2002).54.Anogeianaki, A., et al. Atherosclerosis: a classic inflammatory disease. Int J Immunopathol Pharmacol 24, 817-825 (2011).55.Guillermet-Guibert, J., et al. Novel synergistic mechanism for sst2 somatostatin and TNFalpha receptors to induce apoptosis: crosstalk between NF-kappaB and JNK pathways. Cell Death Differ 14, 197-208 (2007).56.Christophi, G.P., et al. Macrophages of multiple sclerosis patients display deficient SHP-1 expression and enhanced inflammatory phenotype. Lab Invest 89, 742-759 (2009).57.Christophi, G.P., Hudson, C.A., Panos, M., Gruber, R.C. & Massa, P.T. Modulation of macrophage infiltration and inflammatory activity by the phosphatase SHP-1 in virus-induced demyelinating disease. J Virol 83, 522-539 (2009).
神经外科主任,医学博士,主任医师,教授,博士研究生导师
现任中华医学会神经外科分会全国委员、脑血管外科学组委员、山东省神经外科分会副主任委员、脑血管病学科组组长;《中国临床神经外科杂志》和《中华神经外科疾病研究杂志》编委,《中华神经外科杂志》英文版编委、《Neursurgery》中文版编委
目前已行颅内动脉瘤显微夹闭手术3000余例,其技术达国内先进水平;在国内首次提出“鞍区四个解剖间隙”的中文命名,论文被引用率高达60余次。在国际上首创自体硬脑膜包裹技术结合窗式动脉瘤夹成功处理血泡样动脉瘤,取得了非常好的临床疗效
以第一作者和通讯作者发表论文89篇(中华级论著24篇、SCI论文24篇、国家及其它论著41篇)、获省市科研成果奖5项,主持各级课题10余项,在研国家自然科学基金1项。出版论著4部、主审译著4部。获荣誉称号:青岛市市南区专业技术拔尖人才、青岛市专业技术拔尖人才、青岛市优秀临床医学专家等。2014-2018年连续入选“中国名医百强榜”动脉瘤组及颅咽管瘤组全国十强、“华医纵横榜—中国最具影响力医生排行榜”等权威榜单,在国内同行中拥有较高知名度













