作者:Lei Li 同济大学博士后
缺血性脑卒中是世界范围内导致死亡和长期残疾的主要原因,目前针对中枢神经系统缺血的治疗方法主要集中在导致缺血性损伤的机制上,即兴奋性毒性、氧化应激和炎症(1,2)。然而,迄今为止,针对谷氨酸受体、γ-氨基丁酸(GABA)受体、钙通道、钠通道和自由基的临床试验都以失败告终。治疗选择的缺乏与我们对疾病潜在机制的了解不足直接相关。由于大脑已经发展出了自我保护的内在机制,因此深入了解这些保护机制可能会提供新的缺血性脑损伤的治疗靶点。
既往研究报道提示,在体内使用遗传学方法过表达或外源性添加脑源性神经营养因子(brain-derived neurotrophic factor, BDNF)均可以减少脑卒中导致的细胞死亡和缺血核心的体积,恢复神经系统功能;而抑制BDNF会加剧缺血性损伤(3,4)。然而,BDNF的参与机制目前仍不清楚。
来自瑞士苏黎世大学药理学和毒理学研究所的Shiva K. Tyagarajan教授课题组开展了此项研究,评估了缺血性脑损伤触发的生理机制,探索了BDNF在缺血性脑损伤后的组织修复和神经网络重塑中的作用,相关研究成果于2022年03月04日发表在Science Advances杂志(IF=14.146)上,题为“Cross-talk between GABAergic postsynapse and microglia regulate synapse loss after brain ischemia”。Shiva K. Tyagarajan教授等人发现:中枢神经系统缺血性损伤后,小胶质细胞来源的BDNF可作为介导小胶质细胞与神经元间通讯的信号转导因子,激活ERK1/2和GSK3β通路,通过桥尾蛋白(gephyrin)磷酸化影响谷氨酸能和 GABA能突触的完整性。


Shiva K. Tyagarajan就职于瑞士苏黎世大学药理学和毒理学研究所,其实验室在神经发育药理学方向展开了细致的研究,主要内容包括突触可塑性、细胞与分子神经科学等。近年来相关研究工作发表于Nature Methods (2022)、Science Advances (2022)、Science (2021)等。
https://www.imperial.nhs.uk/consultant-directory/simone-di-giovanni;
https://www.imperial.ac.uk/people/s.di-giovanni
首先,通过使用体外海马切片培养和糖氧剥夺(OGD)细胞缺血模型,研究者发现OGD引起谷氨酸和GABA能突触下调:在缺血后90min和24h,CA1锥体神经元的树突棘密度显著降低,突触后抑制性支架蛋白桥尾蛋白簇密度也显著降低;通过神经电生理手段监测证实了该形态学变化伴随着突触功能的缺陷(图1)。
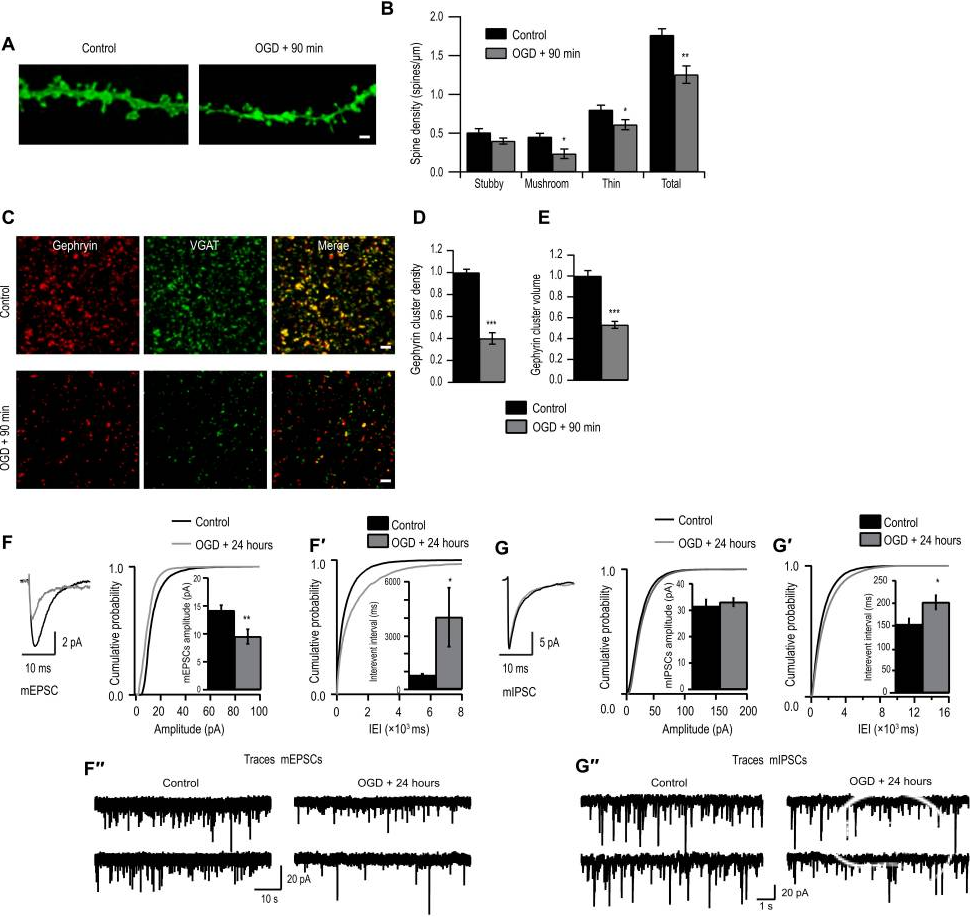
图1 OGD诱导兴奋性突触的形态和功能缺陷
接下来,在OGD造模后,使用嵌合的BDNF受体TrkB-Fc清除proBDNF和mBDNF,研究者发现可以挽救OGD所诱导的突触丢失,表明OGD 诱导的谷氨酸能和 GABA 能突触丢失的减少可能是由于 BDNF 的信号转导。随后研究者证实缺血后谷氨酸能突触丢失由BDNF的前体形式proBDNF通过p75NTR介导,而GABA能突触丢失则是由BDNF的成熟形式mBDNF通过TrkB受体诱导。
已知mBDNF以高亲和力与TrkB受体结合,研究者进一步探讨了OGD后TrkB 下游的 ERK1/2和 GSK3β信号级联是否会导致GABA能突触内桥尾蛋白簇的减少。结果发现,TrkB下游的ERK1/2和GSK3β通路将桥尾蛋白的第268位和第270位丝氨酸残基磷酸化,是OGD后GABA能突触丢失的决定因素。随后在体MCAO模型也重复了体外OGD诱导的突触丢失的结果,并利用CRISPR-Cas9技术建立了GphnS268A/S270A全局点突变的小鼠品系,进行MCAO造模后发现小鼠突触丢失显著减弱,更直接地证实了桥尾蛋白磷酸化在MCAO后24小时突触的改变中发挥着核心调控作用,ERK1/2和GSK3β作为下游效应分子参与调控MCAO后桥尾蛋白支架稳定性以及谷氨酸能和GABA能突触完整性。
随后,作者在野生型(WT)和基因工程小鼠(BDNFwt/wt/CX3CR1CreERT2+/-、BDNFflox/flox/CX3CR1CreERT2 +/-)中进行MCAO造模,发现:MCAO后小胶质细胞释放的BDNF促进了突触丢失,并且小胶质细胞来源的BDNF在影响TrkB受体信号下游的桥尾蛋白磷酸化中发挥着核心作用。
最后,通过小胶质细胞的药理学耗竭、CRISPR-Cas9产生的GphnS268A/S270A突变小鼠和小胶质细胞的Bdnf基因敲除实验,研究者证明:小胶质细胞GphnS268A/S270A突变或Bdnf 缺失可以减轻 MCAO 造模导致的脑损伤;GphnS268A/S270A 突变可以阻断MCAO 后小胶质细胞内 BDNF 的增加;对GABAAR进行拮抗可以直接导致小胶质细胞的 proBDNF、 mBDNF和桥尾蛋白磷酸化的改变。
综上,研究者总结指出:该研究揭示了小胶质细胞、BDNF信号通路和桥尾蛋白磷酸化之间的直接联系,并是调节缺血性卒中后组织完整性和突触丢失的关键通路。阻止小胶质细胞释放BDNF或阻止桥尾蛋白在第268位和第270位丝氨酸残基的磷酸化可以在缺血损伤后24小时内防止突触丢失。小胶质细胞中Bdnf基因的靶向敲除或GphnS268A/S270A(磷酸化缺失)点突变可防止MCAO后缺血性脑损伤、神经炎症和突触下调。

图2 MCAO后24小时通过proBDNF和mBDNF促进谷氨酸能和GABA能突触丢失的炎症、小胶质细胞桥尾蛋白(gephyrin)和突触桥尾蛋白相互联系的通路概述;(1)GABA能突触后神经元内桥尾蛋白第268/270位丝氨酸残基的磷酸化和(或)小胶质细胞内GABA依赖的桥尾蛋白第268/270位丝氨酸残基的磷酸化导致缺血诱导的突触丢失。GphnS268A/S270A突变小鼠MCAO后小胶质细胞活化降低;BV2细胞经BIC处理后,桥尾蛋白磷酸化增加,proBDNF和mBDNF水平升高;(2)激活的小胶质细胞释放proBDNF和mBDNF,分别作用于其同源受体p75NTR和TrkB;(3)proBDNF经由p75NTR激活RhoA/Rac1通路进行肌动蛋白重塑和树突棘丢失,触发小胶质细胞辅助的VGLUT剥离;(4) TrkB受体下游的ERK1/2和GSK3β通路被激活,分别磷酸化桥尾蛋白的Ser268和Ser270残基;(5)桥尾蛋白在Ser268和Ser270的磷酸化通过钙蛋白酶-1裂解导致桥尾蛋白支架丢失,促进GABAAR内化和小胶质细胞辅助GABA能末梢的替换。该机制概述了缺血后24小时同侧和对侧的兴奋性和抑制性突触丢失的过程。
原文献及全文链接:
Cramer, T., Gill, R., Thirouin, Z. S., Vaas, M., Sampath, S., Martineau, F., Noya, S. B., Panzanelli, P., Sudharshan, T., Colameo, D., Chang, P. K., Wu, P. Y., Shi, R., Barker, P. A., Brown, S. A., Paolicelli, R. C., Klohs, J., McKinney, R. A., & Tyagarajan, S. K. Cross-talk between GABAergic postsynapse and microglia regulate synapse loss after brain ischemia. Science advances, 8(9), eabj0112 (2022). https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8896802/
参考文献:
1. Brouns R., Deyn P. P. D., The complexity of neurobiological processes in acute ischemic stroke. Clin Neurol Neurosur. 111, 483–495 (2009).
2. Lakhan S. E., Kirchgessner A., Hofer M., Inflammatory mechanisms in ischemic stroke: Therapeutic approaches. J. Transl. Med. 7, 97 (2009).
3. Yu S.-J., Tseng K.-Y., Shen H., Harvey B. K., Airavaara M., Wang Y., Local administration of AAV-BDNF to subventricular zone induces functional recovery in stroke rats. Plos One. 8, e81750 (2013).
4. Schäbitz W.-R., Steigleder T., Cooper-Kuhn C. M., Schwab S., Sommer C., Schneider A., Kuhn H. G., Intravenous brain-derived neurotrophic factor enhances poststroke sensorimotor recovery and stimulates neurogenesis. Stroke 38, 2165–2172 (2007).
在招岗位
2022 RECRUIT /
招募编译团队及审稿团队
岗位职责:撰写、审阅神经科学各领域的文献导读、领域速报。
岗位要求:神经科学领域四年级以上的博士生、博士后以及青年科研工作者。
AiBrain作者团队由海内外知名高校博士生、博士后,及已成立实验室的PI们组成;加入AiBrain,可以体验专业的投审稿系统、高效温馨的团队合作、丰富的文章栏目,以及有竞争力的丰厚报酬;能力突出者可以作为领域/栏目负责人,并配有岗位津贴。
欢迎有意者投递简历及个人作品!

微信号:AiBrainzhushou
邮箱:ai_brain@163.com


声明:脑医汇旗下神外资讯、神介资讯、脑医咨询、AiBrain所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享




